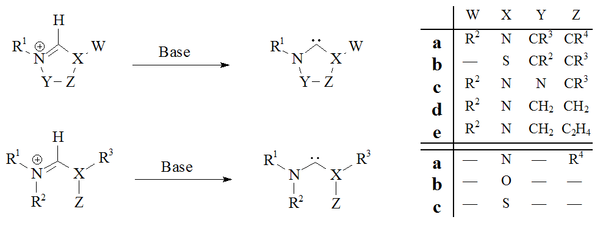
Carbeno persistente - Persistent carbene
Um carbeno persistente (também conhecido como carbeno estável ) é um tipo de carbeno que demonstra estabilidade particular. Os exemplos mais conhecidos e por maior subgrupo agora são os carbenos N-heterocíclicos (NHC) (por vezes chamados de carbenos Arduengo ), por exemplo diaminocarbenes com a fórmula geral (R 2 N) 2 C : , onde os 'de R são tipicamente alquilo e grupos aril. Os grupos podem ser ligados para dar carbenos heterocíclicos , tais como aqueles derivados de imidazol , imidazolina , tiazol ou triazol .
Tradicionalmente, os carbenos são vistos como tão reativos que foram estudados apenas indiretamente, por exemplo, por reações de aprisionamento. Essa situação mudou dramaticamente com o surgimento de carbenos persistentes. Embora sejam substâncias bastante reativas, ou seja, em fase de dimerização , muitas podem ser isoladas como substâncias puras.
Os carbenos persistentes tendem a existir no singlete . Sua estabilidade é apenas parcialmente devido ao impedimento estérico de grupos volumosos. Alguns carbenos singuletos são termodinamicamente estáveis e podem ser isolados e armazenados indefinidamente. Outros dimerizam lentamente ao longo dos dias. Os carbenos de estado tripleto têm meia-vida medida em segundos e, portanto, podem ser observados, mas não armazenados.
História
Evidência inicial
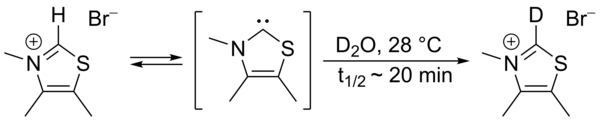
Em 1957, Ronald Breslow propôs que um carbeno nucleofílico relativamente estável , um derivado do tiazol-2-ilideno , estava envolvido no ciclo catalítico da vitamina B 1 (tiamina) que produz furoína do furfural . Nesse ciclo, o anel de tiazólio da vitamina troca um átomo de hidrogênio (ligado ao carbono 2 do anel) por um resíduo de furfural. Na água deuterada , o próton C2 foi encontrado para trocar rapidamente por um deuteron em um equilíbrio estatístico .
Esta troca foi proposta para ocorrer por intermédio de um tiazol-2-ilideno. Em 2012, foi relatado o isolamento do denominado intermediário de Breslow .
Em 1960, Hans-Werner Wanzlick e colaboradores conjeturaram que carbenos derivados de dihidroimidazol-2-ilideno foram produzidos por pirólise a vácuo dos correspondentes compostos de 2-triclorometil dihidroimidazol com a perda de clorofórmio . Eles conjecturou que o carbeno existia em equilíbrio com o seu dímero , um tetraaminoethylene derivado, o chamado equilíbrio Wanzlick . Esta conjectura foi contestada por Lemal e colaboradores em 1964, que apresentaram evidências de que o dímero não se dissocia; e por Winberg em 1965. No entanto, experimentos subsequentes de Denk, Herrmann e outros confirmaram esse equilíbrio, embora em circunstâncias específicas.
Isolamento de carbenos persistentes
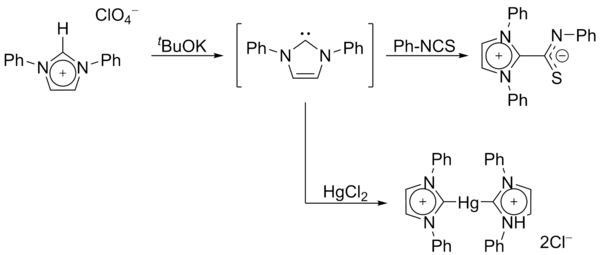
Em 1970, o grupo de Wanzlick gerou carbenos de imidazol-2-ilideno pela desprotonação de um sal de imidazólio . Wanzlick, assim como Roald Hoffmann , propôs que esses carbenos à base de imidazol deveriam ser mais estáveis do que seus análogos 4,5-dihidro, devido à aromaticidade do tipo Hückel . Wanzlick, entretanto, não isolou imidazol-2-ilidenos, mas em vez disso, seus compostos de coordenação com mercúrio e isotiocianato :
Em 1988, Guy Bertrand e outros isolaram um fosfinocarbeno . Estas espécies podem ser representadas como um λ 3 -fosfinocarbeno ou λ 5 - fosfacetileno :
Esses compostos foram chamados de "carbenos push-pull" em referência às afinidades eletrônicas contrastantes dos átomos de fósforo e silício. Eles exibem reatividade carbênica e alcínica . Uma estrutura de raios-X desta molécula não foi obtida e no momento da publicação algumas dúvidas permaneceram quanto à sua natureza carbênica exata.
Em 1991, Arduengo e colegas de trabalho cristalizaram um diaminocarbeno por desprotonação de um cátion imidazólio:
Este carbeno, o precursor de uma grande família de carbenos com o núcleo imidazol-2-ilideno, é indefinidamente estável à temperatura ambiente na ausência de oxigênio e umidade. Ele derrete a 240–241 ° C sem decomposição. Os 13 C Espectro de RMN mostra um sinal a 211 ppm para o átomo de carbenic. A estrutura de raios-X revelou comprimentos de ligação N – C mais longos no anel do carbeno do que no composto de imidazólio parental, indicando que havia muito pouco caráter de ligação dupla nessas ligações.
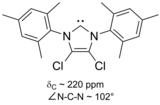
O primeiro carbeno ilídico estável ao ar, um membro clorado da família imidazol-2-ilideno, foi obtido em 1997.
Em 2000, Bertrand obteve carbenos adicionais do tipo fosfanil, incluindo (fosfanil) (trifluorometil) carbeno, estável em solução a -30 ° C e um (amino) (aril) carbeno moderadamente estável com apenas um heteroátomo adjacente ao átomo carbênico.
Fatores que afetam a estabilidade de carbenos estabilizados por heteroátomo

( Veja a estrutura 3D com visualizador externo )
A estabilidade de carbenos Arduengo foi inicialmente atribuído às N- volumosos adamantilo substituintes, o que impede o carbeno de dimerising devido a impedimento estérico . A substituição dos grupos N-adamantilo por grupos metil também fornece NHCs estáveis. Assim, os imidazol-2-ilidenos são termodinamicamente estáveis .
Também havia sido conjecturado que a dupla ligação entre os carbonos 4 e 5 da estrutura do anel imidazólio, que conferia caráter aromático àquele sistema, era importante para a estabilidade do carbeno. Essa conjectura foi refutada em 1995 pelo grupo de Arduengo, que obteve um derivado do diidroimidazol-2-ilideno , sem a ligação dupla. A estabilidade termodinâmica neste composto, e o papel da proteção estérica na prevenção da dimerização, tem sido um tópico de alguma disputa.
O primeiro carbeno persistente acíclico foi relatado em 1996, mostrando que um backbone cíclico não era necessário para sua estabilidade. Ao contrário dos derivados cíclicos, os carbenos acíclicos são flexíveis no que diz respeito à rotação das ligações ao átomo carbênico. Ao medir a barreira à rotação dessas ligações, a extensão de seu caráter de ligação dupla pode ser medida, e a natureza ilídica desse carbeno pode ser determinada. Como os diaminocarbenos cíclicos, as variantes livres tendem a dimerizar.
A maioria dos carbenos persistentes são estabilizados por dois centros de nitrogênio flanqueadores. O aminotiocarbeno e um aminooxicarbeno são outliers. e um. Nestes compostos estáveis, o átomo carbênico fica entre um átomo de nitrogênio e um átomo de enxofre ou oxigênio:
Ao contrário dos NHCs, esses carbenos não são termodinamicamente estáveis, mas tendem a dimerizar.
No bis (diisopropilamino) ciclopropenilideno , que é estável à temperatura ambiente, o átomo de carbeno é conectado a dois átomos de carbono, em um anel de três membros que retém a aromaticidade e a geometria do anel de ciclopropenilideno . Este exemplo demonstrou que a presença de heteroátomos próximos ao carbeno também não é necessária para a estabilidade.
Classes de carbenos estáveis
A seguir estão exemplos das classes de carbenos estáveis isolados até o momento:
Imidazol-2-ilidenos
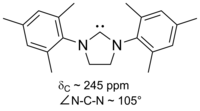
Os primeiros carbenos estáveis a serem isolados baseavam-se em um anel imidazol , com o hidrogênio no carbono 2 do anel (entre os dois átomos de nitrogênio) removido e outros hidrogênios substituídos por vários grupos. Esses imidazol-2-ilidenos ainda são os mais estáveis e a família de carbenos persistentes mais bem estudada e compreendida.
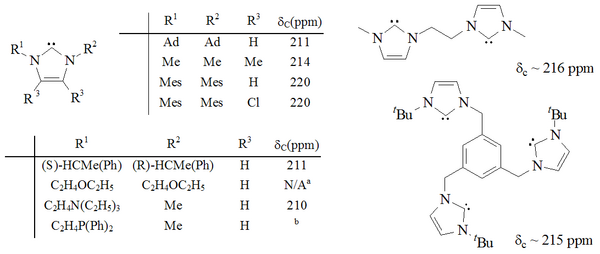
Uma gama considerável de imidazol-2-ilidenos foi sintetizada, incluindo aqueles em que as posições 1,3 foram funcionalizadas com alquil , aril , alquiloxi, alquilamino, alquilfosfino e até substituintes quirais :
( Visualize a estrutura 3D com visualizador externo. )
Em particular, a substituição de dois átomos de cloro pelos dois hidrogênios nas posições 4 e 5 do anel produziu o primeiro carbeno estável ao ar. Sua estabilidade extra provavelmente resulta do efeito de retirada de elétrons dos substituintes de cloro , que reduzem a densidade de elétrons no átomo de carbono que carrega o par solitário , via indução através do esqueleto sigma.
Também foram sintetizadas moléculas contendo dois e até três grupos imidazol-2-ilideno.
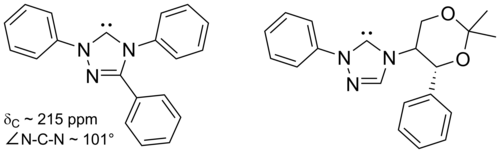
Os carbenos à base de imidazol são termodinamicamente estáveis e geralmente têm valores de desvio químico de 13 C NMR diagnósticos entre 210 e 230 ppm para o carbono carbênico. Normalmente, as estruturas de raios-X dessas moléculas mostram ângulos de ligação NCN de 101–102 °.
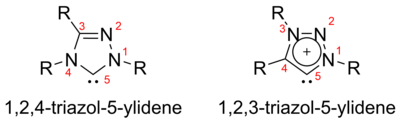
Triazol-5-ilidenos
Dependendo do arranjo dos três átomos de nitrogênio no triazol-5-ilideno, existem dois isômeros possíveis, a saber, 1,2,3-triazol-5-ilidenos e 1,2,4-triazol-5-ilidenos.
Os triazol-5-ilidenos com base no anel 1,2,4-triazol são ilustrados abaixo e foram primeiro preparados por Enders e colaboradores por pirólise a vácuo através da perda de metanol de 2-metoxitriazóis. Apenas uma gama limitada dessas moléculas foi relatada, com a molécula substituída por trifenila sendo comercialmente disponível.
Os carbenos à base de triazol são termodinamicamente estáveis e têm valores de desvio químico de 13 C NMR de diagnóstico entre 210 e 220 ppm para o carbono carbênico. A estrutura de raios-X do carbeno substituído com trifenil acima mostra um ângulo de ligação NCN de ca. 101 °. O precursor de 5-metoxitriazol desse carbeno foi feito pelo tratamento de um sal de triazólio com metóxido de sódio, que ataca como um nucleófilo . Isso pode indicar que esses carbenos são menos aromáticos do que os imidazol-2-ilidenos, pois os precursores do imidazólio não reagem com os nucleófilos devido à perda de aromaticidade resultante.
Outros diaminocarbenos
As duas famílias acima podem ser vistas como casos especiais de uma classe mais ampla de compostos que têm um átomo carbênico ligando dois átomos de nitrogênio. Uma série de tais diaminocarbenos foi preparada principalmente pelo grupo de pesquisa de Roger Alder . Em alguns desses compostos, a unidade NCN é um membro de um anel não aromático de 5 ou 6 membros, incluindo um exemplo bicíclico. Em outros exemplos, os nitrogênios adjacentes são conectados apenas através do átomo carbênico e podem ou não fazer parte de anéis separados.
Ao contrário dos imidazol-2-ilidenos ou triazol-5-ilidenos aromáticos, estes carbenos parecem não ser termodinamicamente estáveis, como mostrado pela dimerização de alguns exemplos cíclicos e acíclicos não impedidos. Estudos sugerem que esses carbenos se dimerizam via dimerização catalisada por ácido (como no equilíbrio de Wanzlick ).
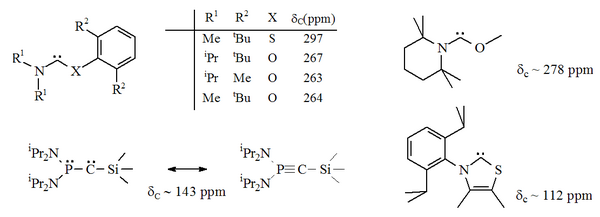
Os diaminocarbenos têm valores de desvio químico de 13 C NMR diagnósticos entre 230 e 270 ppm para o átomo carbênico. A estrutura de raios-X do di-hidroimidazol-2-ilideno mostra um ângulo de ligação NCN de ca. 106 °, enquanto o ângulo do carbeno acíclico é 121 °, ambos maiores do que aqueles observados para os imidazol-2-ilidenos.
Heteroamino carbenos
Existem várias variantes dos carbenos estáveis acima, onde um dos átomos de nitrogênio adjacentes ao centro do carbeno (os nitrogênios α ) foi substituído por um heteroátomo alternativo, como oxigênio, enxofre ou fósforo .
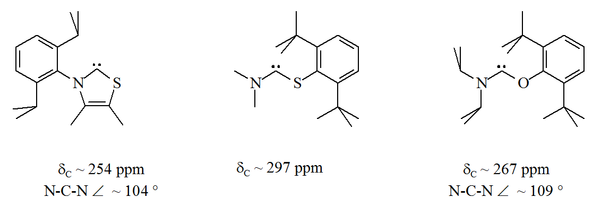
Em particular, a substituição formal de enxofre por um dos nitrogênios no imidazol produziria o composto heterocíclico aromático tiazol . Um carbeno à base de tiazol (análogo ao carbeno postulado por Breslow) foi preparado e caracterizado por cristalografia de raios-X. Outros aminocarbenos não aromáticos com átomos de O, S e P adjacentes (isto é, alfa) ao centro do carbeno foram preparados, por exemplo, carbenos à base de tio e oxiimínio foram caracterizados por cristalografia de raios-X.
Como o oxigênio e o enxofre são divalentes , a proteção estérica do centro carbênico é limitada, especialmente quando a unidade NCX faz parte de um anel. Esses carbenos acíclicos têm valores de desvio químico de 13 C NMR diagnósticos entre 250 e 300 ppm para o carbono carbênico, mais abaixo do campo do que qualquer outro tipo de carbeno estável. As estruturas de raios-X mostraram ângulos de ligação NCX de ca. 104 ° e 109 ° respectivamente.
Carbenos que formalmente derivam de imidazol-2-ilidenos por substituição de enxofre, oxigênio ou outros calcogênios por ambos os α- nitrogênios devem ser instáveis, pois têm o potencial de se dissociar em um alcino (R 1 C≡CR 2 ) e um dichalcogeneto de carbono (X 1 = C = X 2 ).
Não-amino carbenos
A reação de dissulfeto de carbono (CS 2 ) com derivados de acetileno deficientes em elétrons é proposta para dar carbenos de 1,3-ditiolium transitórios (isto é, onde X 1 = X 2 = S), que então se dimerizam para dar derivados de tetratiafulveno . Assim, é possível que o inverso desse processo esteja ocorrendo em carbenos semelhantes.
Carbenos de Bertrand
Nos carbenos persistentes de Bertrand, o carbono insaturado está ligado a um fósforo e a um silício . No entanto, esses compostos parecem exibir algumas propriedades alcínicas e, quando publicado, a natureza carbênica exata desses óleos vermelhos estava em debate.
Outros carbenos nucleofílicos
Um carbeno N-heterocíclico estável tem uma estrutura análoga à borazina com um átomo de boro substituído por um grupo metileno . Isso resulta em um composto planar de 6 elétrons.

Ciclopropenilidenos
Outra família de carbenos é baseada em um núcleo de ciclopropenilideno , um anel de três carbonos com uma ligação dupla entre os dois átomos adjacentes ao carbênico. Esta família é exemplificada por bis (diisopropilamino) ciclopropenilideno .
Carbenos de estado tripleto
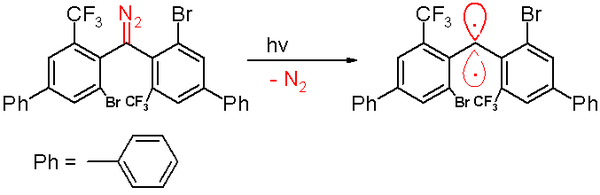
Em 2001, Hideo Tomioka e seus associados foram capazes de produzir um carbeno tripleto comparativamente estável ( bis (9-antril) carbeno , com meia-vida de 19 minutos), tirando proveito da deslocalização de elétrons .
Em 2006, um carbeno tripleto foi relatado pelo mesmo grupo com meia-vida de 40 minutos. Este carbeno é preparado por uma decomposição fotoquímica de um precursor de diazometano por 300 nanômetros de luz em benzeno com expulsão de gás nitrogênio .
A exposição ao oxigênio (um diradical tripleto) converte esse carbeno na benzofenona correspondente . O composto difenilmetano é formado quando é capturado pelo ciclohexa-1,4-dieno . Tal como acontece com os outros carbenos, esta espécie contém substituintes grandes e volumosos, nomeadamente bromo e os grupos trifluorometil nos anéis fenil, que protegem o carbeno e previnem ou abrandam o processo de dimerização para um 1,1,2,2-tetra (fenil ) alceno. Com base em simulações de computador , a distância do átomo de carbono divalente a seus vizinhos é de 138 picômetros com um ângulo de ligação de 158,8 °. Os planos dos grupos fenil estão quase em ângulos retos entre si (o ângulo diedro sendo 85,7 °).
Carbenos mesoiônicos
Os carbenos mesoiônicos (MICs) são semelhantes aos carbenos N-heterocíclicos (NHCs), exceto que as estruturas de ressonância canônica com o carbeno representado não podem ser desenhadas sem adicionar cargas adicionais. Os carbenos mesoiônicos também são referidos como carbenos N-heterocíclicos anormais (aNHC) ou carbenos N-heterocíclicos remotos (rNHC). Uma variedade de carbenos livres pode ser isolada e são estáveis à temperatura ambiente. Outros carbenos livres não são estáveis e são suscetíveis às vias de decomposição intermolecular.
Propriedades quimicas
Basicidade e nucleofilicidade
Os imidazol-2-ilidenos são bases fortes, tendo um pKa de ca. 24 para o ácido conjugado em dimetilsulfóxido (DMSO):
No entanto, trabalhos posteriores mostraram que os diaminocarbenos irão desprotonar o solvente DMSO, com o ânion resultante reagindo com o sal de amidínio resultante.
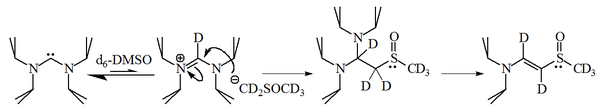
A reação de imidazol-2-ilidenos com 1 -bromohexano deu 90% do aduto 2-substituído, com apenas 10% do alceno correspondente , indicando que essas moléculas também são razoavelmente nucleofílicas .
Os valores de pKa para os ácidos conjugados de várias famílias de NHC foram examinados em solução aquosa. Os valores de pKa dos íons triazólio estão na faixa de 16,5 - 17,8, cerca de 3 unidades pKa mais ácidas do que os íons imidazólio relacionados.
Dimerização
Ao mesmo tempo, pensava-se que os carbenos estáveis se dimerizavam reversivelmente por meio do chamado equilíbrio de Wanzlick . No entanto, os imidazol-2-ilidenos e os triazol-5-ilidenos são termodinamicamente estáveis e não se dimerizam, e foram armazenados em solução na ausência de água e ar por anos. Presumivelmente, isso se deve à natureza aromática desses carbenos, que se perde na dimerização. Na verdade, os imidazol-2-ilidenos são tão termodinamicamente estáveis que apenas em condições altamente restritas esses carbenos são forçados a se dimerizar.
Chen e Taton fizeram um diimidazol-2-ilideno duplamente amarrado por desprotonação do respectivo sal de diimidazólio. Apenas a desprotonação do sal de diimidazólio duplamente amarrado com a ponte de metileno mais curta (-CH 2 -) resultou no dímero de dicarbeno:
Se este dímero existisse como um dicarbeno, os pares de elétrons isolados no carbono carbênico seriam forçados a se aproximarem. Presumivelmente, as interações eletrostáticas repulsivas resultantes teriam um efeito desestabilizador significativo. Para evitar essa interação eletrônica, as unidades de carbeno se dimerizam.
Por outro lado, heteroamino carbenos ( por exemplo, R 2 N-C: -OR ou R 2 N-C: -SR) e carbenos não aromáticos, como diaminocarbenos ( por exemplo, R 2 N-C: -NR 2 ) mostraram dimerizar, embora muito lentamente . Presume-se que isso seja devido à alta barreira à dimerização de estado singleto :
Os diaminocarbenos não dimerizam verdadeiramente, mas formam o dímero por reação via sais de formamidínio , uma espécie precursora protonada. Consequentemente, esta reação pode ser catalisada por ácido. Essa reação ocorre porque, ao contrário dos carbenos à base de imidazólio, não há perda de aromaticidade na protonação do carbeno.
Ao contrário da dimerização de carbenos de estado tripleto , estes carbenos de estado singlete não se aproximam cabeça a cabeça ("menos movimento"), mas sim o par solitário de carbeno ataca o orbital p de carbono vazio ("não menos movimento"). A dimerização do carbeno pode ser catalisada por ácidos e metais.
Reatividade
A química dos carbenos estáveis não foi totalmente explorada. No entanto, Enders et al.
have performed a range of organic reactions involving a triazol-5-ylidene. These reactions are outlined below and may be considered as a model for other carbenes.

| uma | 3,6-difenil-1,2,4,5-tetrazina, tolueno | 92% | e | 2 equiv., PhNCO, tolueno, refluxo | 92% | |
|---|---|---|---|---|---|---|
| b | RXH, RT | 95-97% | f | CS 2 , tolueno ou PhNCS, THF, RT | 71-90% | |
| c | O 2 , S 8 ou Se, tolueno, refluxo | 54-68% | g | Maleimida, THF, RT | 47–84% | |
| d | R 1 CH = CHR 2 , THF, RT | 25–68% | h | Dicarboxilato de dimetilacetileno, THF, refluxo | 21% |
Esses carbenos tendem a se comportar de forma nucleofílica ( e e f ), realizando reações de inserção ( b ), reações de adição ( c ), [2 + 1] cicloadições ( d , g e h ), [4 + 1] cicloadições ( a ), bem como desprotonações simples . As reacções de inserção ( B ) provavelmente prosseguir através de desprotonação, resultando na geração de um nucleófilo ( - XR), que pode atacar o sal gerado dando a impressão de uma inserção HX.
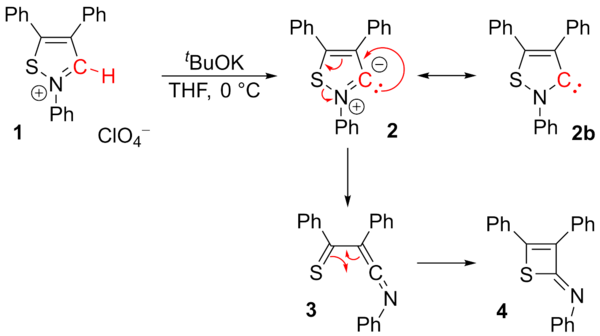
O carbeno de isotiazol estável relatado ( 2b ) derivado de um perclorato de isotiazólio ( 1 ) foi questionado. Os pesquisadores só foram capazes de isolar 2-imino-2H-tieto ( 4 ). O intermediário 3 foi proposto por meio de uma reação de rearranjo . O carbeno 2b não é mais considerado estável.
Complexação de Carbene
Imidazol-2-ilidenos, triazol-5-ilidenos (e menos, diaminocarbenos) foram mostrados para coordenar a uma infinidade de elementos, de metais alcalinos , elementos do grupo principal , metais de transição e até mesmo lantanídeos e actinídeos . Uma tabela periódica de elementos dá uma ideia dos complexos que foram preparados e, em muitos casos, foram identificados por cristalografia de raios-X de cristal único . Acredita-se que os carbenos estáveis se comportam de maneira semelhante às organofosfinas em suas propriedades de coordenação com os metais. Esses ligantes são considerados bons doadores de σ através do par carbênico solitário , mas pobres aceitadores de π devido à doação de ligante interno dos átomos de nitrogênio adjacentes ao centro de carbeno e, portanto, são capazes de coordenar até mesmo relativamente ao elétron metais deficientes. Enders e Hermann mostraram que esses carbenos são substitutos adequados para ligantes de fosfina em vários ciclos catalíticos . Embora eles tenham descoberto que esses ligantes não ativam o catalisador de metal tanto quanto os ligantes de fosfina, eles geralmente resultam em catalisadores mais robustos. Vários sistemas catalíticos foram investigados por Hermann e Enders, usando catalisadores contendo ligantes de imidazol e triazol carbeno, com sucesso moderado. Grubbs relatou a substituição de um ligante de fosfina (PCy 3 ) por um imidazol-2-ilideno no catalisador de metátese de olefina RuCl 2 (PCy 3 ) 2 CHPh e observou um aumento da metátese de fechamento do anel, bem como exibindo "uma notável estabilidade ao ar e à água" . Moléculas contendo duas e três porções de carbeno foram preparadas como ligantes de carbeno potenciais bidentados e tridentados .
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Período |
|
|||||||||||||||||||
| 1 | 1 H |
|
2 Ele |
|||||||||||||||||
| 2 | 3 Li |
4 Ser |
|
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
|||||||||||
| 3 | 11 N / D |
12 Mg |
|
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
|||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 Como |
34 Se |
35 Br |
36 Kr |
||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 CD |
49 No |
50 Sn |
51 Sb |
52 Te |
53 eu |
54 Xe |
||
| 6 | 55 Cs |
56 BA |
|
71 Lu |
72 Hf |
73 Ta |
74 C |
75 Ré |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 No |
86 Rn |
|
| 7 | 87 Fr |
88 Ra |
|
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|
|
|
||||||||||||||||||||
|
|
57 La |
58 Ce |
59 Pr |
60 WL |
61 PM |
62 Sm |
63 Eu |
64 D'us |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
||||||
|
|
89 Ac |
90 º |
91 Pa |
92 você |
93 Np |
94 Pu |
95 Sou |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 Não |
||||||
- Lenda
- Complexo Carbene com elemento conhecido
- Nenhum complexo de carbeno com elemento conhecido
Carbenos em química organometálica e catálise
Os carbenos podem ser estabilizados como espécies organometálicas . Esses complexos de carbeno de metal de transição se enquadram em duas categorias:
- Carbenos de Fischer em que carbenos são amarrados a um metal e um grupo de remoção de elétrons (geralmente um carbonil),
- Carbenos de Schrock ; em que carbenos são amarrados a um metal e um grupo doador de elétrons . As reações das quais esses carbenos participam são muito diferentes daquelas em que participam os carbenos orgânicos.
Química do carbeno no estado tripleto
É provável que carbenos de estado tripleto persistente tenham reatividade muito semelhante a outros carbenos de estado tripleto não persistente .
Propriedades físicas
Os carbenos que foram isolados até hoje tendem a ser sólidos incolores com baixos pontos de fusão. Esses carbenos tendem a sublimar em baixas temperaturas sob alto vácuo.
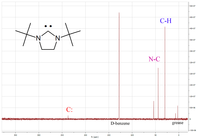
Uma das propriedades físicas mais útil é o desvio químico de diagnóstico do átomo de carbono carbenic na 13 C- RMN espectro. Tipicamente este pico está na gama de entre 200 e 300 ppm, em que alguns outros picos aparecem na 13 C- RMN espectro. Um exemplo é mostrado à esquerda para um diaminocarbeno cíclico que tem um pico carbênico a 238 ppm.
Após a coordenação para centros de metal, a ressonância do carbeno 13 C geralmente muda de campo alto, dependendo da acidez de Lewis do fragmento complexo. Com base nessa observação, Huynh et al. desenvolveu uma nova metodologia para determinar as forças do doador de ligante por análise de 13 C NMR de complexos trans- paládio (II) -carbeno. O uso de um 13 carbeno N-heterocíclico-C ligando marcado também permite o estudo de complexos de carbeno-fosfina mistos, que se submetem a trans - cis -isomerization devido ao efeito trans .
Formulários
NHCs são amplamente usados como ligantes auxiliares na química organometálica . Uma aplicação prática é o ruténio baseados Grubbs catalisador e NHC-paládio Complexos para reacções de acoplamento cruzado. Os complexos NHC-metal, especificamente os complexos Ag (I) -NHC, foram amplamente testados quanto às suas aplicações biológicas.
Métodos de preparação
Os NHCs são frequentemente fortemente básicos (o valor de pKa do ácido conjugado de um imidazol-2-ilideno foi medido a cerca de 24) e reagem com o oxigênio . É claro que essas reações são realizadas usando técnicas sem ar , evitando compostos de acidez mesmo moderada . Embora os sais de imidazólio sejam estáveis à adição nucleofílica , outros sais não aromáticos não são (isto é, sais de formamidínio ).
Nesses casos, nucleófilos fortes e desimpedidos são evitados, sejam eles gerados in situ ou estejam presentes como uma impureza em outros reagentes (por exemplo, LiOH em BuLi).
Várias abordagens foram desenvolvidas a fim de preparar carbenos estáveis, estas são descritas abaixo.
Deprotonação
A desprotonação de sais precursores de carbeno com bases fortes provou ser uma rota confiável para quase todos os carbenos estáveis:
Imidazol-2-ilidenos e dihidroimidazol-2-ilidenos, por exemplo , IMes , foram preparados pela desprotonação dos respectivos sais de imidazólio e dihidroimidazólio . Os carbenos acíclicos e os carbenos à base de tetra-hidropirimidinil foram preparados por desprotonação usando bases homogêneas fortes.
Várias bases e condições de reação têm sido empregadas com sucesso variável. O grau de sucesso depende principalmente da natureza do precursor sendo desprotonado. A principal desvantagem deste método de preparação é o problema de isolamento do carbeno livre dos íons de metais usados em sua preparação.
Bases de hidreto metálico
Pode-se acreditar que o hidreto de sódio ou potássio seria a base ideal para a desprotonação desses sais precursores. O hidreto deve reagir irreversivelmente com a perda de hidrogênio para dar o carbeno desejado, com os subprodutos inorgânicos e o excesso de hidreto sendo removidos por filtração. Na prática, esta reação é frequentemente muito lenta, exigindo a adição de DMSO ou t- BuOH . Esses reagentes geram catalisadores solúveis , que aumentam a velocidade de reação desse sistema heterogêneo, por meio da geração de ânion terc-butóxido ou dimsil . No entanto, esses catalisadores provaram ser ineficazes para a preparação de adutos não-imidazólio, pois eles tendem a agir como nucleófilos em relação aos sais precursores e, ao fazê-lo, são destruídos. A presença de íons hidróxido como impureza no hidreto metálico também pode destruir sais não aromáticos.
A desprotonação com hidreto de sódio ou potássio em uma mistura de amônia líquida / THF a -40 ° C foi relatada para carbenos à base de imidazol. Arduengo e colegas de trabalho conseguiram preparar um diidroimidazol-2-ilideno usando NaH. No entanto, este método não foi aplicado à preparação de diaminocarbenos. Em alguns casos, o terc-butóxido de potássio pode ser empregado sem a adição de um hidreto de metal.
Alquilítio
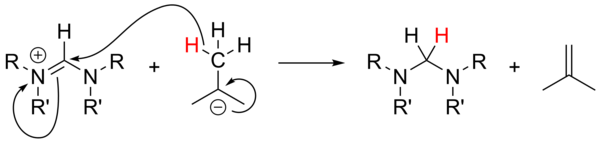
O uso de alquil-lítio como bases fortes não foi extensivamente estudado e não tem sido confiável para a desprotonação de sais precursores. Com sais não aromáticos, n-BuLi e PhLi podem atuar como nucleófilos, enquanto t-BuLi pode às vezes atuar como uma fonte de hidreto, reduzindo o sal com a geração de isobuteno :
Bases amidas
Amidas de lítio como a diisopropilamida (LDA) e ( tetrametilpiperidida (LiTMP) ) geralmente funcionam bem para a desprotonação de todos os tipos de sais, desde que não haja muito LiOH presente no n- butil-lítio usado para fazer a amida de lítio. A titulação da amida de lítio pode ser usada para determinar a quantidade de hidróxido na solução. A desprotonação de sais precursores com hexametildissilazidas metálicas funciona de forma muito limpa para a desprotonação de todos os tipos de sais, exceto para sais de formamidínio sem obstáculos, onde esta base pode atuar como um nucleófilo para dar um aduto de triaminometano.
Preparação de carbeno livre de metal

A preparação de carbenos estáveis livres de cátions metálicos tem sido intensamente procurada para permitir um estudo mais aprofundado das espécies de carbenos isoladas desses metais. Separar um carbeno de um complexo carbeno-metal pode ser problemático devido à estabilidade do complexo. Conseqüentemente, é preferível tornar o carbeno livre desses metais em primeiro lugar. Na verdade, alguns íons de metal, em vez de estabilizar o carbeno, foram implicados na dimerização catalítica de exemplos desimpedidos.
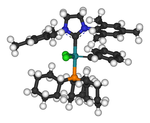
É mostrado à direita uma estrutura de raios-X mostrando um complexo entre um diaminocarbeno e potássio HMDS . Este complexo foi formado quando o excesso de KHMDS foi usado como uma base forte para desprotonar o sal de formamidínio . Remover íons de lítio resultantes da desprotonação com reagentes como diisopropilamida de lítio (LDA) pode ser especialmente problemático. Os subprodutos dos sais de potássio e sódio tendem a precipitar da solução e podem ser removidos. Os íons de lítio podem ser removidos quimicamente ligando-se a espécies como criptantes ou éteres de coroa .
Os carbenos livres de metal foram preparados de várias maneiras, conforme descrito abaixo:
Decalcogenação
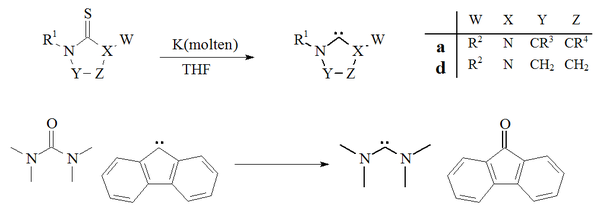
Outra abordagem de preparação de carbenos baseia-se na dessulfuração de tioureias com potássio em THF . Um fator que contribui para o sucesso dessa reação é que o subproduto, o sulfeto de potássio , é insolúvel no solvente. As temperaturas elevadas sugerem que este método não é adequado para a preparação de carbenos dimerizantes instáveis. Um único exemplo da desoxigenação de uma ureia com um carbeno derivado de fluoreno para dar tetrametildiaminocarbeno e fluorenona também foi relatado:
A dessulfuração de tioureias com potássio fundido para dar imidazol-2-ilidenos ou diaminocarbenos não tem sido amplamente utilizada. O método foi usado para preparar carbenos de diidroimidazol.
Pirólise a vácuo
A pirólise a vácuo, com a remoção de subprodutos neutros voláteis, ou seja, metanol ou clorofórmio, tem sido usada para preparar carbenos à base de dihidroimidazol e triazol. Historicamente, a remoção de clorofórmio por pirólise a vácuo dos adutos A foi usada por Wanzlick em suas primeiras tentativas de preparar diidroimidazol-2-ilidenos, mas este método não é amplamente utilizado. O laboratório de Enders usou a pirólise a vácuo do aduto B para gerar um triazol-5-ilideno.
Bis (trimetilsilil) mercúrio
Bis (trimetilsilil) mercúrio (CH 3 ) 3 Si-Hg-Si (CH 3 ) 3 reage com sais de cloro- imínio e cloro- amidínio para dar um carbeno livre de metal e mercúrio elementar . Por exemplo, (CH 3 ) 3 Si-Hg-Si (CH 3 ) 3 + R 2 N = C (Cl) -NR 2 + Cl - → R 2 N-C: -NR 2 + Hg (l) + (CH 3 ) 3 Si-Cl
Decomposição fotoquímica
Os carbenos de estado tripleto persistente foram preparados por decomposição fotoquímica de um produto diazometano por meio da expulsão de gás nitrogênio , em um comprimento de onda de 300 nm em benzeno.
Purificação
Os carbenos estáveis são muito reativos e, portanto, o mínimo de manuseio é desejável usando técnicas sem ar . No entanto, desde que sejam usados materiais rigorosamente secos, relativamente não ácidos e sem ar, os carbenos estáveis são razoavelmente robustos ao manuseio per se . A título de exemplo, um carbeno estável preparado a partir de hidreto de potássio pode ser filtrado através de uma almofada de celite seca para remover o excesso de KH (e os sais resultantes) da reação. Em uma escala relativamente pequena, uma suspensão contendo um carbeno estável em solução pode ser deixada para assentar e a solução sobrenadante empurrada através de um filtro de seringa de membrana seca . Os carbenos estáveis são prontamente solúveis em solventes não polares, como hexano, e assim, tipicamente, a recristalização de carbenos estáveis pode ser difícil, devido à indisponibilidade de solventes polares não ácidos adequados. A sublimação sem ar, conforme mostrado à direita, pode ser um método eficaz de purificação, embora temperaturas abaixo de 60 ° C sob alto vácuo sejam preferíveis, pois esses carbenos são relativamente voláteis e também podem começar a se decompor a essas temperaturas mais altas. Na verdade, a sublimação em alguns casos pode dar cristais únicos adequados para análise de raios-X. No entanto, a forte complexação com íons metálicos como o lítio , na maioria dos casos, evita a sublimação.
Referências
Leitura adicional
Avaliações sobre carbenos persistentes:
- Hopkinson, MN; Richter, C .; Schedler, M .; Glorius, F. (2014). "An Overview of N-Heterocyclic Carbenes". Nature . 510 (7506): 485–496. Bibcode : 2014Natur.510..485H . doi : 10.1038 / nature13384 . PMID 24965649 . S2CID 672379 ..
- Carbene Chemistry: From Fleeting Intermediates to Powerful Reagents, (Capítulo 4, Hideo Tomioka (estado tripleto); Capítulo 5 (estado singleto), Roger W. Alder) - ed. Guy Bertrand
- Química intermediária reativa por Robert A. Moss, Matthew Platz, Maitland Jones (Capítulo 8, Stable Singlet Carbenes, Guy Bertrand)
- RW Alder, em 'Diaminocarbenes: explorar estrutura e reatividade', ed. G. Bertrand, Nova York, 2002
- M. Regitz (1996). "Carbenes estável - ilusão ou realidade?". Angew. Chem. Int. Ed. 30 (6): 674–676. doi : 10.1002 / anie.199106741 .
Para uma revisão sobre as propriedades físico-químicas (eletrônica, estérica, ...) de carbenos N-heterocíclicos:
- T. Dröge; F. Glorius (2010). "A Medida de Todos os Anéis - N-Heterocíclicos Carbenos". Angew. Chem. Int. Ed. 49 (39): 6940–6952. doi : 10.1002 / anie.201001865 . PMID 20715233 .