Flúor -Fluorine
 Flúor líquido (em temperaturas extremamente baixas )
| ||||||||||||||||||
| Flúor | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronúncia | ||||||||||||||||||
| Alótropos | alfa, beta (ver Alótropos de flúor ) | |||||||||||||||||
| Aparência | gás: amarelo muito pálido líquido: sólido amarelo brilhante: alfa é opaco, beta é transparente |
|||||||||||||||||
| Peso atômico padrão A r °(F) | ||||||||||||||||||
| Flúor na tabela periódica | ||||||||||||||||||
| ||||||||||||||||||
| Número atômico ( Z ) | 9 | |||||||||||||||||
| Grupo | grupo 17 (halogênios) | |||||||||||||||||
| Período | período 2 | |||||||||||||||||
| Quadra | p-bloco | |||||||||||||||||
| Configuração eletrônica | [ Ele ] 2s 2 2p 5 | |||||||||||||||||
| Elétrons por camada | 2, 7 | |||||||||||||||||
| Propriedades físicas | ||||||||||||||||||
| Fase em STP | gás | |||||||||||||||||
| Ponto de fusão | (F 2 ) 53,48 K (-219,67 °C, -363,41 °F) | |||||||||||||||||
| Ponto de ebulição | (F 2 ) 85,03 K (-188,11 °C, -306,60 °F) | |||||||||||||||||
| Densidade (em STP) | 1,696 g/L | |||||||||||||||||
| quando líquido (em bp ) | 1,505 g / cm3 | |||||||||||||||||
| Ponto Triplo | 53,48 K, 90 kPa | |||||||||||||||||
| Ponto crítico | 144,41 K, 5,1724 MPa | |||||||||||||||||
| Calor da vaporização | 6,51 kJ/mol | |||||||||||||||||
| Capacidade de calor molar | Cp : 31 J /(mol·K) (a 21,1°C) Cv : 23 J / (mol·K) (a 21,1°C) |
|||||||||||||||||
Pressão de vapor
| ||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||
| Estados de oxidação | −1 , 0 (oxida o oxigênio) | |||||||||||||||||
| Eletro-negatividade | Escala de Pauling: 3,98 | |||||||||||||||||
| Energias de ionização | ||||||||||||||||||
| Raio covalente | 18h _ | |||||||||||||||||
| Raio de Van der Waals | 135 da tarde | |||||||||||||||||
| Linhas espectrais de flúor | ||||||||||||||||||
| Outras propriedades | ||||||||||||||||||
| Ocorrência natural | primordial | |||||||||||||||||
| Estrutura de cristal | cúbico | |||||||||||||||||
| Condutividade térmica | 0,02591 W/(m⋅K) | |||||||||||||||||
| Pedido magnético | diamagnético (−1,2 × 10 −4 ) | |||||||||||||||||
| Número CAS | 7782-41-4 | |||||||||||||||||
| História | ||||||||||||||||||
| Nomeação | após o mineral fluorita , ele próprio nomeado após o latim fluo (fluir, em fundição) | |||||||||||||||||
| Descoberta | André-Marie Ampère (1810) | |||||||||||||||||
| Primeiro isolamento | Henri Moissan (26 de junho de 1886) | |||||||||||||||||
| Nomeado por | ||||||||||||||||||
| Principais isótopos de flúor | ||||||||||||||||||
| ||||||||||||||||||
O flúor é um elemento químico com o símbolo F e número atômico 9. É o halogênio mais leve e existe em condições padrão como um gás diatômico amarelo pálido altamente tóxico . Como o elemento mais eletronegativo , é extremamente reativo, pois reage com todos os outros elementos, exceto argônio , neônio e hélio .
Entre os elementos, o flúor ocupa o 24º lugar em abundância universal e 13º em abundância terrestre . A fluorita , a principal fonte mineral de flúor que deu nome ao elemento, foi descrita pela primeira vez em 1529; como foi adicionado aos minérios de metal para diminuir seus pontos de fusão para fundição , o verbo latino fluo que significa 'fluxo' deu ao mineral seu nome. Proposto como um elemento em 1810, o flúor provou ser difícil e perigoso de separar de seus compostos, e vários dos primeiros experimentadores morreram ou sofreram ferimentos em suas tentativas. Somente em 1886 o químico francês Henri Moissan isolou o flúor elementar usando eletrólise de baixa temperatura , um processo ainda empregado para a produção moderna. A produção industrial de gás flúor para enriquecimento de urânio , sua maior aplicação, começou durante o Projeto Manhattan na Segunda Guerra Mundial .
Devido à despesa de refinar flúor puro, a maioria das aplicações comerciais usa compostos de flúor, com cerca de metade da fluorita extraída usada na fabricação de aço . O restante da fluorita é convertido em fluoreto de hidrogênio corrosivo a caminho de vários fluoretos orgânicos, ou em criolita , que desempenha um papel fundamental no refino de alumínio . Moléculas contendo uma ligação carbono-flúor geralmente têm estabilidade química e térmica muito alta; seus principais usos são como refrigerantes , isolantes elétricos e utensílios de cozinha, o último como PTFE (Teflon). Produtos farmacêuticos como atorvastatina e fluoxetina contêm ligações C-F. O íon flúor dos sais de flúor dissolvidos inibe as cáries dentárias e, portanto, encontra uso na pasta de dente e na fluoretação da água . As vendas globais de fluoroquímicos somam mais de US$ 69 bilhões por ano.
Os gases de fluorocarbono são geralmente gases de efeito estufa com potencial de aquecimento global de 100 a 23.500 vezes maior que o dióxido de carbono , e o SF 6 tem o maior potencial de aquecimento global de qualquer substância conhecida. Os compostos organofluorados geralmente persistem no ambiente devido à força da ligação carbono-flúor . O flúor não tem função metabólica conhecida em mamíferos; algumas plantas e esponjas do mar sintetizam venenos organofluorados (na maioria das vezes monofluoroacetatos ) que ajudam a deter a predação.
Características
Configuração eletrônica
Os átomos de flúor têm nove elétrons, um a menos que o neônio , e configuração eletrônica 1s 2 2s 2 2p 5 : dois elétrons em uma camada interna preenchida e sete em uma camada externa exigindo mais um para ser preenchido. Os elétrons externos são ineficazes na blindagem nuclear e experimentam uma carga nuclear efetiva alta de 9 − 2 = 7; isso afeta as propriedades físicas do átomo.
A primeira energia de ionização do flúor é a terceira mais alta entre todos os elementos, atrás do hélio e do neônio, o que complica a remoção de elétrons de átomos neutros de flúor. Também possui alta afinidade eletrônica , perdendo apenas para o cloro , e tende a capturar um elétron para se tornar isoeletrônico com o gás nobre néon; ele tem a maior eletronegatividade de qualquer elemento. Os átomos de flúor têm um pequeno raio covalente de cerca de 60 picômetros , semelhante aos de seus vizinhos de período , oxigênio e neônio.
Reatividade
| Vídeo externo | |
|---|---|
|
| |
|
|
A energia de ligação do difluorino é muito menor do que a do Cl
2ou Br
2e semelhante à ligação peróxido facilmente clivada; isso, juntamente com a alta eletronegatividade, é responsável pela fácil dissociação do flúor, alta reatividade e fortes ligações a átomos não-flúor. Por outro lado, as ligações com outros átomos são muito fortes devido à alta eletronegatividade do flúor. Substâncias não reativas como aço em pó, fragmentos de vidro e fibras de amianto reagem rapidamente com o gás flúor frio; madeira e água entram em combustão espontânea sob um jato de flúor.
As reações do flúor elementar com metais requerem condições variadas. Os metais alcalinos causam explosões e os metais alcalino-terrosos exibem atividade vigorosa em massa; para evitar a passivação da formação de camadas de fluoreto de metal, a maioria dos outros metais, como alumínio e ferro, deve ser pulverizada, e os metais nobres requerem gás de flúor puro a 300–450 °C (575–850 °F). Alguns não-metais sólidos (enxofre, fósforo) reagem vigorosamente em flúor líquido. O sulfeto de hidrogênio e o dióxido de enxofre combinam-se prontamente com o flúor, este último às vezes de forma explosiva; o ácido sulfúrico exibe muito menos atividade, exigindo temperaturas elevadas.
O hidrogênio , como alguns dos metais alcalinos, reage explosivamente com o flúor. O carbono , como negro de lâmpada , reage à temperatura ambiente para produzir fluorometano . Grafite combina com flúor acima de 400°C (750°F) para produzir monofluoreto de carbono não estequiométrico ; temperaturas mais altas geram fluorocarbonetos gasosos , às vezes com explosões. O dióxido de carbono e o monóxido de carbono reagem à temperatura ambiente ou um pouco acima dela, enquanto as parafinas e outros produtos químicos orgânicos geram reações fortes: mesmo haloalcanos completamente substituídos , como o tetracloreto de carbono , normalmente incombustíveis, podem explodir. Embora o trifluoreto de nitrogênio seja estável, o nitrogênio requer uma descarga elétrica em temperaturas elevadas para que ocorra a reação com o flúor, devido à ligação tripla muito forte do nitrogênio elementar; amônia pode reagir explosivamente. O oxigênio não se combina com o flúor em condições ambientais, mas pode ser feito reagir usando descarga elétrica em baixas temperaturas e pressões; os produtos tendem a se desintegrar em seus elementos constituintes quando aquecidos. Os halogênios mais pesados reagem prontamente com o flúor, assim como o gás nobre radônio ; dos outros gases nobres, apenas o xenônio e o criptônio reagem, e somente sob condições especiais.
Fases
À temperatura ambiente, o flúor é um gás de moléculas diatômicas , amarelo pálido quando puro (às vezes descrito como verde-amarelo). Tem um odor pungente e cortante característico de halogênio detectável a 20 ppb . O flúor condensa em um líquido amarelo brilhante a -188 ° C (-306 ° F), uma temperatura de transição semelhante à do oxigênio e do nitrogênio.
O flúor tem duas formas sólidas, α- e β-flúor. Este último cristaliza a -220°C (-364°F) e é transparente e macio, com a mesma estrutura cúbica desordenada do oxigênio sólido recém-cristalizado, ao contrário dos sistemas ortorrômbicos de outros halogênios sólidos. O resfriamento adicional a -228 °C (-378 °F) induz uma transição de fase para α-flúor opaco e duro, que tem uma estrutura monoclínica com camadas densas e angulares de moléculas. A transição de β- para α-flúor é mais exotérmica do que a condensação do flúor e pode ser violenta.
Isótopos
Apenas um isótopo de flúor ocorre naturalmente em abundância, o isótopo estável19
F. _ Possui alta relação magnetogírica e excepcional sensibilidade a campos magnéticos; por ser também o único isótopo estável , é usado em ressonância magnética . Dezoito radioisótopos com números de massa de 13 a 31 foram sintetizados, dos quais18
F é o mais estável com meia-vida de 109,77 minutos. Outros radioisótopos têm meia-vida inferior a 70 segundos; a maioria decai em menos de meio segundo. Os isótopos17
F e18
F sofrem decaimento β + e captura de elétrons , isótopos mais leves decaem por emissão de prótons , e aqueles mais pesados que19
F sofrem decaimento β − (os mais pesados com emissão de nêutrons atrasada ). Dois isômeros metaestáveis de flúor são conhecidos,18m
F , com meia-vida de 162(7) nanossegundos, e26m
F , com meia-vida de 2,2(1) milissegundos.
Ocorrência
Universo
Número atômico |
Elemento | Quantidade relativa |
|---|---|---|
| 6 | Carbono | 4.800 |
| 7 | Azoto | 1.500 |
| 8 | Oxigênio | 8.800 |
| 9 | Flúor | 1 |
| 10 | Néon | 1.400 |
| 11 | Sódio | 24 |
| 12 | Magnésio | 430 |
Entre os elementos mais leves, o valor de abundância do flúor de 400 ppb (partes por bilhão) – 24º entre os elementos do universo – é excepcionalmente baixo: outros elementos, de carbono a magnésio, são vinte ou mais vezes mais comuns. Isso ocorre porque os processos de nucleossíntese estelar ignoram o flúor, e quaisquer átomos de flúor criados de outra forma têm altas seções nucleares , permitindo que colisões com hidrogênio ou hélio gerem oxigênio ou neon, respectivamente.
Além dessa existência transitória, três explicações foram propostas para a presença de flúor:
- durante as supernovas do tipo II , o bombardeio de átomos de neon por neutrinos poderia transmutá-los em flúor;
- o vento solar das estrelas Wolf-Rayet poderia soprar o flúor para longe de qualquer átomo de hidrogênio ou hélio; ou
- o flúor é confirmado em correntes de convecção decorrentes da fusão em estrelas de ramos gigantes assintóticas .
Terra
O flúor é o décimo terceiro elemento mais comum na crosta terrestre em 600-700 ppm (partes por milhão) em massa. Embora se acredite que não ocorra naturalmente, o flúor elementar mostrou estar presente como uma oclusão na antozonita, uma variante da fluorita. A maior parte do flúor existe como minerais contendo flúor. Fluorita , fluorapatita e criolita são as mais significativas industrialmente. Fluorita ( CaF
2), também conhecido como espatoflúor, abundante em todo o mundo, é a principal fonte de flúor e, portanto, de flúor. China e México são os principais fornecedores. A fluorapatita (Ca 5 (PO 4 ) 3 F), que contém a maior parte do flúor do mundo, é uma fonte inadvertida de flúor como subproduto da produção de fertilizantes. Criolita ( Na
3AlF
6), utilizado na produção de alumínio, é o mineral mais rico em flúor. As fontes naturais economicamente viáveis de criolita foram esgotadas, e a maioria agora é sintetizada comercialmente.
Outros minerais, como o topázio , contêm flúor. Os fluoretos, ao contrário de outros haletos, são insolúveis e não ocorrem em concentrações comercialmente favoráveis em águas salinas. Traços de organofluorinas de origem incerta foram detectados em erupções vulcânicas e fontes geotérmicas. A existência de flúor gasoso em cristais, sugerida pelo cheiro de antozonita triturada , é controversa; um estudo de 2012 relatou a presença de 0,04% de F
2por peso em antozonita, atribuindo essas inclusões à radiação da presença de pequenas quantidades de urânio .
História
Descobertas iniciais

Em 1529, Georgius Agricola descreveu a fluorita como um aditivo usado para diminuir o ponto de fusão dos metais durante a fundição . Ele escreveu a palavra latina fluorēs ( fluor, fluxo) para rochas de fluorita. O nome mais tarde evoluiu para espatoflúor (ainda comumente usado) e depois para fluorita . A composição da fluorita foi posteriormente determinada como sendo difluoreto de cálcio .
O ácido fluorídrico foi usado na gravação de vidro de 1720 em diante. Andreas Sigismund Marggraf o caracterizou pela primeira vez em 1764, quando aqueceu fluorita com ácido sulfúrico, e a solução resultante corroeu seu recipiente de vidro. O químico sueco Carl Wilhelm Scheele repetiu o experimento em 1771 e nomeou o produto ácido fluss-spats-syran (ácido espatoflúor). Em 1810, o físico francês André-Marie Ampère sugeriu que o hidrogênio e um elemento análogo ao cloro constituíam o ácido fluorídrico. Ele também propôs em uma carta a Sir Humphry Davy datada de 26 de agosto de 1812 que esta substância então desconhecida pode ser chamada de flúor do ácido fluorídrico e o sufixo -ine de outros halogênios. Esta palavra, muitas vezes com modificações, é usada na maioria das línguas europeias; no entanto, grego, russo e alguns outros, seguindo a sugestão posterior de Ampère, usam o nome ftor ou derivados, do grego φθόριος ( phthorios , destrutivo). O novo nome latino fluorum deu ao elemento seu atual símbolo F ; Fl foi usado nos primeiros jornais.
Isolamento
Os estudos iniciais sobre o flúor eram tão perigosos que vários experimentadores do século 19 foram considerados "mártires do flúor" após infortúnios com ácido fluorídrico. O isolamento do flúor elementar foi dificultado pela extrema corrosividade do próprio flúor elementar e do fluoreto de hidrogênio, bem como pela falta de um eletrólito simples e adequado . Edmond Frémy postulou que a eletrólise de fluoreto de hidrogênio puro para gerar flúor era viável e desenvolveu um método para produzir amostras anidras de bifluoreto de potássio acidificado ; em vez disso, ele descobriu que o fluoreto de hidrogênio (seco) resultante não conduzia eletricidade. O ex-aluno de Frémy, Henri Moissan , perseverou e, depois de muitas tentativas e erros, descobriu que uma mistura de bifluoreto de potássio e fluoreto de hidrogênio seco era um condutor, permitindo a eletrólise. Para evitar a corrosão rápida da platina em suas células eletroquímicas , ele resfriou a reação a temperaturas extremamente baixas em um banho especial e forjou células a partir de uma mistura mais resistente de platina e irídio , e usou rolhas de fluorita. Em 1886, após 74 anos de esforços de muitos químicos, Moissan isolou o flúor elementar.
Em 1906, dois meses antes de sua morte, Moissan recebeu o Prêmio Nobel de Química , com a seguinte citação:
[Em reconhecimento aos grandes serviços prestados por ele em sua investigação e isolamento do elemento flúor... O mundo inteiro admirou a grande habilidade experimental com que você estudou aquela besta selvagem entre os elementos.
Usos posteriores

A divisão Frigidaire da General Motors (GM) experimentou refrigerantes de clorofluorcarbono no final da década de 1920, e a Kinetic Chemicals foi formada como uma joint venture entre a GM e a DuPont em 1930 na esperança de comercializar o Freon-12 ( CCl
2F
2) como um desses refrigerantes . Substituiu compostos anteriores e mais tóxicos, aumentou a demanda por refrigeradores de cozinha e tornou-se lucrativo; em 1949, a DuPont comprou a Kinetic e comercializou vários outros compostos de freon . O politetrafluoretileno (Teflon) foi descoberto por acaso em 1938 por Roy J. Plunkett enquanto trabalhava em refrigerantes na Kinetic, e sua superlativa resistência química e térmica o levou à comercialização acelerada e produção em massa em 1941.
A produção em larga escala de flúor elementar começou durante a Segunda Guerra Mundial. A Alemanha usou eletrólise de alta temperatura para produzir toneladas do planejado trifluoreto de cloro incendiário e o Projeto Manhattan usou grandes quantidades para produzir hexafluoreto de urânio para enriquecimento de urânio. Desde UF
6é tão corrosivo quanto o flúor, as plantas de difusão gasosa exigem materiais especiais: níquel para membranas, fluoropolímeros para vedações e fluorocarbonos líquidos como refrigerantes e lubrificantes. Esta crescente indústria nuclear mais tarde impulsionou o desenvolvimento de fluoroquímicos no pós-guerra.
Compostos
O flúor tem uma química rica, abrangendo domínios orgânicos e inorgânicos. Combina-se com metais, não metais, metalóides e a maioria dos gases nobres, e quase exclusivamente assume um estado de oxidação de -1. A alta afinidade eletrônica do flúor resulta em uma preferência pela ligação iônica ; quando forma ligações covalentes , estas são polares, e quase sempre simples .
Metais
Os metais alcalinos formam monofluoretos iônicos e altamente solúveis ; estes têm o arranjo cúbico de cloreto de sódio e cloretos análogos. Os difluoretos alcalino-terrosos possuem fortes ligações iônicas, mas são insolúveis em água, com exceção do difluoreto de berílio , que também exibe algum caráter covalente e tem uma estrutura semelhante ao quartzo . Elementos de terras raras e muitos outros metais formam principalmente trifluoretos iônicos .
A ligação covalente primeiro vem à tona nos tetrafluoretos : os de zircônio , háfnio e vários actinídeos são iônicos com altos pontos de fusão, enquanto os de titânio , vanádio e nióbio são poliméricos, fundindo ou decompondo-se a não mais de 350°C (660°C). F). Os pentafluoretos continuam esta tendência com seus polímeros lineares e complexos oligoméricos . Treze hexafluoretos metálicos são conhecidos, todos octaédricos, e são principalmente sólidos voláteis, mas para MoF líquido
6e Ref
6, e WF gasoso
6. O heptafluoreto de rênio , o único heptafluoreto de metal caracterizado , é um sólido molecular de baixo ponto de fusão com geometria molecular bipiramidal pentagonal . Os fluoretos metálicos com mais átomos de flúor são particularmente reativos.
| Progressão estrutural de fluoretos metálicos | ||

|

|

|
| Fluoreto de sódio , iônico | pentafluoreto de bismuto , polimérico | heptafluoreto de rênio , molecular |
Hidrogênio
O hidrogênio e o flúor se combinam para produzir fluoreto de hidrogênio, no qual moléculas discretas formam aglomerados por ligações de hidrogênio, assemelhando-se mais à água do que ao cloreto de hidrogênio . Ele ferve a uma temperatura muito mais alta do que os haletos de hidrogênio mais pesados e, ao contrário deles, é miscível com água. O fluoreto de hidrogênio hidrata prontamente em contato com a água para formar fluoreto de hidrogênio aquoso, também conhecido como ácido fluorídrico. Ao contrário dos outros ácidos hidro-hálicos, que são fortes , o ácido fluorídrico é um ácido fraco em baixas concentrações. No entanto, pode atacar o vidro, algo que os outros ácidos não podem fazer.
Outros não metais reativos

Os fluoretos binários de metalóides e não-metais do bloco p são geralmente covalentes e voláteis, com reatividades variadas. Período 3 e não-metais mais pesados podem formar fluoretos hipervalentes .
O trifluoreto de boro é planar e possui um octeto incompleto. Funciona como um ácido de Lewis e combina com bases de Lewis como amônia para formar adutos . O tetrafluoreto de carbono é tetraédrico e inerte; seus análogos de grupo, tetrafluoreto de silício e germânio, também são tetraédricos, mas se comportam como ácidos de Lewis. Os pnictógenos formam trifluoretos que aumentam em reatividade e basicidade com maior peso molecular, embora o trifluoreto de nitrogênio resista à hidrólise e não seja básico. Os pentafluoretos de fósforo, arsênico e antimônio são mais reativos que seus respectivos trifluoretos, sendo o pentafluoreto de antimônio o ácido de Lewis neutro mais forte conhecido.
Os calcogênios têm diversos fluoretos: difluoretos instáveis foram relatados para oxigênio (o único composto conhecido com oxigênio em estado de oxidação +2), enxofre e selênio; tetrafluoretos e hexafluoretos existem para enxofre, selênio e telúrio. Estes últimos são estabilizados por mais átomos de flúor e átomos centrais mais leves, de modo que o hexafluoreto de enxofre é especialmente inerte. Cloro, bromo e iodo podem formar mono-, tri- e pentafluoretos, mas apenas o heptafluoreto de iodo foi caracterizado entre os possíveis heptafluoretos interhalogênicos . Muitos deles são fontes poderosas de átomos de flúor, e as aplicações industriais que usam trifluoreto de cloro requerem precauções semelhantes às que usam flúor.
gases nobres
Gases nobres , com camadas eletrônicas completas, desafiaram a reação com outros elementos até 1962, quando Neil Bartlett relatou a síntese de hexafluoroplatinato de xenônio ; difluoreto de xenônio , tetrafluoreto , hexafluoreto e vários oxifluoretos foram isolados desde então. Entre outros gases nobres, o criptônio forma um difluoreto , e o radônio e o flúor geram um sólido suspeito de ser difluoreto de radônio . Os fluoretos binários de gases nobres mais leves são excepcionalmente instáveis: argônio e fluoreto de hidrogênio combinam-se sob condições extremas para dar fluorhidreto de argônio . Hélio e neônio não possuem fluoretos de longa duração, e nenhum fluoreto de neônio foi observado; fluorhidreto de hélio foi detectado por milissegundos em altas pressões e baixas temperaturas.
Compostos orgânicos


A ligação carbono-flúor é a mais forte da química orgânica e confere estabilidade aos organofluorados. É quase inexistente na natureza, mas é usado em compostos artificiais. A pesquisa nesta área geralmente é conduzida por aplicações comerciais; os compostos envolvidos são diversos e refletem a complexidade inerente à química orgânica.
Moléculas discretas
A substituição de átomos de hidrogênio em um alcano por progressivamente mais átomos de flúor altera gradualmente várias propriedades: os pontos de fusão e ebulição são reduzidos, a densidade aumenta, a solubilidade em hidrocarbonetos diminui e a estabilidade geral aumenta. Perfluorocarbonos, nos quais todos os átomos de hidrogênio são substituídos, são insolúveis na maioria dos solventes orgânicos, reagindo em condições ambientais apenas com sódio em amônia líquida.
O termo composto perfluorado é usado para o que seria um perfluorocarbono se não fosse pela presença de um grupo funcional , geralmente um ácido carboxílico . Esses compostos compartilham muitas propriedades com os perfluorocarbonos, como estabilidade e hidrofobicidade , enquanto o grupo funcional aumenta sua reatividade, permitindo-lhes aderir a superfícies ou atuar como surfactantes ; Os fluorossurfactantes , em particular, podem diminuir a tensão superficial da água mais do que seus análogos à base de hidrocarbonetos. Os fluororotelomeros , que possuem alguns átomos de carbono não fluorados perto do grupo funcional, também são considerados perfluorados.
Polímeros
Os polímeros exibem os mesmos aumentos de estabilidade proporcionados pela substituição de flúor (por hidrogênio) em moléculas discretas; seus pontos de fusão geralmente aumentam também. Politetrafluoretileno (PTFE), o fluoropolímero mais simples e análogo de perfluoro de polietileno com unidade estrutural – CF
2–, demonstra essa mudança como esperado, mas seu ponto de fusão muito alto dificulta a moldagem. Vários derivados de PTFE são menos tolerantes à temperatura, mas mais fáceis de moldar: etileno propileno fluorado substitui alguns átomos de flúor por grupos trifluorometil , alcanos perfluoroalcoxi fazem o mesmo com grupos trifluorometoxi e Nafion contém cadeias laterais de perfluoroéter cobertas com grupos de ácido sulfônico . Outros fluoropolímeros retêm alguns átomos de hidrogênio; o fluoreto de polivinilideno tem metade dos átomos de flúor do PTFE e o fluoreto de polivinil tem um quarto, mas ambos se comportam como polímeros perfluorados.
Produção
O flúor elementar e praticamente todos os compostos de flúor são produzidos a partir de fluoreto de hidrogênio ou de suas soluções aquosas, ácido fluorídrico . O fluoreto de hidrogênio é produzido em fornos pela reação endotérmica de fluorita (CaF 2 ) com ácido sulfúrico:
- CaF 2 + H 2 SO 4 → 2 HF(g) + CaSO 4
O HF gasoso pode então ser absorvido em água ou liquefeito.
Cerca de 20% do HF fabricado é um subproduto da produção de fertilizantes, que produz ácido hexafluorossilícico (H 2 SiF 6 ), que pode ser degradado para liberar HF termicamente e por hidrólise:
- H 2 SiF 6 → 2 HF + SiF 4
- SiF 4 + 2 H 2 O → 4 HF + SiO 2
Rotas industriais para F 2

O método de Moissan é usado para produzir quantidades industriais de flúor, através da eletrólise de uma mistura de fluoreto de potássio / fluoreto de hidrogênio : íons de hidrogênio e fluoreto são reduzidos e oxidados em um cátodo de recipiente de aço e um ânodo de bloco de carbono , sob 8-12 volts, para gerar hidrogênio e gás flúor, respectivamente. As temperaturas são elevadas, KF•2HF fundindo a 70 °C (158 °F) e sendo eletrolisado a 70–130 °C (158–266 °F). O KF, que atua para fornecer condutividade elétrica, é essencial, pois o HF puro não pode ser eletrolisado porque é praticamente não condutor. O flúor pode ser armazenado em cilindros de aço com interior passivado, em temperaturas abaixo de 200 °C (392 °F); caso contrário, o níquel pode ser usado. Válvulas reguladoras e tubulações são feitas de níquel, este último possivelmente usando Monel . A passivação frequente, juntamente com a estrita exclusão de água e graxas, deve ser realizada. No laboratório, a vidraria pode transportar gás flúor sob baixa pressão e condições anidras; algumas fontes recomendam sistemas de níquel-Monel-PTFE.
Rotas de laboratório
Enquanto se preparava para uma conferência em 1986 para comemorar o centenário da conquista de Moissan, Karl O. Christe raciocinou que a geração química de flúor deveria ser viável, já que alguns ânions de fluoreto de metal não têm contrapartes neutras estáveis; sua acidificação potencialmente desencadeia a oxidação. Ele desenvolveu um método que desenvolve flúor em alto rendimento e pressão atmosférica:
- 2 KMnO 4 + 2 KF + 10 HF + 3 H 2 O 2 → 2 K 2 MnF 6 + 8 H 2 O + 3 O 2 ↑
- 2 K 2 MnF 6 + 4 SbF 5 → 4 KSbF 6 + 2 MnF 3 + F 2 ↑
Christe comentou mais tarde que os reagentes "são conhecidos há mais de 100 anos e até mesmo Moissan poderia ter inventado esse esquema". Ainda em 2008, algumas referências ainda afirmavam que o flúor era muito reativo para qualquer isolamento químico.
Aplicações industriais
A mineração de fluorita, que fornece a maior parte do flúor global, atingiu o pico em 1989, quando 5,6 milhões de toneladas métricas de minério foram extraídas. As restrições de clorofluorcarbono reduziram para 3,6 milhões de toneladas em 1994; desde então, a produção vem aumentando. Cerca de 4,5 milhões de toneladas de minério e receita de US$ 550 milhões foram geradas em 2003; relatórios posteriores estimaram as vendas globais de fluoroquímicos em 2011 em US$ 15 bilhões e previram números de produção de 3,5 a 5,9 milhões de toneladas em 2016–18 e receita de pelo menos US$ 20 bilhões. A flotação de espuma separa a fluorita extraída em dois tipos metalúrgicos principais de igual proporção: 60-85% de metspar puro é quase todo usado na fundição de ferro, enquanto 97%+ de acidpar puro é convertido principalmente no principal intermediário industrial fluoreto de hidrogênio.
Pelo menos 17.000 toneladas métricas de flúor são produzidas a cada ano. Custa apenas US$ 5-8 por quilograma como urânio ou hexafluoreto de enxofre, mas muitas vezes mais como um elemento devido aos desafios de manuseio. A maioria dos processos que utilizam flúor livre em grandes quantidades emprega geração in situ sob integração vertical .
A maior aplicação do gás flúor, consumindo até 7.000 toneladas anuais, é na preparação de UF
6para o ciclo do combustível nuclear . O flúor é usado para fluorar o tetrafluoreto de urânio , ele próprio formado a partir de dióxido de urânio e ácido fluorídrico. O flúor é monoisotópico, então qualquer diferença de massa entre UF
6moléculas se devem à presença de235
U ou238
U , permitindo o enriquecimento de urânio por difusão gasosa ou centrifugação a gás . Cerca de 6.000 toneladas métricas por ano são destinadas à produção do dielétrico inerte SF
6para transformadores de alta tensão e disjuntores, eliminando a necessidade de bifenilos policlorados perigosos associados a dispositivos preenchidos com óleo . Vários compostos de flúor são usados em eletrônica: hexafluoreto de rênio e tungstênio na deposição de vapor químico , tetrafluorometano em ataque de plasma e trifluoreto de nitrogênio em equipamentos de limpeza. O flúor também é usado na síntese de fluoretos orgânicos, mas sua reatividade geralmente requer conversão primeiro para o ClF mais suave.
3, BrF
3, ou SE
5, que juntos permitem fluoração calibrada. Os produtos farmacêuticos fluorados usam tetrafluoreto de enxofre .
Fluoretos inorgânicos
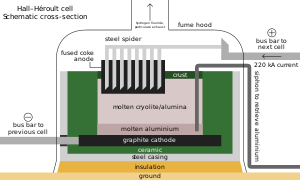
Tal como acontece com outras ligas de ferro, cerca de 3 kg (6,5 lb) de metspar são adicionados a cada tonelada métrica de aço; os íons de flúor diminuem seu ponto de fusão e viscosidade . Ao lado de seu papel como aditivo em materiais como esmaltes e revestimentos de varetas de solda, a maioria dos ácidospar reage com ácido sulfúrico para formar ácido fluorídrico, que é usado em decapagem de aço , gravura de vidro e craqueamento de alcano . Um terço do HF vai para a síntese de criolita e trifluoreto de alumínio , ambos fluxos no processo Hall–Héroult para extração de alumínio; reabastecimento é necessário por suas reações ocasionais com o aparelho de fundição. Cada tonelada métrica de alumínio requer cerca de 23 kg (51 lb) de fluxo. Os fluorossilicatos consomem a segunda maior porção, com o fluorosilicato de sódio usado na fluoretação da água e tratamento de efluentes de lavanderia, e como intermediário na rota da criolita e do tetrafluoreto de silício. Outros fluoretos inorgânicos importantes incluem os de cobalto , níquel e amônio .
Fluoretos orgânicos
Os organofluoretos consomem mais de 20% da fluorita extraída e mais de 40% do ácido fluorídrico, com gases refrigerantes dominando e fluoropolímeros aumentando sua participação no mercado. Os surfactantes são uma aplicação menor, mas geram mais de US$ 1 bilhão em receita anual. Devido ao perigo de reações diretas de hidrocarboneto-flúor acima de -150 °C (-240 °F), a produção industrial de fluorocarbono é indireta, principalmente por meio de reações de troca de halogênio , como a fluoração de Swarts , na qual os clorocarbonetos são substituídos por flúor por fluoreto de hidrogênio sob catalisadores. A fluoração eletroquímica submete os hidrocarbonetos à eletrólise em fluoreto de hidrogênio, e o processo Fowler os trata com carreadores sólidos de flúor, como trifluoreto de cobalto .
Gases refrigerantes
Os refrigerantes halogenados, denominados Freons em contextos informais, são identificados por números R que denotam a quantidade de flúor, cloro, carbono e hidrogênio presentes. Clorofluorcarbonos (CFCs) como R-11 , R-12 e R-114 já dominaram organofluorinas, atingindo o pico de produção na década de 1980. Usado para sistemas de ar condicionado, propelentes e solventes, sua produção ficou abaixo de um décimo desse pico no início dos anos 2000, após ampla proibição internacional. Hidroclorofluorcarbonos (HCFCs) e hidrofluorcarbonos (HFCs) foram projetados como substitutos; sua síntese consome mais de 90% do flúor na indústria orgânica. HCFCs importantes incluem R-22, clorodifluorometano e R-141b . O principal HFC é o R-134a com um novo tipo de molécula HFO-1234yf , uma Hidrofluorolefina (HFO) que vem se destacando devido ao seu potencial de aquecimento global inferior a 1% do HFC-134a.
Polímeros

Cerca de 180.000 toneladas métricas de fluoropolímeros foram produzidas em 2006 e 2007, gerando mais de US$ 3,5 bilhões de receita por ano. O mercado global foi estimado em pouco menos de US$ 6 bilhões em 2011 e foi previsto um crescimento de 6,5% ao ano até 2016. Os fluoropolímeros só podem ser formados pela polimerização de radicais livres.
Politetrafluoretileno (PTFE), às vezes chamado pelo nome DuPont Teflon, representa 60-80% em massa da produção mundial de fluoropolímero. A maior aplicação é em isolamento elétrico , pois o PTFE é um excelente dielétrico . Também é usado na indústria química onde a resistência à corrosão é necessária, no revestimento de tubos, tubulações e gaxetas. Outro uso importante é em tecido de fibra de vidro revestido com PFTE para telhados de estádios. A principal aplicação do consumidor é para panelas antiaderentes . O filme de PTFE sacudido torna-se PTFE expandido (ePTFE), uma membrana de poros finos às vezes referida pela marca Gore-Tex e usada para roupas de chuva, roupas de proteção e filtros ; As fibras de ePTFE podem ser transformadas em vedações e filtros de poeira . Outros fluoropolímeros, incluindo etileno propileno fluorado , imitam as propriedades do PTFE e podem substituí-lo; eles são mais moldáveis, mas também mais caros e têm menor estabilidade térmica. Filmes de dois fluoropolímeros diferentes substituem o vidro nas células solares.
Os ionômeros fluorados quimicamente resistentes (mas caros) são usados como membranas celulares eletroquímicas, das quais o primeiro e mais proeminente exemplo é o Nafion . Desenvolvido na década de 1960, foi inicialmente implantado como material de célula de combustível em naves espaciais e depois substituiu as células de processo de cloro-álcalis à base de mercúrio . Recentemente, a aplicação de células de combustível ressurgiu com os esforços para instalar células de combustível de membrana de troca de prótons em automóveis. Fluoroelastômeros como o Viton são misturas de fluoropolímeros reticulados usados principalmente em O-rings ; perfluorobutano (C 4 F 10 ) é usado como agente extintor de incêndio.
Surfactantes
Os fluorosurfactantes são pequenas moléculas organofluoradas usadas para repelir água e manchas. Embora caros (comparáveis aos produtos farmacêuticos de US$ 200 a US$ 2.000 por quilo), eles renderam mais de US$ 1 bilhão em receitas anuais em 2006; Só a Scotchgard gerou mais de US$ 300 milhões em 2000. Os fluorosurfactantes são uma minoria no mercado geral de surfactantes, a maioria dos quais é absorvida por produtos à base de hidrocarbonetos muito mais baratos. As aplicações em tintas são oneradas por custos compostos ; esse uso foi avaliado em apenas US$ 100 milhões em 2006.
Agroquímicos
Cerca de 30% dos agroquímicos contêm flúor, sendo a maioria herbicidas e fungicidas com poucos reguladores de cultivo . A substituição de flúor, geralmente de um único átomo ou no máximo um grupo trifluorometil , é uma modificação robusta com efeitos análogos aos produtos farmacêuticos fluorados: aumento do tempo de permanência biológica, cruzamento de membranas e alteração do reconhecimento molecular. A trifluralina é um exemplo proeminente, com uso em larga escala nos EUA como herbicida, mas é suspeito de ser cancerígeno e foi proibido em muitos países europeus. O monofluoroacetato de sódio (1080) é um veneno de mamífero no qual dois hidrogênios de ácido acético são substituídos por flúor e sódio; interrompe o metabolismo celular substituindo o acetato no ciclo do ácido cítrico . Sintetizado pela primeira vez no final do século 19, foi reconhecido como um inseticida no início do século 20, e mais tarde foi implantado em seu uso atual. A Nova Zelândia, o maior consumidor de 1080, o usa para proteger os kiwis do invasor gambá comum australiano . A Europa e os EUA proibiram o 1080.
Aplicações medicinais
Cuidado dental
Estudos populacionais a partir de meados do século 20 mostram que o flúor tópico reduz a cárie dentária . Isso foi atribuído pela primeira vez à conversão da hidroxiapatita do esmalte dentário na fluorapatita mais durável, mas estudos em dentes pré-fluoretados refutaram essa hipótese, e as teorias atuais envolvem o flúor auxiliando no crescimento do esmalte em pequenas cáries. Após estudos de crianças em áreas onde o flúor estava naturalmente presente na água potável, a fluoretação controlada da água pública para combater a cárie dentária começou na década de 1940 e agora é aplicada à água que abastece 6% da população global, incluindo dois terços dos americanos. Revisões da literatura acadêmica em 2000 e 2007 associaram a fluoretação da água com uma redução significativa da cárie dentária em crianças. Apesar de tais endossos e evidências de nenhum efeito adverso além da fluorose dental majoritariamente benigna , a oposição ainda existe por motivos éticos e de segurança. Os benefícios da fluoretação diminuíram, possivelmente devido a outras fontes de flúor, mas ainda são mensuráveis em grupos de baixa renda. O monofluorofosfato de sódio e, às vezes, o fluoreto de sódio ou estanho (II) são frequentemente encontrados em cremes dentais fluoretados , introduzidos pela primeira vez nos EUA em 1955 e agora onipresentes em países desenvolvidos, juntamente com enxaguantes bucais fluoretados, géis, espumas e vernizes.
Produtos farmacêuticos
Vinte por cento dos produtos farmacêuticos modernos contêm flúor. Um deles, o redutor de colesterol atorvastatina (Lipitor), gerou mais receita do que qualquer outro medicamento até se tornar genérico em 2011 . um dos quais – fluticasona – é fluorado. Muitos medicamentos são fluorados para retardar a inativação e prolongar os períodos de dosagem porque a ligação carbono-flúor é muito estável. A fluoração também aumenta a lipofilicidade porque a ligação é mais hidrofóbica do que a ligação carbono-hidrogênio , e isso geralmente ajuda na penetração na membrana celular e, portanto, na biodisponibilidade .
Os tricíclicos e outros antidepressivos anteriores à década de 1980 tiveram vários efeitos colaterais devido à sua interferência não seletiva com neurotransmissores diferentes do alvo da serotonina ; a fluoxetina fluorada foi seletiva e uma das primeiras a evitar esse problema. Muitos antidepressivos atuais recebem esse mesmo tratamento, incluindo os inibidores seletivos da recaptação da serotonina : citalopram , seu isômero escitalopram , e fluvoxamina e paroxetina . As quinolonas são antibióticos artificiais de amplo espectro que são frequentemente fluorados para aumentar seus efeitos. Estes incluem ciprofloxacina e levofloxacina . O flúor também é usado em esteróides: a fludrocortisona é um mineralocorticóide que aumenta a pressão arterial , e a triancinolona e a dexametasona são glicocorticóides fortes . A maioria dos anestésicos inalatórios são fortemente fluorados; o protótipo halotano é muito mais inerte e potente que seus contemporâneos. Compostos posteriores, como os éteres fluorados sevoflurano e desflurano , são melhores que o halotano e são quase insolúveis no sangue, permitindo tempos de vigília mais rápidos.
Varredura PET
O flúor-18 é frequentemente encontrado em traçadores radioativos para tomografia por emissão de pósitrons, pois sua meia-vida de quase duas horas é longa o suficiente para permitir seu transporte das instalações de produção para os centros de imagem. O traçador mais comum é a fluorodesoxiglicose que, após injeção intravenosa, é absorvida pelos tecidos que requerem glicose, como o cérebro e a maioria dos tumores malignos; A tomografia assistida por computador pode então ser usada para imagens detalhadas.
Portadores de oxigênio
Os fluorocarbonos líquidos podem conter grandes volumes de oxigênio ou dióxido de carbono, mais do que o sangue, e atraíram a atenção por seus possíveis usos no sangue artificial e na respiração líquida. Como os fluorocarbonos normalmente não se misturam com a água, eles devem ser misturados em emulsões (pequenas gotículas de perfluorocarbono suspensas em água) para serem usadas como sangue. Um desses produtos, Oxycyte , passou por testes clínicos iniciais. Essas substâncias podem ajudar atletas de resistência e são proibidas de praticar esportes; a quase morte de um ciclista em 1998 levou a uma investigação sobre seu abuso. As aplicações da respiração líquida de perfluorocarbono puro (que usa líquido perfluorocarbono puro, não uma emulsão de água) incluem assistência a vítimas de queimaduras e bebês prematuros com deficiência pulmonar. O enchimento pulmonar parcial e completo foi considerado, embora apenas o primeiro tenha tido testes significativos em humanos. Um esforço da Alliance Pharmaceuticals chegou a testes clínicos, mas foi abandonado porque os resultados não foram melhores do que as terapias normais.
Papel biológico

O flúor não é essencial para humanos e outros mamíferos, mas sabe-se que pequenas quantidades são benéficas para o fortalecimento do esmalte dentário (onde a formação de fluorapatita torna o esmalte mais resistente ao ataque, a partir de ácidos produzidos pela fermentação bacteriana de açúcares). Pequenas quantidades de flúor podem ser benéficas para a resistência óssea, mas esta última não foi definitivamente estabelecida. Tanto a OMS quanto o Instituto de Medicina das Academias Nacionais dos EUA publicam a dose diária recomendada (RDA) e a ingestão tolerada superior de flúor, que varia com a idade e o sexo.
Organofluorinas naturais foram encontradas em microorganismos e plantas, mas não em animais. O mais comum é o fluoroacetato , que é usado como defesa contra herbívoros por pelo menos 40 plantas na África, Austrália e Brasil. Outros exemplos incluem ácidos graxos fluorados terminalmente , fluoroacetona e 2-fluorocitrato. Uma enzima que liga o flúor ao carbono – adenosil-fluoreto sintase – foi descoberta em bactérias em 2002.
Toxicidade
O flúor elementar é altamente tóxico para os organismos vivos. Seus efeitos em humanos começam em concentrações inferiores a 50 ppm do cianeto de hidrogênio e são semelhantes aos do cloro: irritação significativa dos olhos e do sistema respiratório, bem como danos no fígado e nos rins ocorrem acima de 25 ppm, o que é imediatamente perigoso para a vida e valor de saúde para o flúor. Os olhos e o nariz são seriamente danificados a 100 ppm, e a inalação de 1.000 ppm de flúor causará a morte em minutos, em comparação com 270 ppm para cianeto de hidrogênio.
| Perigos | |
|---|---|
| Rotulagem GHS : | |
   
|
|
| Perigo | |
| H270 , H314 , H330 | |
| NFPA 704 (diamante de fogo) | |
Acido hidrosulfurico
O ácido fluorídrico é o mais fraco dos ácidos hidrohálicos, tendo um pKa de 3,2 a 25°C. É um líquido volátil devido à presença de ligações de hidrogênio (enquanto os outros ácidos hidro-hálicos são gases). É capaz de atacar vidro, concreto, metais, matéria orgânica.
O ácido fluorídrico é um veneno de contato com maiores riscos do que muitos ácidos fortes como o ácido sulfúrico, embora seja fraco: permanece neutro em solução aquosa e, portanto, penetra nos tecidos mais rapidamente, seja por inalação, ingestão ou pele, e pelo menos nove trabalhadores americanos morreram em tais acidentes de 1984 a 1994. Reage com cálcio e magnésio no sangue levando a hipocalcemia e possível morte por arritmia cardíaca . A formação de fluoreto de cálcio insolúvel desencadeia fortes dores e queimaduras maiores que 160 cm 2 (25 em 2 ) podem causar séria toxicidade sistêmica.
A exposição pode não ser evidente por oito horas para HF 50%, aumentando para 24 horas para concentrações mais baixas, e uma queimadura pode inicialmente ser indolor, pois o fluoreto de hidrogênio afeta a função nervosa. Se a pele tiver sido exposta ao HF, os danos podem ser reduzidos lavando-a com jato de água por 10 a 15 minutos e removendo a roupa contaminada. O gluconato de cálcio é frequentemente aplicado em seguida, fornecendo íons de cálcio para se ligarem ao flúor; queimaduras na pele podem ser tratadas com gel de gluconato de cálcio a 2,5% ou soluções de enxágue especiais. A absorção de ácido fluorídrico requer tratamento médico adicional; o gluconato de cálcio pode ser injetado ou administrado por via intravenosa. O uso de cloreto de cálcio – um reagente comum de laboratório – em vez de gluconato de cálcio é contraindicado e pode levar a complicações graves. Pode ser necessária a excisão ou amputação das partes afetadas.
Íon de flúor
Os fluoretos solúveis são moderadamente tóxicos: 5 a 10 g de fluoreto de sódio, ou 32 a 64 mg de íons de fluoreto por quilograma de massa corporal, representam uma dose letal para adultos. Um quinto da dose letal pode causar efeitos adversos à saúde, e o consumo excessivo crônico pode levar à fluorose esquelética , que afeta milhões na Ásia e na África. O flúor ingerido forma ácido fluorídrico no estômago que é facilmente absorvido pelos intestinos, onde atravessa as membranas celulares, liga-se ao cálcio e interfere em várias enzimas, antes da excreção urinária . Os limites de exposição são determinados por testes de urina da capacidade do corpo de limpar os íons de flúor.
Historicamente, a maioria dos casos de intoxicação por flúor foi causada pela ingestão acidental de inseticidas contendo fluoretos inorgânicos. A maioria das chamadas atuais para os centros de controle de envenenamento por possível envenenamento por flúor vem da ingestão de creme dental contendo flúor. O mau funcionamento do equipamento de fluoretação da água é outra causa: um incidente no Alasca afetou quase 300 pessoas e matou uma pessoa. Os perigos da pasta de dente são agravados para crianças pequenas, e os Centros de Controle e Prevenção de Doenças recomendam supervisionar crianças com menos de seis anos escovando os dentes para que não engulam pasta de dente. Um estudo regional examinou um ano de relatórios de envenenamento por flúor pré-adolescentes, totalizando 87 casos, incluindo uma morte por ingestão de inseticida. A maioria não apresentava sintomas, mas cerca de 30% apresentavam dores de estômago. Um estudo maior nos EUA teve resultados semelhantes: 80% dos casos envolveram crianças menores de seis anos e houve poucos casos graves.
Preocupações ambientais
Atmosfera
O Protocolo de Montreal , assinado em 1987, estabeleceu regulamentações rígidas sobre clorofluorcarbonos (CFCs) e bromofluorcarbonos devido ao seu potencial de dano ao ozônio (ODP). A alta estabilidade que os adequou às suas aplicações originais também significava que eles não estavam se decompondo até atingirem altitudes mais altas, onde os átomos de cloro e bromo liberados atacaram as moléculas de ozônio. Mesmo com a proibição e os primeiros indícios de sua eficácia, as previsões alertavam que várias gerações se passariam antes da recuperação total. Com um décimo do PDO dos CFCs, os hidroclorofluorcarbonos (HCFCs) são os substitutos atuais e estão programados para substituição até 2030-2040 por hidrofluorocarbonos (HFCs) sem cloro e zero PDO. Em 2007 esta data foi antecipada para 2020 para os países desenvolvidos; a Agência de Proteção Ambiental já havia proibido a produção de um HCFC e limitado a produção de outros dois em 2003. Os gases de fluorocarbono são geralmente gases de efeito estufa com potenciais de aquecimento global (GWPs) de cerca de 100 a 10.000; hexafluoreto de enxofre tem um valor de cerca de 20.000. Um valor atípico é o HFO-1234yf, que é um novo tipo de refrigerante chamado Hidrofluoroolefina (HFO) e atraiu a demanda global devido ao seu GWP de menos de 1 em comparação com 1.430 para o atual padrão de refrigerante HFC-134a .
Biopersistência
As organofluorinas exibem biopersistência devido à força da ligação carbono-flúor. Os ácidos perfluoroalquil (PFAAs), que são pouco solúveis em água devido aos seus grupos funcionais ácidos, são poluentes orgânicos persistentes notados ; ácido perfluorooctanossulfônico (PFOS) e ácido perfluorooctanoico (PFOA) são mais frequentemente pesquisados. Os PFAAs foram encontrados em quantidades vestigiais em todo o mundo, de ursos polares a humanos, com PFOS e PFOA conhecidos por residirem no leite materno e no sangue de bebês recém-nascidos. Uma revisão de 2013 mostrou uma ligeira correlação entre os níveis de PFAA das águas subterrâneas e do solo e a atividade humana; não havia um padrão claro de um químico dominante, e maiores quantidades de PFOS foram correlacionadas a maiores quantidades de PFOA. No corpo, os PFAAs se ligam a proteínas como a albumina sérica ; eles tendem a se concentrar nos humanos no fígado e no sangue antes da excreção pelos rins. O tempo de permanência no corpo varia muito de espécie para espécie, com meia-vida de dias em roedores e anos em humanos. Altas doses de PFOS e PFOA causam câncer e morte em roedores recém-nascidos, mas estudos em humanos não estabeleceram um efeito nos níveis de exposição atuais.
Veja também
- Laser de fluoreto de argônio
- Fluoração eletrofílica
- Eletrodo seletivo de flúor , que mede a concentração de flúor
- Datação por absorção de flúor
- Química fluorescente , um processo usado para separar reagentes de solventes orgânicos
- Laser de fluoreto de criptônio
- Fluoração radical
Notas
Fontes
Citações
Referências indexadas
- Agrícola, Georgius ; Hoover, Herbert Clark; Hoover, Lou Henry (1912). De Re Metallica . Londres: The Mining Magazine.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, RE; Cue, JP (2000). "Compostos de flúor, inorgânicos". Enciclopédia de Química Industrial de Ullmann . Weinheim: Wiley-VCH. págs. 397–441. doi : 10.1002/14356007 .
- Produtos Aéreos e Produtos Químicos (2004). "Safetygram #39 Trifluoreto de Cloro" (PDF) . Produtos do ar e produtos químicos. Arquivado a partir do original (PDF) em 18 de março de 2006 . Recuperado em 16 de fevereiro de 2014 .
- Alavi, Abbas; Huang, Steve S. (2007). "Tomografia por emissão de pósitrons em medicina: uma visão geral". Em Hayat, MA (ed.). Cancer Imaging, Volume 1: Carcinomas de pulmão e mama . Burlington: Imprensa Acadêmica. págs. 39–44. ISBN 978-0-12-370468-9.
- Ampère, André-Marie (1816). "Suite d'une classificação naturelle pour les corps simples" . Annales de chimie et de physique (em francês). 2 : 1–5.
- Arana, LR; Mas, N.; Schmidt, R.; Franz, AJ; Schmidt, MA; Jensen, KF (2007). "Gravação isotrópica de silício em gás flúor para MEMS Micromachining". Revista de Micromecânica e Microengenharia . 17 (2): 384–392. Bibcode : 2007JMiMi..17..384A . doi : 10.1088/0960-1317/17/2/026 .
- Armfield, JM (2007). "Quando a ação pública mina a saúde pública: um exame crítico da literatura antifluoridacionista" . Política de Saúde da Austrália e Nova Zelândia . 4 : 25. doi : 10.1186/1743-8462-4-25 . PMC 2222595 . PMID 18067684 .
- Asimov, Isaac (1966). Os Gases Nobres . Nova York: Livros Básicos. ISBN 978-0-465-05129-8.
- Atkins, Peter ; Jones, Loretta (2007). Princípios Químicos: The Quest for Insight (4ª ed.). Nova York: WH Freeman. ISBN 978-1-4292-0965-6.
- Aucamp, Pieter J.; Björn, Lars Olof (2010). "Perguntas e Respostas sobre os Efeitos Ambientais da Destruição da Camada de Ozônio e Mudanças Climáticas: Atualização de 2010" (PDF) . Programa das Nações Unidas para o Meio Ambiente. Arquivado a partir do original (PDF) em 3 de setembro de 2013 . Recuperado em 14 de outubro de 2013 .
- Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "A avaliação NUBASE2016 de propriedades nucleares" (PDF) . Física Chinesa C. 41 (3): 030001. Bibcode : 2017ChPhC..41c0001A . doi : 10.1088/1674-1137/41/3/030001 ..
- Augenstein, WL; et ai. (1991). "Ingestão de flúor em crianças: uma revisão de 87 casos" . Pediatria . 88 (5): 907-912. doi : 10.1542/peds.88.5.907 . PMID 1945630 . S2CID 22106466 .
- Babel, Dietrich; Tressaud, Alain (1985). "Química de cristal de fluoretos". Em Hagenmuller, Paul (ed.). Fluoretos Sólidos Inorgânicos: Química e Física . Orlando: Academic Press. págs. 78–203. ISBN 978-0-12-412490-5.
- Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian (2008). "Controle de Cárie para Populações". Em Fejerskov, Ole; Kidd, Edwina (eds.). Cárie Dentária: A Doença e Seu Manejo Clínico (2ª ed.). Oxford: Blackwell Munksgaard. págs. 505-526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. (2000). "Excreção urinária de flúor por crianças de 4 a 6 anos em uma comunidade do sul do Texas" . Revista Panamericana de Saúde Pública . 7 (4): 242–248. doi : 10.1590/S1020-49892000000400005 . PMID 10846927 .
- Bancos, RE (1986). "Isolamento de flúor por Moissan: Definindo a cena". Jornal de Química do Flúor . 33 (1–4): 3–26. doi : 10.1016/S0022-1139(00)85269-0 .
- Barbee, K.; McCormack, K.; Vartanian, V. (2000). "Preocupações EHS com o processamento de spray de água ozonizada". Em Mendicino, L. (ed.). Questões Ambientais nas Indústrias de Eletrônicos e Semicondutores . Pennington, NJ: A Sociedade Eletroquímica. págs. 108–121. ISBN 978-1-56677-230-3.
- Barrett, CS; Meyer, L.; Wasserman, J. (1967). "Diagrama de Fase de Argônio-Flúor". O Jornal de Física Química . 47 (2): 740–743. Bibcode : 1967JChPh..47..740B . doi : 10.1063/1.1711946 .
- Barry, Patrick L.; Phillips, Tony (26 de maio de 2006). "Boas notícias e um quebra-cabeça" . Administração Nacional de Aeronáutica e Espaço . Recuperado em 6 de janeiro de 2012 .
- Bartlett, N. (1962). "Xenon Hexafluoroplatinato (V) Xe + [PtF 6 ] − ". Proceedings of the Chemical Society (6): 218. doi : 10.1039/PS9620000197 .
- Beasley, Michael (agosto de 2002). Diretrizes para o uso seguro de fluoroacetato de sódio (1080) (PDF) . Wellington: Serviço de Saúde e Segurança Ocupacional, Departamento do Trabalho (Nova Zelândia). ISBN 0-477-03664-3. Arquivado a partir do original (PDF) em 11 de novembro de 2013 . Recuperado em 11 de novembro de 2013 .
- BECK, Jefferson; Newman, Paulo; Schindler, Trent L.; Perkins, Lori (2011). "O que teria acontecido com a camada de ozônio se os clorofluorcarbonos (CFCs) não tivessem sido regulamentados?" . Administração Nacional de Aeronáutica e Espaço . Recuperado em 15 de outubro de 2013 .
- Becker, S.; Müller, BG (1990). "Tetrafluoreto de Vanádio". Angewandte Chemie Edição Internacional em Inglês . 29 (4): 406–407. doi : 10.1002/anie.199004061 .
- Bégué, Jean-Pierre; Bonnet-Delpon, Daniele (2008). Química Bioorgânica e Medicinal do Flúor . Hoboken: John Wiley & Sons. ISBN 978-0-470-27830-7.
- Betts, KS (2007). "Ácidos perfluoroalquil: o que a evidência nos diz?" . Perspectivas de Saúde Ambiental . 115 (5): A250–A256. doi : 10.1289/ehp.115-a250 . PMC 1867999 . PMID 17520044 .
- Bihary, Z.; Chaban, GM; Gerber, RB (2002). "Estabilidade de um composto de hélio quimicamente ligado em hélio sólido de alta pressão". O Jornal de Física Química . 117 (11): 5105-5108. Bibcode : 2002JChPh.117.5105B . doi : 10.1063/1.1506150 .
- Biller, José (2007). Interface de Neurologia e Medicina Interna (ed. ilustrada). Filadélfia: Lippincott Williams & Wilkins. ISBN 978-0-7817-7906-7.
- Blodgett, DW; Suruda, AJ; Crouch, BI (2001). "Intoxicações ocupacionais não intencionais fatais por ácido fluorídrico nos EUA" (PDF) . American Journal of Industrial Medicine . 40 (2): 215–220. doi : 10.1002/ajim.1090 . PMID 11494350 . Arquivado a partir do original (PDF) em 17 de julho de 2012.
- Bombourg, Nicolas (4 de julho de 2012). "Mercado Mundial de Fluoroquímicos, Freedonia" . Reporterlinker . Recuperado em 20 de outubro de 2013 .
- Brantley, LR (1949). Escudeiros, Roy; Clarke, Arthur C. (eds.). "Flúor". Pacific Rockets: Jornal da Pacific Rocket Society . South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Brody, Jane E. (10 de setembro de 2012). "Antibióticos populares podem trazer sérios efeitos colaterais" . The New York Times Bem Blog . Recuperado em 18 de outubro de 2013 .
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Termodinâmica Química do Zircônio . Amsterdã: Elsevier BV ISBN 978-0-444-51803-3.
- Burdon, J.; Emson, B.; Edwards, AJ (1987). "O gás flúor é realmente amarelo?". Jornal de Química do Flúor . 34 (3–4): 471–474. doi : 10.1016/S0022-1139(00)85188-X .
- Bürgi, HB (2000). "Movimento e Desordem na Análise da Estrutura Cristalina: Medindo e Distinguindo-os". Revisão Anual de Físico-Química . 51 : 275-296. Bibcode : 2000ARPC...51..275B . doi : 10.1146/annurev.physchem.51.1.275 . PMID 11031283 .
- Burney, H. (1999). "Passado, presente e futuro da indústria de cloro-álcalis". Em Burney, HS; Furuya, N.; Hine, F.; Ota, K.-I. (ed.). Tecnologia Cloro-Álcalis e Clorato: Simpósio Memorial RB MacMullin . Pennington: Sociedade Eletroquímica. págs. 105-126. ISBN 1-56677-244-3.
- Bustamante, E.; Pedersen, PL (1977). "Alta Glicólise Aeróbica de Células de Hepatoma de Rato em Cultura: Papel da Hexoquinase Mitocondrial" . Anais da Academia Nacional de Ciências . 74 (9): 3735-3739. Bibcode : 1977PNAS...74.3735B . doi : 10.1073/pnas.74.9.3735 . PMC 431708 . PMID 198801 .
- Buznik, VM (2009). "Química Fluoropolímero na Rússia: Situação Atual e Perspectivas". Revista Russa de Química Geral . 79 (3): 520–526. doi : 10.1134/S1070363209030335 . S2CID 97518401 .
- Cameron, AGW (1973). "Abundância dos Elementos no Sistema Solar" (PDF) . Comentários de Ciências Espaciais . 15 (1): 121–146. Bibcode : 1973SSRv...15..121C . doi : 10.1007/BF00172440 . S2CID 120201972 . Arquivado do original (PDF) em 21 de outubro de 2011.
- Carey, Charles W. (2008). Afro-americanos na Ciência . Santa Bárbara: ABC-CLIO. ISBN 978-1-85109-998-6.
- Carlson, DP; Schmiegel, W. (2000). "Fluoropolímeros, Orgânicos". Enciclopédia de Química Industrial de Ullmann . Weinheim: Wiley-VCH. págs. 495-533. doi : 10.1002/14356007.a11_393 .
- Centros de Controle e Prevenção de Doenças (2001). "Recomendações para o uso de flúor para prevenir e controlar a cárie dentária nos Estados Unidos" . Recomendações e Relatórios MMWR . 50 (RR–14): 1–42. PMID 11521913 . Recuperado em 14 de outubro de 2013 .
- Centros de Controle e Prevenção de Doenças (10 de julho de 2013). "Fluoretação da Água Comunitária" . Recuperado em 25 de outubro de 2013 .
- Câmaras, C.; Holliday, AK (1975). Química Inorgânica Moderna: Um Texto Intermediário (PDF) . Londres: Butterworth & Co. ISBN 978-0-408-70663-6. Arquivado a partir do original (PDF) em 23 de março de 2013.
- Chang, Raymond ; Goldsby, Kenneth A. (2013). Química (11ª ed.). Nova York: McGraw-Hill. ISBN 978-0-07-131787-0.
- Cheng, H.; Fowler, DE; Henderson, PB; Hobbs, JP; Pascolini, MR (1999). "Sobre a suscetibilidade magnética do flúor". O Jornal de Química Física A. 103 (15): 2861-2866. Bibcode : 1999JPCA..103.2861C . doi : 10.1021/jp9844720 .
- Cheng, KK; Chalmers, I.; Sheldon, TA (2007). "Adicionando flúor ao abastecimento de água" (PDF) . BMJ . 335 (7622): 699-702. doi : 10.1136/bmj.39318.562951.BE . PMC 2001050 . PMID 17916854 . Arquivado a partir do original (PDF) em 3 de março de 2016 . Recuperado em 26 de março de 2012 .
- Chisté, V.; Bé, MM (2011). "F-18" (PDF) . Em Bé, MM; Coursol, N.; Duchemin, B.; Lagoutine, F.; et ai. (ed.). Tabela de radionuclídeos (Relatório). CEA (Commissariat à l'énergie atomique et aux énergies alternativas), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l'Energie Atomique) . Recuperado em 15 de junho de 2011 .
- Christe, Karl O. (1986). "Síntese química de flúor elementar". Química Inorgânica . 25 (21): 3721-3722. doi : 10.1021/ic00241a001 .
- Grupo de Pesquisa Christe (sd). "Síntese química de flúor elementar" . Arquivado a partir do original em 4 de março de 2016 . Recuperado em 12 de janeiro de 2013 .
- Clark, Jim (2002). "A acidez dos haletos de hidrogênio" . chemguide.co.uk . Recuperado em 15 de outubro de 2013 .
- Clayton, Donald (2003). Manual de Isótopos no Cosmos: Hidrogênio para Gálio . Nova York: Cambridge University Press. ISBN 978-0-521-82381-4.
- Associação de Gás Comprimido (1999). Handbook of Compressed Gases (4ª ed.). Boston: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cordeiro, B.; Gómez, V.; Platero-Prats, AE; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Álvarez, S. (2008). "Raios Covalentes Revisitados". Transações Dalton (21): 2832-2838. doi : 10.1039/b801115j . PMID 18478144 .
- Cracher, Connie M. (2012). "Conceitos Atuais em Odontologia Preventiva" (PDF) . dentalcare. com. Arquivado a partir do original (PDF) em 14 de outubro de 2013 . Recuperado em 14 de outubro de 2013 .
- Croswell, Ken (setembro de 2003). "Flúor: um mistério elementar" . Céu e telescópio . Recuperado em 17 de outubro de 2013 .
- Mitchell Crow, James (2011). "Primeiros sinais de recuperação de buracos de ozônio detectados". Natureza . doi : 10.1038/news.2011.293 .
- Davis, Nicole (novembro de 2006). "Melhor que sangue" . Ciência Popular . Arquivado a partir do original em 4 de junho de 2011 . Recuperado em 20 de outubro de 2013 .
- Davy, Humphry (1813). "Algumas experiências e observações sobre as substâncias produzidas em diferentes processos químicos em espatoflúor" . Transações filosóficas da Royal Society . 103 : 263-279. doi : 10.1098/rstl.1813.0034 .
- Dean, John A. (1999). Manual de Química de Lange (15ª ed.). Nova York: McGraw-Hill. ISBN 0-07-016190-9.
- De Bergalis, Michael (2004). "Películas de fluoropolímero na indústria fotovoltaica". Jornal de Química do Flúor . 125 (8): 1255-1257. doi : 10.1016/j.jfluchem.2004.05.013 .
- Direcção-Geral do Ambiente (Comissão Europeia) (2007). Trifluralina (PDF) (Relatório). Comissão Europeia . Recuperado em 14 de outubro de 2013 .
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). "Estruturas Moleculares de Estado Sólido de Hexafluoretos de Metais de Transição". Química Inorgânica . 45 (9): 3782-3788. doi : 10.1021/ic052029f . PMID 16634614 .
- DuPont (2013a). "Freno" . Recuperado em 17 de outubro de 2013 .
- DuPont (2013b). "Compreendendo a Nomenclatura do Refrigerante 'R'" . Recuperado em 17 de outubro de 2013 .
- Eaton, Charles (1997). "Figura hfl" . E-Hand.com: O Manual Eletrônico de Cirurgia da Mão . The Hand Center (antigo consultório do Dr. Eaton) . Recuperado em 28 de setembro de 2013 .
- Edwards, Philip Neil (1994). "Uso de flúor em quimioterapia". Em Bancos, RE; Inteligente, BE; Tatlow, JC (eds.). Química Organofluorine: Princípios e Aplicações Comerciais . Nova York: Plenum Press. págs. 501-542. ISBN 978-0-306-44610-8.
- Einstein, FWB; Rao, PR; Trotter, J.; Bartlett, N. (1967). "A estrutura cristalina do trifluoreto de ouro". Jornal da Sociedade Química A: Inorgânico, Físico, Teórico . 4 : 478-482. doi : 10.1039/J19670000478 .
- Eisler, Ronald (1995). Monofluoroacetato de Sódio (1080) Perigos para Peixes, Vida Selvagem e Invertebrados: Uma Revisão Sinóptica (PDF) (Relatório). Centro de Ciências Ambientais Patuxent (Serviço Nacional Biológico dos EUA) . Recuperado em 5 de junho de 2011 .
- Ellis, Brian (2001). Essencialismo Científico . Cambridge: Cambridge University Press. ISBN 978-0-521-80094-5.
- El-Kareh, Badih (1994). Fundamentos da Tecnologia de Processamento de Semicondutores . Norwell e Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- El Saadi, MS; Hall, AH; Hall, PK; Riggs, BS; Augenstein, WL; Rumack, BH (1989). "Exposição dérmica ao ácido fluorídrico". Toxicologia Veterinária e Humana . 31 (3): 243-247. PMID 2741315 .
- Emeleus, HJ; Sharpe, AG (1974). Avanços em Química Inorgânica e Radioquímica . Vol. 16. Nova York: Academic Press. ISBN 978-0-08-057865-1.
- Emeleus, HJ; Sharpe, AG (1983). Avanços em Química Inorgânica e Radioquímica . Vol. 27. Imprensa Acadêmica. ISBN 0-12-023627-3.
- Emsley, John (1981). "A força oculta do hidrogênio" . Novo Cientista . 91 (1264): 291-292.
- Emsley, John (2011). Blocos de Construção da Natureza: Um Guia de A–Z para os Elementos (2ª ed.). Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Energetics, Inc. (1997). Perfil Energético e Ambiental da Indústria de Alumínio dos EUA (PDF) (Relatório) . Recuperado em 15 de outubro de 2013 .
- Filler, R.; Saha, R. (2009). "Flúor em Química Medicinal: um século de progresso e uma retrospectiva de 60 anos de destaques selecionados" (PDF) . Química Medicinal Futura . 1 (5): 777-791. doi : 10.4155/fmc.09.65 . PMID 21426080 . Arquivado do original (PDF) em 22 de outubro de 2013.
- Fischman, Michael L. (2001). "Perigos de fabricação de semicondutores". Em Sullivan, John B.; Krieger, Gary R. (eds.). Saúde Ambiental Clínica e Exposições Tóxicas (2ª ed.). Filadélfia: Lippincott Williams & Wilkins. págs. 431–465. ISBN 978-0-683-08027-8.
- Conselho de Alimentação e Nutrição. "Ingestão Dietética de Referência (DRIs): Ingestão Dietética Recomendada e Ingestão Adequada, Elementos" (PDF) . Instituto de Medicina, Academias Nacionais. Arquivado do original (PDF) em 13 de novembro de 2018 . Recuperado em 2 de janeiro de 2019 .
- Forster, P.; Ramaswamy, V.; Artaxó, P.; Berntsen, T.; Betts, R.; Fahey, DW; Haywood, J.; Lean, J.; Lowe, DC; Myhre, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. (2007). "Mudanças nos constituintes atmosféricos e no forçamento radiativo". Em Salomão, S.; Manning, M.; Chen, Z.; Marquês, M.; Averyt, KB; Tignor, M.; Miller, HL (eds.). Mudança Climática 2007: A Base da Ciência Física. Contribuição do Grupo de Trabalho I para o Quarto Relatório de Avaliação do Painel Intergovernamental sobre Mudanças Climáticas . Cambridge: Universidade de Cambridge. págs. 129–234. ISBN 978-0-521-70596-7.
- Fulton, Robert B.; Miller, M. Michael (2006). "Flúorpar". Em Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (eds.). Minerais e Rochas Industriais: Mercadorias, Mercados e Usos . Littleton: Sociedade para Mineração, Metalurgia e Exploração (EUA). págs. 461-473. ISBN 978-0-87335-233-8.
- Gabriel, JL; Miller Jr, TF; Wolfson, MR; Shaffer, TH (1996). "Relações Quantitativas Estrutura-Atividade de Hetero-Hidrocarbonetos Perfluorados como Meio Respiratório Potencial". Revista ASAIO . 42 (6): 968-973. doi : 10.1097/00002480-199642060-00009 . PMID 8959271 . S2CID 31161098 .
- Ganhos, Paul (18 de outubro de 1998). "Uma Nova Ameaça no Doping Sanguíneo" . O New York Times . Recuperado em 18 de outubro de 2013 .
- Gessner, BD; Beller, M.; Middaugh, JP; Whitford, GM (1994). "Intoxicação aguda por flúor de um sistema público de água". New England Journal of Medicine . 330 (2): 95–99. doi : 10.1056/NEJM199401133300203 . PMID 8259189 .
- Giesy, JP; Kannan, K. (2002). "Treactantes Perfluoroquímicos no Meio Ambiente" . Ciência e Tecnologia Ambiental . 36 (7): 146A-152A. Bibcode : 2002EnST...36..146G . doi : 10.1021/es022253t . PMID 11999053 .
- Godfrey, SM; McAuliffe, CA; Mackie, AG; Pritchard, RG (1998). "Derivados inorgânicos dos elementos". Em Norman, Nicholas C. (ed.). Química do Arsênico, Antimônio e Bismuto . Londres: Blackie Academic & Professional. págs. 67-158. ISBN 978-0-7514-0389-3.
- Verde, SW; Slinn, DSL; Simpson, RNF; Woytek, AJ (1994). "Fluidos de perfluorocarbono". Em Bancos, RE; Inteligente, BE; Tatlow, JC (eds.). Química Organofluorine: Princípios e Aplicações . Nova York: Plenum Press. págs. 89-119. ISBN 978-0-306-44610-8.
- Greenwood, NN; Earnshaw, A. (1998). Química dos Elementos (2ª ed.). Oxford: Butterworth Heinemann. ISBN 0-7506-3365-4.
- Gribble, GW (2002). "Organofluorinas que ocorrem naturalmente". Em Neison, AH (ed.). Organofluorinas . O Manual de Química Ambiental. Vol. 3N. Berlim: Springer. págs. 121–136. doi : 10.1007/10721878_5 . ISBN 3-540-42064-9.
- Grot, Walter (2011). Ionômeros fluorados (2ª ed.). Oxford e Waltham: Elsevier. ISBN 978-1-4377-4457-6.
- Hagmann, WK (2008). "Os muitos papéis do flúor na química medicinal". Revista de Química Medicinal . 51 (15): 4359-4369. doi : 10.1021/jm800219f . PMID 18570365 .
- Harbison, GS (2002). "A polaridade do dipolo elétrico do solo e estados excitados metaestáveis de baixa altitude de NF". Jornal da Sociedade Americana de Química . 124 (3): 366–367. doi : 10.1021/ja0159261 . PMID 11792193 .
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. (2007). "Reação entre dióxido de carbono e flúor elementar". Jornal de Química do Flúor . 128 (1): 17–28. doi : 10.1016/j.jfluchem.2006.09.002 . HD : 10098/1665 . S2CID 95754841 .
- Haxel, GB; Hedrick, JB; Orris, GJ (2005). Stauffer, PH; Hendley II, JW (eds.). Elementos de Terras Raras—Recursos Críticos para Alta Tecnologia, Fact Sheet 087-02 (Relatório). US Geological Survey . Recuperado em 31 de janeiro de 2014 .
- Haynes, William M., ed. (2011). Manual de Química e Física (92ª ed.). Boca Raton: CRC Press. ISBN 978-1-4398-5511-9.
- Hoffman, Robert; Nelson, Lewis; Howland, Maria; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis (2007). Manual de Emergências Toxicológicas de Goldfrank . Nova York: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Honeywell (2006). Tratamento médico recomendado para exposição ao ácido fluorídrico (PDF) . Morristown: Honeywell International. Arquivado a partir do original (PDF) em 8 de outubro de 2013 . Recuperado em 9 de janeiro de 2014 .
- Hoogers, G. (2002). "Componentes da célula de combustível e seu impacto no desempenho". Em Hoogers, G. (ed.). Manual de Tecnologia de Células de Combustível . Boca Raton: CRC Press. págs. 4-1–4-27. ISBN 0-8493-0877-1.
- Hounshell, David A.; Smith, John Kelly (1988). Ciência e Estratégia Corporativa: DuPont R & D, 1902–1980 . Cambridge: Cambridge University Press. ISBN 0-521-32767-9.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. (2004). "Hexafluorine vs. Descontaminação padrão para reduzir a toxicidade sistêmica após a exposição dérmica ao ácido fluorídrico". Toxicologia Clínica . 42 (4): 355–361. doi : 10.1081/CLT-120039541 . PMID 15461243 . S2CID 27090208 .
- ICIS (2 de outubro de 2006). "O Tesouro do Flúor" . Reed informações comerciais . Recuperado em 24 de outubro de 2013 .
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. (2000). "Flúor". Enciclopédia de Química Industrial de Ullmann . Weinheim: Wiley-VCH. pp. 381-395. doi : 10.1002/14356007.a11_293 .
- Johnson, Linda A. (28 de dezembro de 2011). "Contra as probabilidades, Lipitor se tornou o mais vendido do mundo" . O Globo de Boston . Recuperado em 24 de outubro de 2013 .
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. (2006). "Ventilação Líquida Parcial em Pacientes Adultos com Síndrome do Desconforto Respiratório Agudo". American Journal of Respiratory and Critical Care Medicine . 173 (8): 882–9. doi : 10.1164/rccm.200508-1196OC . PMID 16254269 .
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo (1999). "Experiência SIM". Em Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (eds.). Materiais e aglomerados mesoscópicos: suas propriedades físicas e químicas . Tóquio: Kodansha. pp. 259-273. ISBN 4-06-208635-2.
- Kelly, TD; Miller, MM (2005). "Estatísticas históricas de espatoflúor" . Serviço Geológico dos EUA . Recuperado em 10 de fevereiro de 2014 .
- Keplinger, ML; Suissa, LW (1968). "Toxicidade da inalação de curto prazo de flúor". Jornal da Associação Americana de Higiene Industrial . 29 (1): 10–18. doi : 10.1080/00028896809342975 . PMID 5667185 .
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, JW; Rotella, FJ; Soderholm, L.; Cort, B.; Tinkle, M.; Oeste, M.; Hoisington, D.; Lander, GA (1994). "Variação de temperatura dos parâmetros estruturais em tetrafluoretos de actinídeos" . O Jornal de Física Química . 101 (11): 9333-9337. Bibcode : 1994JChPh.101.9333K . doi : 10.1063/1.467963 .<
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. (2000). "Um composto de argônio estável" . Natureza . 406 (6798): 874-876. Bibcode : 2000Natur.406..874K . doi : 10.1038/35022551 . PMID 10972285 . S2CID 4382128 .
- Rei, DE; Malone, R.; Lilley, SH (2000). "Nova Classificação e Atualização sobre os Antibióticos Quinolonas" . Médico de Família Americano . 61 (9): 2741-2748. PMID 10821154 . Recuperado em 8 de outubro de 2013 .
- Kirsch, Peer (2004). Química Fluororgânica Moderna: Síntese, Reatividade, Aplicações . Weinheim: Wiley-VCH. ISBN 978-3-527-30691-6.
- Kissa, Erik (2001). Surfactantes e Repelentes Fluorados (2ª ed.). Nova York: Marcel Dekker. ISBN 978-0-8247-0472-8.
- Kuriakose, AK; Margrave, JL (1965). "Cinética das reações de flúor elementar. IV. Fluoração de grafite". Revista de Química Física . 69 (8): 2772-2775. doi : 10.1021/j100892a049 .
- Lagow, RJ (1970). As reações do flúor elementar; Uma Nova Abordagem à Química do Flúor (PDF) (PhD, Rice University, TX). Ann Arbor: UMI.
- Lau, C.; Anitole, K.; Hodes, C.; Liderar.; Pfahles-Hutchens, A.; Semente, J. (2007). "Ácidos Perfluoroalquil: Uma Revisão de Monitoramento e Achados Toxicológicos" . Ciências Toxicológicas . 99 (2): 366–394. doi : 10.1093/toxsci/kfm128 . PMID 17519394 .
- Lee, Stephen; et ai. (2014). "Plantas contendo monofluoroacetato que são potencialmente tóxicas para o gado". Revista de Química Agrícola e Alimentar . Publicações ACS. 62 (30): 7345-7354. doi : 10.1021/jf500563h . PMID 24724702 .
- Lewars, Errol G. (2008). Modelagem de maravilhas: antecipação computacional de novas moléculas . Dordrecht: Springer. ISBN 978-1-4020-6972-7.
- Lide, David R. (2004). Manual de Química e Física (84ª ed.). Boca Raton: CRC Press. ISBN 0-8493-0566-7.
- Lidin, R.; Molochko, VA; Andreeva, LL (2000). Химические свойства неорганических веществ [ Propriedades químicas de substâncias inorgânicas ] (em russo). Moscou: Khimiya. ISBN 5-7245-1163-0.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcom, H. (2002). Critérios de Saúde Ambiental 227 (Flúor) . Genebra: Programa das Nações Unidas para o Meio Ambiente; Organização Internacional do Trabalho; Organização Mundial da Saúde. ISBN 92-4-157227-2. Recuperado em 14 de outubro de 2013 .
- Lusty, PAJ; Brown, TJ; Ward, J.; Bloomfield, S. (2008). "A necessidade de produção indígena de espatoflúor na Inglaterra" . Serviço Geológico Britânico . Recuperado em 13 de outubro de 2013 .
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introdução à Química Inorgânica Moderna (6ª ed.). Cheltenham: Nelson Thornes. ISBN 0-7487-6420-8.
- MACOMBER, Roger (1996). Química Orgânica . Vol. 1. Sausalito: Livros de Ciências da Universidade. ISBN 978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). "Observação relativa a une volatilisation remarquable d'une partie de l'espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d'hesperos; laquelle volatilisation a été effectuée au moyen des acides" [ Observação de uma notável volatilização de parte de um tipo de pedra a que se dá o nome de flosse, flüsse, flus-spaht, bem como a de hesperos; cuja volatilização foi efectuada por meio de ácidos]. Mémoires de l'Académie royale des sciences et belles-lettres (em francês). XXIV : 3-11.
- Martin, John W., ed. (2007). Enciclopédia Concisa da Estrutura dos Materiais . Oxford e Amsterdã: Elsevier. ISBN 978-0-08-045127-5.
- Maria, CM (2011). Um livro didático de Odontologia em Saúde Pública . Nova Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-216-1.
- Matsui, M. (2006). "Corantes contendo flúor". Em Kim, Sung-Hoon (ed.). Corantes funcionais . Orlando: Academic Press. pp. 257-266. ISBN 978-0-12-412490-5.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. (2012). "Ressonância Magnética Nuclear e Espectroscopia de Ressonância de Spin Eletrônica". Enciclopédia de Química Industrial de Ullmann . Weinheim: Wiley-VCH. págs. 609-660. doi : 10.1002/14356007.b05_471 .
- Meyer, Eugene (1977). Química de Materiais Perigosos . Penhascos de Englewood: Prentice Hall. ISBN 978-0-13-129239-0.
- Miller, M. Michael (2003a). "Fluorspar" (PDF) . Anuário de Minerais do Serviço Geológico dos EUA . US Geological Survey. págs. 27.1–27.12.
- Miller, M. Michael (2003b). "Recurso Mineral do Mês, Espatoflúor" (PDF) . US Geological Survey . Recuperado em 24 de outubro de 2013 .
- Mitchell, E. Siobhan (2004). Antidepressivos . Nova York: Chelsea House Publishers. ISBN 978-1-4381-0192-7.
- Moeller, T.; Bailar, JC; Kleinberg (1980). Química, com Análise Qualitativa Inorgânica (3ª ed.). Nova York: Academic Press. ISBN 0-12-503350-8.
- Moissan, Henri (1886). "Action d'un courant électrique sur l'acid fluorhydrique anidrido" . Comptes rendus hebdomadaires des séances de l'Académie des sciences (em francês). 102 : 1543-1544 . Recuperado em 9 de outubro de 2013 .
- McCoy, M. (2007). "Os desafios do mercado de pesquisa diminuem a confiança dos CEOs químicos do mundo". Notícias de Química e Engenharia . 85 (23): 11. doi : 10.1021/cen-v085n023.p011a .
- Moore, John W.; Stanitski, Conrad L.; Jus, Peter C. (2010). Princípios de Química: A Ciência Molecular . Belmont: Brooks/Cole. ISBN 978-0-495-39079-4.
- Morrow, SI; Perry, DD; Cohen, MS (1959). "A formação de dinitrogênio tetrafluoreto na reação de flúor e amônia". Jornal da Sociedade Americana de Química . 81 (23): 6338-6339. doi : 10.1021/ja01532a066 .
- Muller, Peter (2009). "5.067 Refinamento da estrutura cristalina" (PDF) . Cambridge: MIT OpenCourseWare . Recuperado em 13 de outubro de 2013 .
- Murphy, CD; Schafrath, C.; O'Hagan, D. (2003). "Produtos Naturais Fluorados: A Biossíntese de Fluoroacetato e 4-Fluorotreonina em Streptomyces cattleya ". Quimiosfera . 52 (2): 455–461. Bibcode : 2003Chmsp..52..455M . doi : 10.1016/S0045-6535(03)00191-7 . PMID 12738270 .
- Murthy, C. Parameshwara; Mehdi Ali, SF; Ashok, D. (1995). Química Universitária . Vol. I. Nova Deli: Nova Era Internacional. ISBN 978-81-224-0742-6.
- Conselho Nacional de Saúde e Pesquisa Médica (2007). Uma Revisão Sistemática da Eficácia e Segurança da Fluoretação, Parte A: Revisão da Metodologia e Resultados (PDF) . Camberra: Governo australiano. ISBN 978-1-86496-421-9. Arquivado a partir do original (PDF) em 13 de janeiro de 2012 . Recuperado em 8 de outubro de 2013 .
- O Instituto Nacional de Segurança e Saúde Ocupacional (1994). "Flúor" . Documentação para Concentrações Imediatamente Perigosas à Vida ou à Saúde (IDLHs) . Recuperado em 15 de janeiro de 2014 .
- O Instituto Nacional de Segurança e Saúde Ocupacional (1994). "Cloro" . Documentação para Concentrações Imediatamente Perigosas à Vida ou à Saúde (IDLHs) . Recuperado em 13 de julho de 2014 .
- Centro Nacional de Dados Nucleares . "Banco de dados NuDat 2.1" . Laboratório Nacional de Brookhaven . Recuperado em 25 de outubro de 2013 .
- Administração Nacional Oceânica e Atmosférica. "UN/NA 1045 (Folha de Dados de Flúor das Nações Unidas/América do Norte)" . Recuperado em 15 de outubro de 2013 .
- Navarrini, Walter; Venturini, Francesco; Tortelli, Vito; Basak, Soubir; Pimparkar, Ketan P.; Adamo, Andréa; Jensen, Klavs F. (2012). "Fluoração direta de monóxido de carbono em microrreatores". Jornal de Química do Flúor . 142 : 19-23. doi : 10.1016/j.jfluchem.2012.06.006 .
- Nelson, Eugene W. (1947). "'Bad Man' of The Elements" . Popular Mechanics . 88 (2): 106–108, 260.
- Nelson, JM; Chiller, TM; Potências, JH; Ângulo, FJ (2007). "Segurança Alimentar: Espécies de Campylobacter Resistente a Fluoroquinolonas e a Retirada de Fluoroquinolonas de Uso em Aves: Uma História de Sucesso em Saúde Pública" (PDF) . Doenças Infecciosas Clínicas . 44 (7): 977-980. doi : 10.1086/512369 . PMID 17342653 .
- Nielsen, Forrest H. (2009). "Micronutrientes em Nutrição Parenteral: Boro, Silício e Flúor" . Gastroenterologia . 137 (5): S55-60. doi : 10.1053/j.gastro.2009.07.072 . PMID 19874950 . Recuperado em 29 de abril de 2018 .
- Norwood, Charles J.; Fohs, F. Julius (1907). Kentucky Geological Survey, Boletim No. 9: Fluorspar Deposits of Kentucky . Pesquisa Geológica de Kentucky.
- Nouri, S.; Silvi, B.; Gillespie, RJ (2002). "Ligação química em moléculas hipervalentes: a regra do octeto é relevante?" (PDF) . Química Inorgânica . 41 (8): 2164-2172. doi : 10.1021/ic011003v . PMID 11952370 . Recuperado em 23 de maio de 2012 .
- O'Hagan, D. (2008). "Compreendendo a Química Organofluorine. Uma Introdução ao C-F Bond". Revisões da Sociedade Química . 37 (2): 308–319. doi : 10.1039/b711844a . PMID 18197347 .
- O'Hagan, D.; Schafrath, C.; Cobb, SL; Hamilton, JTG; Murphy, CD (2002). "Bioquímica: Biossíntese de uma Molécula Organofluorine" . Natureza . 416 (6878): 279. Bibcode : 2002Natur.416..279O . doi : 10.1038/416279a . PMID 11907567 . S2CID 4415511 .
- Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. (1998). "Características de transporte de íons e água de membranas de Nafion como eletrólitos". Electrochimica Acta . 43 (24): 3741-3747. doi : 10.1016/S0013-4686(98)00132-7 .
- Okazoe, T. (2009). "Visão geral sobre a história da química organofluorada do ponto de vista da indústria de materiais" . Anais da Academia do Japão, Série B. 85 (8): 276–289. Bibcode : 2009PJAB...85..276O . doi : 10.2183/pjab.85.276 . PMC 3621566 . PMID 19838009 .
- Olivares, M.; Uauy, R. (2004). Nutrientes Essenciais na Água Potável (Esboço) (PDF) (Relatório). Organização Mundial da Saúde (OMS). Arquivado a partir do original (PDF) em 19 de outubro de 2012 . Recuperado em 14 de outubro de 2013 .
- Parente, Lucas (2001). "O desenvolvimento de glicocorticóides sintéticos". Em Goulding, Nicolas J.; Flor, Rod J. (eds.). Glicocorticóides . Basileia: Birkhäuser. págs. 35–53. ISBN 978-3-7643-6059-7.
- Partington, JR (1923). "A história inicial do ácido fluorídrico". Memoirs and Proceedings of the Manchester Literary and Philosophical Society . 67 (6): 73–87.
- Patnaik, Pradyot (2007). Um guia abrangente para as propriedades perigosas de substâncias químicas (3ª ed.). Hoboken: John Wiley & Sons. ISBN 978-0-471-71458-3.
- Pauling, Linus (1960). A Natureza da Ligação Química (3ª ed.). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0.
- Pauling, L.; Keaveny, I.; Robinson, AB (1970). "A Estrutura Cristalina de α-Flúor". Jornal de Química do Estado Sólido . 2 (2): 225–227. Bibcode : 1970JSSCh...2..225P . doi : 10.1016/0022-4596(70)90074-5 .
- Perry, Dale L. (2011). Manual de Compostos Inorgânicos (2ª ed.). Boca Raton: CRC Press. ISBN 978-1-4398-1461-1.
- Pitter, KS (1975). "Fluoretos de Radon e Elemento 118" . Jornal da Sociedade Química, Chemical Communications (18): 760b-761. doi : 10.1039/C3975000760B .
- Pitzer, Kenneth S. , ed. (1993). Estrutura Molecular e Termodinâmica Estatística: Trabalhos Selecionados de Kenneth S. Pitzer . Cingapura: Publicação Científica Mundial. ISBN 978-981-02-1439-5.
- Pizzo, G.; Piscopo, MR; Pizzo, I.; Giuliana, G. (2007). "Fluoretação da Água Comunitária e Prevenção da Cárie: Uma Revisão Crítica" (PDF) . Investigações Orais Clínicas . 11 (3): 189–193. doi : 10.1007/s00784-007-0111-6 . PMID 17333303 . S2CID 13189520 .
- Posner, Stefan (2011). "Compostos Perfluorados: Ocorrência e Usos em Produtos". Em Knepper, Thomas P.; Grande, Frank T. (eds.). Produtos Químicos Polifluorados e Produtos de Transformação . Heidelberg: Springer Science+Business Media. págs. 25–40. ISBN 978-3-642-21871-2.
- Posner, Stefan; et ai. (2013). Substâncias per e polifluoradas nos países nórdicos: ocorrência de uso e toxicologia (PDF) . Copenhaga: Conselho Nórdico de Ministros. doi : 10.6027/TN2013-542 . ISBN 978-92-893-2562-2.
- Preskorn, Sheldon H. (1996). Farmacologia Clínica de Inibidores Seletivos da Recaptação de Serotonina . Caddo: Comunicação Profissional. ISBN 978-1-884735-08-0.
- Príncipe, Lawrence M. (2012). Os Segredos da Alquimia . Chicago: University of Chicago Press. ISBN 978-0-226-68295-2.
- Proudfoot, AT; Bradberry, SM; Vale, JA (2006). "Intoxicação por Fluoroacetato de Sódio". Revisões toxicológicas . 25 (4): 213–219. doi : 10.2165/00139709-200625040-00002 . PMID 17288493 . S2CID 29189551 .
- PRWeb (28 de outubro de 2010). "Mercado global de fluoroquímicos deve ultrapassar 2,6 milhões de toneladas até 2015, de acordo com um novo relatório da Global Industry Analysts, Inc" . prweb . com . Recuperado em 24 de outubro de 2013 .
- PRWeb (23 de fevereiro de 2012). "O mercado global de espatoflúor atingirá 5,94 milhões de toneladas métricas até 2017, de acordo com o novo relatório da Global Industry Analysts, Inc" . prweb . com . Recuperado em 24 de outubro de 2013 .
- PRWeb (7 de abril de 2013). "O mercado de fluoropolímeros está pronto para crescer a um CAGR de 6,5% e atingir US $ 9.446,0 milhões até 2016 - Novo relatório da MarketsandMarkets" . prweb . com . Recuperado em 24 de outubro de 2013 .
- Pyykkö, Pekka; Atsumi, Michiko (2009). "Raios Covalentes de Ligação Dupla Molecular para Elementos Li-E112". Química: Um Jornal Europeu . 15 (46): 12770-9. doi : 10.1002/chem.200901472 . PMID 19856342 .
- Raghavan, PS (1998). Conceitos e Problemas em Química Inorgânica . Delhi: Discovery Publishing House. ISBN 978-81-7141-418-5.
- Raj, P. Prithvi; Erdine, Serdar (2012). Procedimentos de Alívio da Dor: O Guia Ilustrado . Chichester: John Wiley & Sons. ISBN 978-0-470-67038-5.
- Ramkumar, Jayshree (2012). "Membrana Nafion Perfluorosulfonate: Propriedades únicas e várias aplicações". Em Banerjee, S.; Tyagi, AK (eds.). Materiais Funcionais: Preparação, Processamento e Aplicações . Londres e Waltham: Elsevier. págs. 549-578. ISBN 978-0-12-385142-0.
- Reddy, D. (2009). "Neurologia da Fluorose Esquelética Endêmica" . Neurologia Índia . 57 (1): 7–12. doi : 10.4103/0028-3886.48793 . PMID 19305069 .
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Kátia; Smith, Verne V. (2004). "Sobre a origem do flúor na Via Láctea". Avisos Mensais da Royal Astronomical Society . 354 (2): 575-580. arXiv : astro-ph/0410580 . Bibcode : 2004MNRAS.354..575R . doi : 10.1111/j.1365-2966.2004.08215.x . S2CID 12330666 .
- Renner, R. (2006). "O longo e o curto de substituições perfluoradas" . Ciência e Tecnologia Ambiental . 40 (1): 12–13. Bibcode : 2006EnST...40...12R . doi : 10.1021/es062612a . PMID 16433328 .
- Rhoades, David Walter (2008). Estudos de espectroscopia dielétrica de banda larga de Nafion (dissertação de doutorado, University of Southern Mississippi, MS). Ana Arbor. ISBN 978-0-549-78540-8.
- Richter, M.; Hahn, O.; Fuchs, R. (2001). "Fluorita roxa: pigmento de um artista pouco conhecido e seu uso na pintura gótica tardia e início do renascimento no norte da Europa". Estudos em Conservação . 46 (1): 1–13. doi : 10.1179/sic.2001.46.1.1 . JSTOR 1506878 . S2CID 191611885 .
- Riedel, Sebastião; Kaupp, Martin (2009). "Os estados de oxidação mais altos dos elementos de metal de transição". Revisões de Química de Coordenação . 253 (5–6): 606–624. doi : 10.1016/j.ccr.2008.07.014 .
- Ripa, LW (1993). "Um meio século de fluoretação da água comunitária nos Estados Unidos: revisão e comentário" (PDF) . Revista de Odontologia em Saúde Pública . 53 (1): 17–44. doi : 10.1111/j.1752-7325.1993.tb02666.x . PMID 8474047 . Arquivado do original (PDF) em 4 de março de 2009.
- Roblin, I.; Urbano, M.; Flicoteau, D.; Martinho, C.; Pradeau, D. (2006). "Tratamento tópico de queimaduras experimentais na pele com ácido fluorídrico por 2,5% de gluconato de cálcio". Journal of Burn Care & Research . 27 (6): 889-894. doi : 10.1097/01.BCR.0000245767.54278.09 . PMID 17091088 . S2CID 3691306 .
- Salager, Jean-Louis (2002). Surfactantes: Tipos e Usos (PDF) . Livreto FIRP # 300-A. Laboratório de Formulação, Interfaces, Reologia e Processos, Universidad de los Andes . Recuperado em 13 de outubro de 2013 .
- Sandford, Graham (2000). "Química Organofluorine". Transações Filosóficas . 358 (1766): 455-471. Bibcode : 2000RSPTA.358..455S . doi : 10.1098/rsta.2000.0541 . S2CID 202574641 .
- Sarkar, S. (2008). "Sangue Artificial" . Indian Journal of Critical Care Medicine . 12 (3): 140–144. doi : 10.4103/0972-5229.43685 . PMC 2738310 . PMID 19742251 .
- Scheele, Carl Wilhelm (1771). "Undersŏkning om fluss-spat och dess syra" [Investigação de Fluorita e seu Ácido]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (em sueco). 32 : 129-138.
- Schimmeyer, S. (2002). "A Busca por um Substituto de Sangue" . Iluminar . Columbia: Universidade da Carolina do Sul. 15 (1). Arquivado a partir do original em 2 de outubro de 2011 . Recuperado em 15 de outubro de 2013 .
- Schlöder, T.; Riedel, S. (2012). "Investigação de Cátions Radicais Heterodiméricos e Homodiméricos da Série: [F 2 O 2 ] + , [F 2 Cl 2 ] + , [Cl 2 O 2 ] + , [F 4 ] + e [Cl 4 ] + ". Avanços RSC . Sociedade Real de Química . 2 (3): 876-881. Bibcode : 2012RSCd...2..876S . doi : 10.1039/C1RA00804H .
- Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian (2012). "Ocorrência de Difluorine F2 na Natureza-In Situ Prova e Quantificação por Espectroscopia de RMN". Edição Internacional de Angewandte Chemie . 51 (31): 7847-7849. doi : 10.1002/anie.201203515 . ISSN 1521-3773 . PMID 22763992 .
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). "Uso de flúor-18 Fluoro-2-desoxi-D-glicose Tomografia por emissão de pósitrons na avaliação do processo de espondilite tuberculosa" (PDF) . Jornal de Distúrbios da Coluna Vertebral . 13 (6): 541-544. doi : 10.1097/00002517-200012000-00016 . PMID 11132989 . Recuperado em 8 de outubro de 2013 .
- Schulze-Makuch, D.; Irwin, LN (2008). A vida no universo: expectativas e restrições (2ª ed.). Berlim: Springer-Verlag. ISBN 978-3-540-76816-6.
- Schwarcz, Joseph A. (2004). A mosca na pomada: 70 comentários fascinantes sobre a ciência da vida cotidiana . Toronto: ECW Press. ISBN 1-55022-621-5.
- Senning, A. (2007). Dicionário de Quimioetimologia de Elsevier: Os Whies e as origens da nomenclatura química e terminologia . Amsterdã e Oxford: Elsevier. ISBN 978-0-444-52239-9.
- Shaffer, TH; Wolfson, MR; Clark Jr, LC (1992). "Ventilação Líquida". Pneumologia Pediátrica . 14 (2): 102–109. doi : 10.1002/ppul.1950140208 . PMID 1437347 . S2CID 222167378 .
- Shin, Richard D.; Silverberg, Mark A. (2013). "Toxicidade de Flúor" . Medscape . Recuperado em 15 de outubro de 2013 .
- Shriver, Duward; Atkins, Pedro (2010). Manual de Soluções para Química Inorgânica . Nova York: WH Freeman. ISBN 978-1-4292-5255-3.
- Shulman, JD; Wells, LM (1997). "Toxicidade aguda de flúor por ingestão de produtos odontológicos de uso doméstico em crianças, do nascimento aos 6 anos de idade". Revista de Odontologia em Saúde Pública . 57 (3): 150–158. doi : 10.1111/j.1752-7325.1997.tb02966.x . PMID 9383753 .
- Siegemund, GN; Schwertfeger, W.; Feiring, A.; Inteligente, B.; Behr, F.; Vogel, H.; McKusick, B. (2000). "Compostos de flúor, orgânicos". Enciclopédia de Química Industrial de Ullmann . Vol. 15. Weinheim: Wiley-VCH. doi : 10.1002/14356007.a11_349 .
- Slye, Orville M. (2012). "Agentes Extintores de Incêndio". Em Ullmann, Franz (ed.). Enciclopédia de Química Industrial de Ullmann . Vol. 15. Weinheim: Wiley-VCH. pp. 1–11. doi : 10.1002/14356007.a11_113.pub2 . ISBN 978-3527306732.
- Steenland, K.; Fletcher, T.; Savitz, DA (2010). "Evidência epidemiológica sobre os efeitos na saúde do ácido perfluorooctanóico (PFOA)" . Perspectivas de Saúde Ambiental . 118 (8): 1100–1108. doi : 10.1289/ehp.0901827 . PMC 2920088 . PMID 20423814 .
- Stillman, John Maxson (dezembro de 1912). "Basil Valentine, uma farsa do século XVII" . Mensal Ciência Popular . 81 . Recuperado em 14 de outubro de 2013 .
- Storer, Frank H. (1864). Primeiros esboços de um dicionário de solubilidades de substâncias químicas . Cambridge: Sever e Francis.
- Swinson, Joel (junho de 2005). "Flúor – um elemento vital na caixa de remédios" (PDF) . PharmaChem . Química Farmacêutica: 26–27. Arquivado do original (PDF) em 8 de fevereiro de 2012 . Recuperado em 9 de outubro de 2013 .
- Taber, Andrew (22 de abril de 1999). "Morrendo para montar" . Salão . Recuperado em 18 de outubro de 2013 .
- Tanner Industries (janeiro de 2011). "Amoníaco Anidro: (MSDS) Ficha de Dados de Segurança do Material" . tannerind . com . Recuperado em 24 de outubro de 2013 .
- Theodoridis, George (2006). "Agroquímicos contendo flúor: uma visão geral dos desenvolvimentos recentes". Em Tressaud, Alain (ed.). Flúor e o Meio Ambiente: Agroquímicos, Arqueologia, Química Verde e Água . Amsterdã e Oxford: Elsevier. págs. 121–176. ISBN 978-0-444-52672-4.
- Toon, Richard (1 de setembro de 2011). "A descoberta do flúor" . Educação em Química . Vol. 48, nº. 5. Sociedade Real de Química . pp. 148-151. ISSN 0013-1350 .
- Pesquisa de Mercado de Transparência (17 de maio de 2013). "Espera-se que o mercado de fluoroquímicos atinja US$ 21,5 bilhões globalmente até 2018: pesquisa de mercado de transparência" . Blog de Pesquisa de Mercado de Transparência. Arquivado a partir do original em 22 de fevereiro de 2014 . Recuperado em 15 de outubro de 2013 .
- Ullmann, Fritz (2008). Fibras de Ullmann (2 volumes). Weinheim: Wiley-VCH. ISBN 978-3-527-31772-1.
- Agência de Proteção Ambiental dos Estados Unidos (1996). "Fatos RED: Trifluralin" (PDF) . Arquivado a partir do original (PDF) em 18 de outubro de 2013 . Recuperado em 17 de outubro de 2013 .
- Agência de Proteção Ambiental dos Estados Unidos (2012). "contaminantes emergentes - sulfonato de perfluorooctano (PFOS) e ácido perfluorooctanoico (PFOA)" (PDF) . Arquivado a partir do original (PDF) em 29 de outubro de 2013 . Recuperado em 4 de novembro de 2013 .
- Agência de Proteção Ambiental dos Estados Unidos (2013a). "Substâncias que destroem a camada de ozônio" . Arquivado a partir do original em 10 de dezembro de 2010 . Recuperado em 15 de outubro de 2013 .
- Agência de Proteção Ambiental dos Estados Unidos (2013b). "Faseout de HCFCs (Substâncias que destroem a camada de ozônio Classe II)" . Recuperado em 15 de outubro de 2013 .
- Viel, Claude; Goldwhite, Harold (1993). "1906 Prêmio Nobel: Henri Moissan, 1852-1907". Em Laylin, K. James (ed.). Prêmios Nobel de Química, 1901-1992 . Washington: Sociedade Americana de Química; Fundação Património Químico. págs. 35–41 . ISBN 978-0-8412-2690-6.
- Vigoureux, P. (1961). "A relação giromagnética do próton". Física Contemporânea . 2 (5): 360–366. Bibcode : 1961ConPh...2..360V . doi : 10.1080/00107516108205282 .
- Villalba, Gara; Ayres, Robert U.; Schroder, Hans (2008). "Contabilidade de flúor: produção, uso e perda". Jornal de Ecologia Industrial . 11 : 85-101. doi : 10.1162/jiec.2007.1075 . S2CID 153740615 .
- Walsh, Kenneth A. (2009). Berílio Química e Processamento . Parque de Materiais: ASM International. ISBN 978-0-87170-721-5.
- Walter, P. (2013). "Honeywell investe US $ 300 milhões em refrigerante verde" . Mundo da Química .
- Semanas, ME (1932). "A Descoberta dos Elementos. XVII. A Família do Halogênio". Revista de Educação Química . 9 (11): 1915-1939. Bibcode : 1932JChEd...9.1915W . doi : 10.1021/ed009p1915 .
- Werner, NL; Hecker, MT; Sethi, AK; Burro, CJ (2011). "Uso desnecessário de Antibióticos Fluoroquinolonas em Pacientes Hospitalizados" . BMC Doenças Infecciosas . 11 : 187-193. doi : 10.1186/1471-2334-11-187 . PMC 3145580 . PMID 21729289 .
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Química Inorgânica . San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Willey, Ronald R. (2007). Equipamentos, Materiais e Processos Práticos para Filmes Finos Ópticos . Charlevoix: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L.; Braker, William (2001). "Flúor". Matheson Gas Data Book (7ª ed.). Parsippany: Matheson Tri-Gas. ISBN 978-0-07-135854-5.
- Yeung, CA (2008). "Uma revisão sistemática da eficácia e segurança da fluoretação" . Odontologia Baseada em Evidências . 9 (2): 39–43. doi : 10.1038/sj.ebd.6400578 . PMID 18584000 .
- Young, David A. (1975). Diagramas de Fase dos Elementos (Relatório). Laboratório Lawrence Livermore . Recuperado em 10 de junho de 2011 .
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. (2013). "Ácido perfluorooctanoico (PFOA) e ácido perfluorooctanosulfônico (PFOS) em águas superficiais, sedimentos, solos e águas residuais - Uma revisão sobre concentrações e coeficientes de distribuição". Quimiosfera . 91 (6): 725–32. Bibcode : 2013Chmsp..91..725Z . doi : 10.1016/j.chemosphere.2013.02.024 . PMID 23498059 .
- Zorich, Robert (1991). Manual de Qualidade de Fabricação de Circuitos Integrados . San Diego: Academic Press. ISBN 978-0-323-14055-3.
links externos
-
 Mídia relacionada ao flúor no Wikimedia Commons
Mídia relacionada ao flúor no Wikimedia Commons