Catião 2-norbornil - 2-Norbornyl cation
Em química orgânica , o termo cátion 2-norbornil (ou cátion 2-biciclo [2.2.1] heptil ) descreve um dos três carbocations formados a partir de derivados de norbornano . Embora os cátions 1-norbornil e 7-norbornil tenham sido estudados, os estudos mais extensos e vigorosos debates foram centrados na estrutura exata do cátion 2-norbornil.
O cátion 2-norbornil foi formado a partir de uma variedade de derivados e reagentes de norbornano. Os primeiros relatórios de sua formação e reatividade publicados por Saul Winstein geraram controvérsia sobre a natureza de sua ligação , quando ele invocou uma ligação de dois elétrons de três centros para explicar a estereosseletividade do produto resultante. Herbert C. Brown desafiou esta afirmação com base no fato de que as estruturas de ressonância clássicas poderiam explicar a estereoespecificidade sem a necessidade de adaptar uma nova perspectiva de ligação. Os pontos de vista de ambos os pesquisadores tiveram seus apoiadores, e dezenas de cientistas contribuíram com experimentos engenhosamente planejados para fornecer evidências para um ponto de vista ou outro. Com o tempo, a disputa tornou-se cada vez mais acirrada e acrimoniosa, e o debate assumiu um caráter pessoal ou ad hominem .
A evidência da natureza não clássica do cátion 2-norbornila cresceu ao longo de várias décadas, principalmente por meio de dados espectroscópicos coletados usando métodos como ressonância magnética nuclear (NMR). A confirmação cristalográfica de sua natureza não clássica não veio até 2013. Embora a maioria dos químicos agora concorde que o cátion 2-norbornil em si não é clássico, também é amplamente reconhecido que a paisagem energética para carbocations tende a ser "plana", com muitos estruturas potenciais diferindo apenas minuciosamente em energia. Certamente, nem todos os carbocations bicíclicos são não clássicos; a diferença de energia entre as estruturas clássicas e não clássicas costuma ser delicadamente equilibrada. Assim, certos cátions 2-biciclo [2.2.1] heptilo alquil-substituídos são agora conhecidos por adotarem estruturas clássicas.
A natureza da ligação no cátion 2-norbornila incorporou muitas novas idéias na compreensão do campo de ligações químicas. Podem ser observadas semelhanças entre este cátion e outros, como os boranos .
Teoria
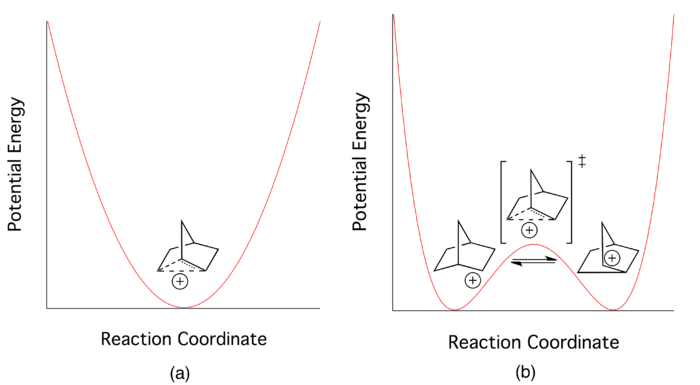
A natureza da ligação no cátion 2-norbornila foi o centro de um debate vigoroso e bem conhecido na comunidade química até meados do século XX. Enquanto a maioria dos químicos acreditava que uma ligação de dois elétrons de três centros representava melhor sua estrutura eletrônica de estado fundamental , outros argumentaram que todos os dados relativos ao cátion 2-norbornila poderiam ser explicados retratando-o como um par de cátions que se equilibra rapidamente .
No auge do debate, todos os químicos concordaram que a imagem deslocalizada da ligação de elétrons poderia ser aplicada ao cátion 2-norbornila. Mas isso não respondeu à questão fundamental em que o debate girava. Os pesquisadores continuaram a buscar novas maneiras de determinar se a imagem deslocalizada de três centros descrevia um estado de transição de baixa energia (ponto de sela na superfície de energia potencial multidimensional ) ou um mínimo de energia potencial por si só. Os proponentes da imagem "clássica" acreditavam que o sistema era melhor descrito por um potencial de poço duplo com uma barreira muito baixa, enquanto aqueles no campo "não clássico" imaginavam o estado eletrônico deslocado para descrever um único poço de energia potencial.
Hipovalência: a imagem não clássica
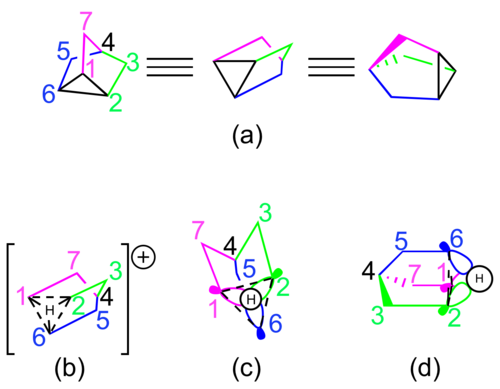
Os defensores da natureza não clássica do cátion 2-norbornil estável tipicamente retratam as espécies usando estruturas de ressonância ou uma única estrutura com ligações parciais ( ver Figura 2 ). Esta interação hipovalente pode ser imaginada como o efeito líquido de i) uma ligação sigma parcial entre os carbonos 1 e 6, ii) uma ligação sigma parcial entre os carbonos 2 e 6, e iii) uma ligação pi parcial entre os carbonos 1 e 2. Cada parcial a ligação é representada como uma ligação completa em uma das três estruturas de ressonância ou como uma ligação parcial tracejada se o cátion for representado por uma única estrutura.
Tem havido algum debate sobre o quanto a estrutura de ressonância pi-bond realmente contribui para a estrutura eletrônica deslocalizada. Por meio da espectroscopia de RMN de 1 H e 13 C , foi confirmado que pouca carga positiva repousa no carbono de metileno 6. Isso não é surpreendente, pois os carbocatos primários são muito menos estáveis do que os carbocatos secundários. No entanto, o cátion 2-norbornil pode ser formado a partir de derivados de β- (Δ 3 -ciclopentenil) -etano, indicando que a estrutura de ressonância ligada por pi é significativa.
O cátion 2-norbornila foi um dos primeiros exemplos de íon não clássico . Os íons não clássicos podem ser definidos como cátions orgânicos nos quais a densidade de elétrons de um orbital de ligação preenchido é compartilhada por três ou mais centros e contém algum caráter de ligação sigma. O cátion 2-norbornil é visto como o protótipo para íons não clássicos. Outros cátions simples, como acetileno protonado (etínio, C
2H+
3), etileno protonado (etênio, C
2H+
5), e etano protonado (etânio, C
2H+
7) foram melhor descritos como não clássicos por meio de espectroscopia de infravermelho.
A representação orbital molecular mais frequentemente proposta do cátion 2-norbornil é mostrada na Figura 3. Dois orbitais do tipo p , um em cada um dos carbonos 1 e 2, interagem com um orbital hibridizado sp 3 no carbono 6 para formar a ligação hipovalente . Cálculos estendidos da Teoria de Hückel para o cátion 2-norbornil sugerem que o orbital no carbono 6 poderia ser hibridizado sp 2 , embora isso afete apenas a geometria dos hidrogênios geminais .
Equilíbrio rápido: a imagem clássica
De acordo com os proponentes de um potencial de poço duplo clássico, o cátion 2-norbornila existe em equilíbrio dinâmico entre duas estruturas assimétricas enantioméricas . A espécie deslocalizada central para a imagem não clássica é meramente um estado de transição entre as duas estruturas. Os rearranjos de Wagner-Meerwein são invocados como o mecanismo de conversão entre os dois enantiômeros ( consulte a Figura 4 ).
Os esforços para isolar as espécies assimétricas espectroscopicamente são normalmente malsucedidos. A principal razão para essa falha são as taxas de reação direta e reversa extremamente rápidas , que indicam uma barreira potencial muito baixa para a interconversão entre os dois enantiômeros.
Nortriciclônio: outra estrutura não clássica
Alguns químicos também considerado o catião 2-norbornilo a ser melhor representada pelo ião nortricylconium, um C 3 -symmetric nortricyclene protonada. Esta descrição foi invocado pela primeira vez para explicar parcialmente os resultados de um 14 C scrambling isótopo experimento. A representação orbital molecular desta estrutura envolve uma interação em fase entre os orbitais hibridizados sp 2 dos carbonos 1, 2 e 6 e o orbital atômico 1s em um átomo de hidrogênio compartilhado ( ver Figura 5 ).
História
Íons não clássicos
Os íons não clássicos diferem dos cátions tradicionais em sua estrutura eletrônica : embora as ligações químicas sejam tipicamente representadas como o compartilhamento de elétrons entre dois átomos, os íons não clássicos estáveis podem conter três ou mais átomos que compartilham um único par de elétrons. Em 1939, Thomas Nevell e outros tentaram elucidar o mecanismo de transformação do cloridrato de canfeno em cloreto de isobornila . Em um dos mecanismos de reação propostos descritos no artigo, a carga positiva de um cátion intermediário não foi atribuída a um único átomo, mas sim à estrutura como um todo. Isso foi mais tarde citado por oponentes da descrição não clássica como a primeira vez que um íon não clássico foi invocado. No entanto, o termo "íon não clássico" não apareceu explicitamente na literatura química até mais de uma década depois, quando foi usado para marcar ligações deslocalizadas em um cátion butil piramidal.
O termo íon sinartético também foi invocado para descrever ligações deslocalizadas em carbocações estáveis antes que o termo íon não clássico fosse amplamente utilizado. Os primeiros usuários deste termo comentaram sobre a notável semelhança entre a ligação nesses tipos de cátions e a ligação em borohidretos .
Primeiras propostas não clássicas
Em 1949, Saul Winstein observou que 2- exo- norbornil brosilato ( p- bromobenzenossulfonato) e 2- endo- norbornil tosilato ( p- toluenossulfonato) deu uma mistura racêmica do mesmo produto, 2- exo- acetato de norbornil , após a acetólise ( ver Figura 6 ). Uma vez que tosilatos e brosilatos funcionam igualmente bem como grupos de saída , ele concluiu que tanto o norbornano 2- endo e 2- exo substituído devem estar passando por um intermediário catiônico comum com uma exo reatividade dominante . Ele relatou que este intermediário era provavelmente um cátion 2-norbornil simétrico e deslocalizado. Posteriormente, foi demonstrado por cromatografia em fase de vapor que a quantidade de endo epímero do produto produzido era inferior a 0,02%, comprovando a alta estereosseletividade da reação.
Quando um único enantiômero de 2- exo- norbornil brosilato sofre acetólise, nenhuma atividade óptica é observada no 2- exo- norbornil acetato resultante ( ver Figura 7 ). De acordo com a descrição não clássica do cátion 2-norbornila, o plano de simetria presente (passando pelos carbonos 4, 5 e 6) permite acesso igual a ambos os enantiômeros do produto, resultando na mistura racêmica observada .
Também foi observado que os norbornanos 2- exo- substituídos reagiram 350 vezes mais rápido do que os isômeros endo correspondentes . A assistência anquimérica da ligação sigma entre os carbonos 1 e 6 foi racionalizada como a explicação para este efeito cinético. É importante ressaltar que a assistência anquimérica invocada levou muitos químicos a postular que a estabilidade energética do cátion 2-norbornila era diretamente devido à estrutura simétrica em ponte invocada na explicação não clássica. No entanto, alguns outros autores ofereceram explicações alternativas para a alta estabilidade sem invocar uma estrutura não clássica.
Em 1951, foi sugerido pela primeira vez que o cátion 2-norbornil poderia realmente ser melhor descrito quando visto como um íon nortriciclônio. Foi demonstrado que o principal produto formado a partir de uma reação de eliminação do cátion 2-norbornil é o nortricicleno (não o norborneno), mas tem sido reivindicado que suporta ambos os postulados de íons não clássicos.
Herbert C. Brown: uma visão divergente
Herbert C. Brown não acreditava que fosse necessário invocar um novo tipo de ligação em intermediários estáveis para explicar a interessante reatividade do cátion 2-norbornila. Criticando muitos químicos por desconsiderar as explicações anteriores de reatividade, Brown argumentou que todas as informações acima mencionadas sobre o cátion 2-norbornil poderiam ser explicadas usando efeitos estéricos simples presentes no sistema norbornil. Dado que uma explicação alternativa usando um par de íons de equilíbrio rápido para descrever o cátion 2-norbornila era válida, ele não viu necessidade de invocar uma representação estável e não clássica de ligação. Invocar íons não clássicos estáveis estava se tornando comum; Brown sentiu que isso não era apenas injustificado, mas também contraproducente para o campo da química como um todo. De fato, muitos artigos relatando íons não clássicos estáveis foram posteriormente retratados por serem irrealistas ou incorretos. Depois de publicar esta visão controversa em 1962, Brown começou uma busca para encontrar evidências experimentais incompatíveis com a imagem deslocalizada de ligação no cátion 2-norbornil.
Brown também trabalhou para provar a instabilidade de uma estrutura eletrônica deslocalizada para o cátion 2-norbornila. Se o íon não clássico pudesse ser provado como tendo uma energia mais alta do que o par de íons clássico correspondente, o íon não clássico seria visto apenas como um estado de transição entre os dois cátions assimétricos. Embora ele não tenha descartado a possibilidade de um estado de transição deslocalizado, Brown continuou a rejeitar a simetria reflexiva proposta do cátion 2-norbornila, mesmo no final de sua carreira.
Impacto
A introdução da ligação deslocalizada de dois elétrons de três centros invocada na imagem não clássica do cátion 2-norbornila permitiu que os químicos explorassem todo um novo reino de ligações químicas. Os químicos estavam ansiosos para aplicar as características dos estados eletrônicos hipovalentes a sistemas novos e antigos (embora muitos tenham se empolgado demais). Um dos conceitos mais fundamentalmente importantes que emergiram da intensa pesquisa focada em íons não clássicos foi a ideia de que elétrons já envolvidos em ligações sigma poderiam estar envolvidos com reatividade. Embora os orbitais pi preenchidos fossem conhecidos como doadores de elétrons , os químicos duvidavam que os orbitais sigma pudessem funcionar com a mesma capacidade. A descrição não clássica do cátion 2-norbornil pode ser vista como a doação de um par de elétrons de uma ligação sigma carbono-carbono em um orbital p vazio de carbono 2. Assim, este carbocátion mostrou que a doação de elétrons por ligação sigma é tão plausível como a doação de elétrons por ligação pi.
O intenso debate que se seguiu ao desafio de Brown aos proponentes de íons não clássicos também teve um grande impacto no campo da química. Para provar ou refutar a natureza não clássica do cátion 2-norbornila, os químicos de ambos os lados do debate buscaram zelosamente novas técnicas de caracterização química e interpretações mais inovadoras dos dados existentes. Uma técnica espectroscópica que foi desenvolvida para investigar o cátion 2-norbornil foi a espectroscopia de ressonância magnética nuclear de compostos em meio altamente ácido. Comparações do cátion 2-norbornil para estados de transição instáveis com estados eletrônicos deslocalizados foram feitas frequentemente ao tentar elucidar se o sistema norbornil era estável ou não. Esses esforços motivaram investigações mais aprofundadas dos estados de transição e aumentaram amplamente a compreensão da comunidade científica sobre sua estrutura eletrônica. Em suma, a competição vigorosa entre grupos científicos levou a uma extensa pesquisa e a uma melhor compreensão dos conceitos químicos subjacentes.
Formação
O cátion 2-norbornila pode ser produzido por uma infinidade de rotas sintéticas. Essas rotas podem ser agrupadas em três classes diferentes: σ Formação , π Formação e Formação por rearranjo . Cada um deles é discutido separadamente abaixo.

formação σ
O material de partida para esta rota é um derivado de norbornano com um bom grupo de saída na posição 2. Se o grupo de saída estiver na exoface , a densidade de elétrons da ligação σ entre os carbonos 1 e 6 é doada para o σ * antibond entre o carbono 2 e o grupo de saída ( consulte a Figura 8b ).
Se o grupo de saída estiver na endoface , o grupo de saída sairá sozinho primeiro. Em seguida, a densidade de elétrons da ligação σ entre os carbonos 1 e 6 é doada para o orbital atômico vazio resultante no carbono 2. No entanto, esta rota de formação é muito mais lenta do que a do exo -isômero porque a ligação σ não pode fornecer assistência ancimérica para o primeiro etapa, tornando a energia de ativação para o primeiro estado de transição muito mais elevada. Além disso, se houver uma alta concentração de eletrófilos reativos na mistura de reação, a formação de um derivado de norbornano recentemente substituído pode impedir a formação de íons não clássicos.
Um exemplo dessa rota de formação é a reação que levou Winstein e Trifan a propor a estrutura deslocalizada do cátion 2-norbornila. Os tosilatos e brosilatos de 2-norbornil formam o cátion 2-norbornil por esta via como um intermediário para a solvólise .
formação π
O material de partida para esta via é um derivado β- (Δ 3 -ciclopentenil) -etano com um bom grupo de saída no carbono terminal do grupo etano. A densidade de elétrons da ligação π da porção alceno é doada para a anti-ligação σ * entre o carbono terminal e o grupo de saída ( ver Figura 8c ).
Por exemplo, o principal produto da acetólise do β- (Δ 3 -ciclopentenil) -etil nosilato ( p- nitrobenzenossulfonato) é o 2- exo- norbornil acetato. A escassez de β- (Δ 3 -ciclopentenil) -etilacetato presente após a reação é explicada pela maior estabilidade do sistema norbornil sobre o sistema ciclopentenil decorado.
Esta rota só é eficaz se a ciclopentenil olefina for isolada de qualquer sistema maior ligado em π. A taxa de reação diminui significativamente se a ligação dupla envolvida formar um anel aromático de seis membros, como acontece no nosilato de 2-indaniletil. As substituições de alquil nas olefinas aumentam a taxa de reação ao estabilizar o carbocátion resultante.
Formação a partir do rearranjo de cátions 1-norbornil e 7-norbornil
O cátion 2-norbornil também pode ser formado por meio de rearranjos de íons semelhantes, como os cátions 1-norbornil e 7-norbornil, embora estes geralmente não sejam tão bem compreendidos. Carbono-14 radioactivas experiências de marcação isotópica mostraram que o complexo de encriptao em sistemas de catiões norbornilo permitir 14 C a estar presentes em todos os sete posições do sistema de norbornilo. Ciclando entre as temperaturas baixas e altas durante as hidrólises de 1- e 7-cloronorbornanos, uma grande quantidade de 2-norbornanol foi observada além dos esperados 1- e 7-norbornanóis, respectivamente. Assim, os cátions 1- e 7-norbornil têm algum mecanismo pelo qual eles podem se rearranjar para o cátion 2-norbornil mais estável na escala de tempo das reações de solvólise.
Geometria
Evidência espectroscópica
Uma sonda para testar se o cátion 2-norbornila é ou não não clássico está investigando a simetria inerente do cátion. Muitas ferramentas espectroscópicas, como a espectroscopia de ressonância magnética nuclear ( espectroscopia de NMR) e a espectroscopia Raman , dão dicas sobre a simetria refletiva e rotacional presente em uma molécula ou íon. Cada uma das três estruturas propostas do cátion 2-norbornila ilustra uma simetria molecular diferente. A forma não clássica contém um plano de reflexão através dos carbonos 4, 5, 6 e o ponto médio dos carbonos 1 e 2. A forma clássica não contém simetria refletiva nem rotacional. A estrutura de nortricicleno protonado contém um eixo de rotação simétrico C 3 através do carbono 4.
Cada pico em um espectro de NMR corresponde a um conjunto de átomos de um elemento específico que estão em ambientes químicos semelhantes. O espectro de NMR do sal de cloropentafluoreto de antimônio do cátion 2-norbornil não é útil à temperatura ambiente porque os desvios de hidreto ocorrem mais rápido do que a escala de tempo de um experimento de NMR; a maioria dos hidrogênios são, portanto, vistos como equivalentes e contabilizados no mesmo pico de absorção. Baixando a temperatura do experimento de NMR para −60 ° C, os desvios de hidreto são "congelados" e mais informações estruturais podem ser obtidas a partir do espectro. Os pesquisadores descobriram que, nessas baixas temperaturas, o espectro de 1 H NMR correspondia ao que seria esperado para a estrutura não clássica do íon.
Os estudos de RMN de 1 H e 13 C foram capazes de confirmar que quaisquer rearranjos de Wagner-Meerwein propostos ocorreram mais rápido do que a escala de tempo do experimento de RMN, mesmo em baixas temperaturas. Para moléculas em equilíbrio estático com relação a rearranjos, NMR revela quantos conjuntos de núcleos relacionados à simetria estão na molécula e quantos núcleos cada um desses conjuntos representa via integração de espectro. Para moléculas em equilíbrio dinâmico, como o cátion 2-norbornila, os núcleos dentro de cada conjunto também podem ser transformados uns nos outros por meio de rearranjos com taxas de reação rápidas. Uma vez que o equilíbrio dinâmico proposto dos proponentes de íons clássicos tinha taxas muito rápidas de rearranjo, os primeiros estudos de RMN não favoreciam nem invalidavam nenhuma das três estruturas propostas. Mas, usando a análise de NMR de estado sólido , pode-se diminuir a temperatura do experimento de NMR para 5 kelvins (−268 ° C) e, assim, diminuir significativamente qualquer fenômeno de rearranjo. De estado sólido 13 C Os espectros de RMN mostra de catiões 2-norbornilo que os carbonos 1 e 2 estão em ambientes químicos idênticos, o que é consistente com a única imagem não clássica do catião 2-norbornilo.
Os espectros Raman do cátion 2-norbornil mostram uma espécie mais simétrica do que seria esperado para um par de íons clássicos rapidamente equilibrados. Uma vez que as taxas de reação propostas para os rearranjos de íons clássicos são mais lentas do que a escala de tempo Raman, seria de se esperar que os espectros Raman indicassem uma espécie menos simétrica se a imagem clássica estivesse correta.
Alguns estudos sobre o 13 C RMN em particular interpretação favorecida através da estrutura nortricyclene protonado. Além disso, os espectros Raman do cátion 2-norbornil em alguns solventes ácidos mostram uma banda de absorção em 3110 cm -1 indicativa de um anel de ciclopropano esgotado de elétrons. Uma vez que essa banda de absorção seria esperada no nortricicleno protonado simétrico C 3 , alguns cientistas afirmaram que isso é uma evidência convincente para esta interpretação. Outros químicos postularam que as propriedades do cátion 2-norbornil são muito dependentes do ambiente do solvente. Embora a alta acidez e a baixa nucleofilicidade dos solventes usados nos experimentos acima mencionados possam fazer com que a geometria do nortricilcônio protonado seja a mais estável, essa geometria não precisa ser a mais energeticamente favorável em outros solventes.
Cálculos
Muitos estudos de cálculo têm sido usados para comparar a viabilidade de diferentes geometrias propostas. Usando o método semi-empírico quântico do MINDO / 3 , os pesquisadores não foram capazes de concluir qual geometria do cátion 2-norbornila era energeticamente mais favorável. No entanto, verificou-se que a estrutura clássica é o único potencial mínimo para o cátion 2-metil-2-norbornil substituído com alquil. Cálculos adicionais usando a Teoria de Hückel Estendida para Orbitais Moleculares foram encontrados para favorecer a geometria não clássica do cátion com simetria refletiva.
Termodinâmica
Alguns estudos usaram comparações interessantes a fim de sondar a estabilidade energética do cátion 2-norbornila fornecido por sua natureza deslocalizada. Comparando o rearranjo entre o cátion 3-metil-2-norbornil e o cátion 2-metil-2-norbornil àquele entre os carbocations isopentano terciário e secundário , descobre-se que a mudança na entalpia é cerca de 6 kcal / mol menos para o norbornil sistema. Uma vez que a principal diferença entre esses dois rearranjos reversíveis é a quantidade de deslocalização possível no estado fundamental eletrônico, pode-se atribuir a estabilização do cátion 3-metil-2-norbornila à sua natureza não clássica. No entanto, alguns estudos experimentais falharam em observar esta estabilização nas reações de solvólise.
Outros estudos sobre a estabilidade do cátion 2-norbornil mostraram que as substituições de alquil no carbono 1 ou 2 forçam o sistema a ser decididamente clássico. Os carbocations terciários são muito mais estáveis do que seus correspondentes secundários e, portanto, não precisam adotar ligações deslocalizadas para atingir a energia potencial mais baixa possível.
Cinética
Para apoiar sua sugestão da natureza não clássica do cátion 2-norbornil, Winstein e Trifan primeiro usaram a evidência cinética da taxa de reação aumentada para a formação do cátion 2- exo- norbornil sobre o cátion 2- endo- norbornil. Outros pesquisadores investigaram a taxa de reação de compostos que poderiam apresentar assistência ancimérica, mas não poderiam sofrer rearranjos, pois o sistema norbornil poderia mostrar tendências semelhantes no aumento da taxa. Alguns afirmam que isso é uma evidência definitiva do quadro não clássico. Mas nem todos concordam. Outros pesquisadores descobriram que os derivados do ciclopentano que eram estruturalmente semelhantes ao sistema norbornil ainda apresentavam taxas de reação aumentadas, levando-os a afirmar que o cátion norbornil clássico descreve o sistema muito melhor.
Experimentos de marcação de isótopos
Experimentos de marcação de isótopos radioativos fornecem uma ferramenta poderosa para determinar a estrutura de moléculas orgânicas. Ao decompor sistematicamente o cátion 2-norbornila e analisar a quantidade de isótopo radioativo em cada produto de decomposição, os pesquisadores foram capazes de mostrar mais evidências para a imagem não clássica de ligação deslocalizada ( ver Figura 9 ). Os proponentes da imagem não clássica esperariam que 50% do CO 2 gerado na decomposição na Figura 9 contivesse 14 C, enquanto os proponentes da imagem clássica esperariam que mais do CO 2 gerado fosse radioativo devido à natureza de curta duração de o cátion. Observou-se que 40% do dióxido de carbono produzido por decomposição era radioativo, sugerindo que a imagem não clássica é mais correta.
Outra distinção entre estruturas não clássicas e clássicas do cátion 2-norbornil é possível combinando experimentos de NMR com experimentos de marcação de isótopos. A substituição isotópica de um de dois átomos de deutério por um átomo de hidrogênio faz com que o ambiente dos átomos ativos de RMN próximos mude dramaticamente. A marcação assimétrica de isótopos de deutério (substituição) fará com que um conjunto de carbonos que eram todos equivalentes na espécie totalmente hidrogênio seja dividido em dois ou mais conjuntos de carbonos equivalentes nas espécies marcadas com deutero; isso se manifestará no espectro de NMR como um pico no espectro da espécie totalmente de hidrogênio tornando-se pelo menos dois picos "divididos" nas espécies marcadas com deutero. Se um sistema está passando por um equilíbrio rápido a uma taxa mais rápida do que a escala de tempo de um experimento de 13 C NMR, o pico relevante será dividido dramaticamente (na ordem de 10-100 ppm). Se o sistema for estático, o pico será dividido muito pouco. O espectro de 13 C NMR do cátion 2-norbornil a -150 ° C mostra que os picos correspondentes aos carbonos 1 e 2 são divididos em menos de 10 ppm (partes por milhão) quando este experimento é realizado, indicando que o sistema é não passando por um equilíbrio rápido como na imagem clássica.
Cristalografia de raio-x
Embora a caracterização de cristais de cátion 2-norbornil possa ter impedido significativamente mais debates sobre sua estrutura eletrônica, ele não cristaliza sob quaisquer condições padrão. Recentemente, a estrutura cristalina foi obtida e relatada por meios criativos: a adição de tribrometo de alumínio a brometo de 2-norbornila em dibromometano em baixas temperaturas proporcionou cristais de [ C
7H
11] + [ Al
2Br
7] - · CH
2Br
2. Ao examinar a estrutura de cristal resultante, os pesquisadores foram capazes de confirmar que a geometria cristalina melhor suporta o caso de ligação deslocalizada no cátion 2-norbornil estável. Comprimentos de ligação entre o carbono de "ponte" 6 e cada um dos carbonos 1 e 2 foram encontrados para ser ligeiramente mais longos do que ligações alcano típicas. De acordo com a imagem não clássica, seria de se esperar uma ordem de ligação entre 0 e 1 para essas ligações, significando que isso explica bem a estrutura cristalina. O comprimento da ligação entre os carbonos 1 e 2 foi relatado como estando entre os comprimentos típicos de ligação carbono-carbono simples e dupla, o que concorda com as previsões não clássicas de uma ordem de ligação ligeiramente acima de 1. De acordo com a imagem não clássica, seria de esperar uma ordem de ligação entre 0 e 1 para as duas primeiras ligações. Os investigadores que cristalizaram o cátion 2-norbornila comentaram que o cátion provou ser impossível de cristalizar a menos que fornecido um ambiente químico que o prendeu em uma orientação definida.