Reação de Suzuki - Suzuki reaction
| Reação de Suzuki | |
|---|---|
| Nomeado após | Akira Suzuki |
| Tipo de reação | Reação de acoplamento |
| Identificadores | |
| Portal de Química Orgânica | acoplamento Suzuki |
| ID de ontologia RSC | RXNO: 0000140 |
A reação de Suzuki é uma reação orgânica , classificada como uma reação de acoplamento cruzado , onde os parceiros de acoplamento são um ácido borônico e um organohalide e o catalisador é um complexo de paládio (0) . Foi publicado pela primeira vez em 1979 por Akira Suzuki , e ele compartilhou o Prêmio Nobel de Química de 2010 com Richard F. Heck e Ei-ichi Negishi por sua contribuição para a descoberta e desenvolvimento de acoplamentos cruzados catalisados por paládio em síntese orgânica. Esta reação também é conhecida como reação Suzuki – Miyaura ou simplesmente como acoplamento Suzuki . É amplamente utilizado para sintetizar poli olefinas , estirenos , e substituídos de bifenilos . Diversas análises foram publicadas descrevendo os avanços e o desenvolvimento da reação Suzuki. O esquema geral para a reação de Suzuki é mostrado abaixo, onde uma ligação simples carbono-carbono é formada pelo acoplamento de uma espécie de organoboro (R 1 -BY 2 ) com um haleto (R 2 -X) usando um catalisador de paládio e uma base .
-
( Eq.1 )
Mecanismo de reação
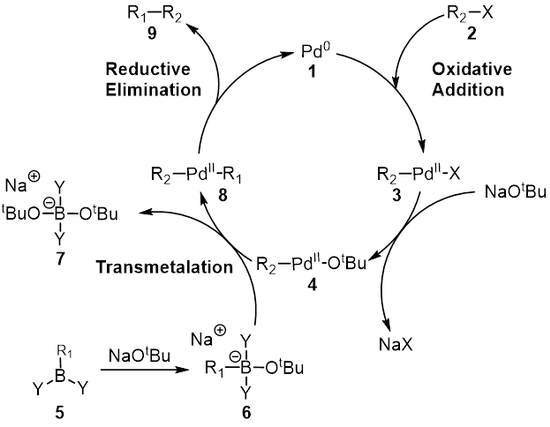
O mecanismo da reação de Suzuki é melhor visto da perspectiva do catalisador de paládio 1 . A primeira etapa é a adição oxidativa de paládio ao haleto 2 para formar a espécie de organopaládio 3 . A reação ( metátese ) com a base dá o intermediário 4 , que via transmetalação com o complexo de boro 6 (produzido pela reação do ácido borônico 5 com a base) forma a espécie de organopaládio 8 . A eliminação redutiva do produto desejado 9 restaura o catalisador de paládio original 1 que completa o ciclo catalítico . O acoplamento Suzuki ocorre na presença de uma base e por muito tempo o papel da base não foi totalmente compreendido. A base foi inicialmente considerada como formando um borato de trialquil (R 3 B-OR), no caso de uma reação de um trialquilborano (BR 3 ) e alcóxido ( - OR); esta espécie poderia ser considerada mais nucleofílica e então mais reativa ao complexo de paládio presente na etapa de transmetalação. Duc e colegas investigaram o papel da base no mecanismo de reação para o acoplamento de Suzuki e descobriram que a base tem três papéis: Formação do complexo de paládio [ArPd (OR) L 2 ], formação do borato de trialquila e aceleração de a etapa de eliminação redutiva por reação do alcóxido com o complexo de paládio.
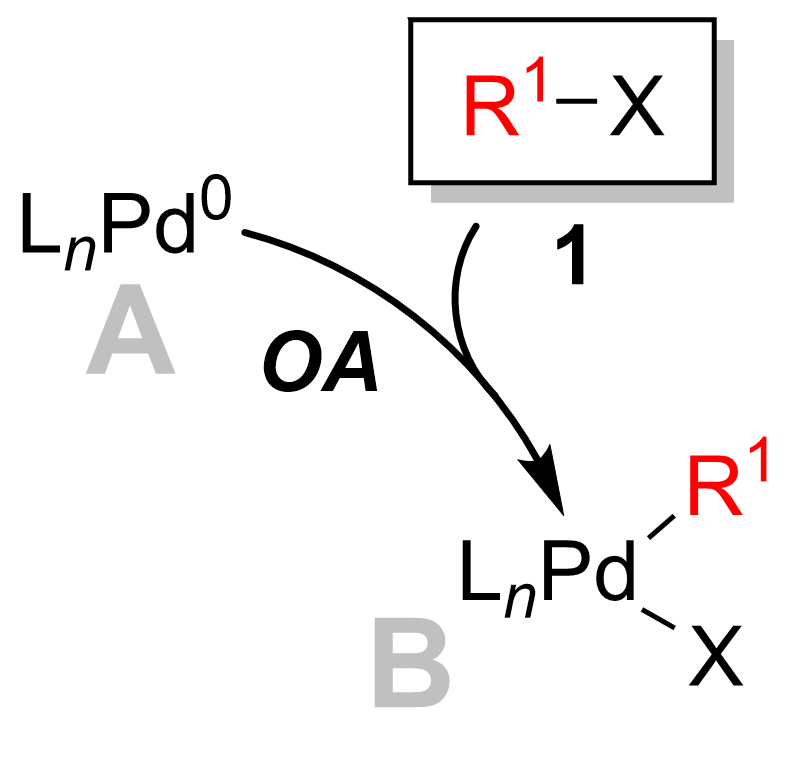
Adição oxidativa
Na maioria dos casos, a adição oxidativa é a etapa de determinação da taxa do ciclo catalítico. Durante esta etapa, o catalisador de paládio é oxidado de paládio (0) em paládio (II). O catalisador de paládio 1 é acoplado ao haleto de alquila 2 para produzir um complexo de organopaládio 3 . Como visto no diagrama abaixo, a etapa de adição oxidativa quebra a ligação carbono - halogênio onde o paládio está agora ligado ao halogênio e ao grupo R.
A adição oxidativa prossegue com a retenção da estereoquímica com haletos de vinila , enquanto dá inversão da estereoquímica com haletos alílicos e benzílicos . A adição oxidativa inicialmente forma o complexo cis- paládio, que rapidamente se isomeriza para o complexo trans.
O acoplamento Suzuki ocorre com retenção da configuração nas ligações duplas para o reagente organoboro ou haleto. No entanto, a configuração dessa ligação dupla, cis ou trans, é determinada pela isomerização cis-para-trans do complexo de paládio na etapa de adição oxidativa em que o complexo de trans-paládio é a forma predominante. Quando o organoboro está ligado a uma ligação dupla e é acoplado a um halogeneto de alquenila, o produto é um dieno como mostrado abaixo.
Transmetalação
A transmetalação é uma reação organometálica onde os ligantes são transferidos de uma espécie para outra. No caso do acoplamento de Suzuki, os ligantes são transferidos da espécie organoboro 6 para o complexo de paládio (II) 4, onde a base que foi adicionada na etapa anterior é trocada pelo substituinte R 1 na espécie organoboro para dar o novo paládio (II) complexo 8 . O mecanismo exato de transmetalação para o acoplamento Suzuki ainda precisa ser descoberto. Os compostos de organoboro não sofrem de transmetalação, na ausência de uma base e é, portanto, acredita-se que o papel de base é para activar o composto orgânico de boro, assim como facilitar a formação de R 2 -Pd ll -O t Bu a partir de R 2 - Pd ll -X.
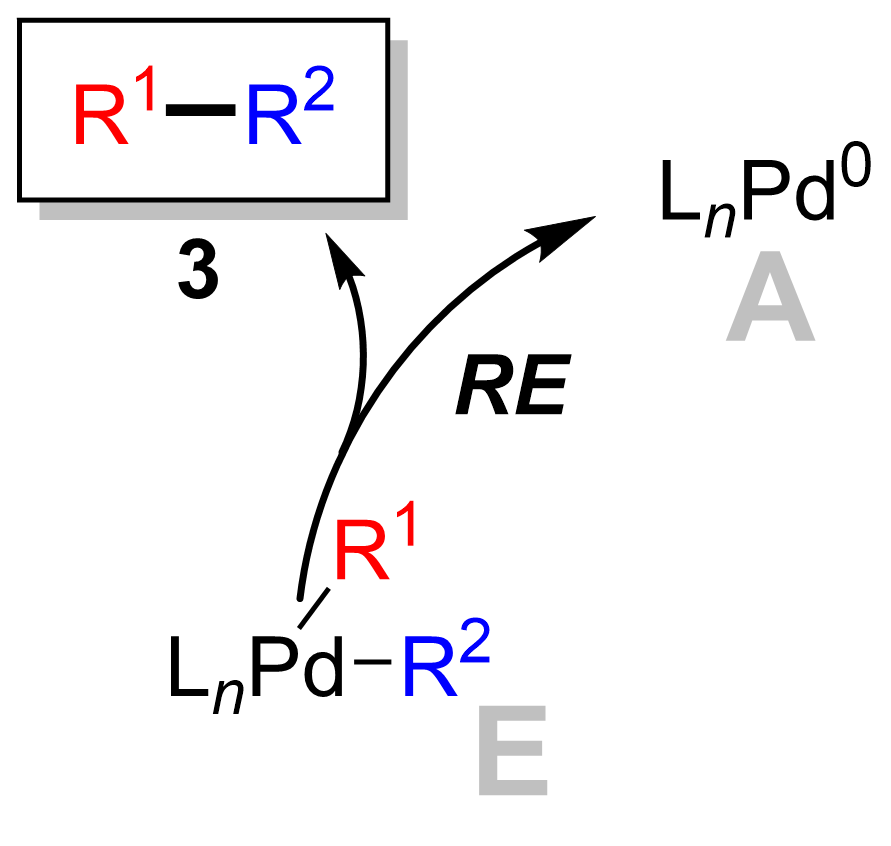
Eliminação redutiva
A etapa final é a etapa de eliminação redutiva onde o complexo de paládio (II) ( 8 ) elimina o produto ( 9 ) e regenera o catalisador de paládio (0) ( 1 ). Usando a marcação de deutério , Ridgway et al. mostraram que a eliminação redutiva ocorre com a retenção da estereoquímica.
O ligante desempenha um papel importante na reação de Suzuki. Normalmente, o ligante fosfina é usado na reação de Suzuki. O ligante de fosfina aumenta a densidade de elétrons no centro metálico do complexo e, portanto, auxilia na etapa de adição oxidativa. Além disso, o volume de substituição do ligante de fosfina ajuda na etapa de eliminação redutiva. No entanto, o ligante N-heterocíclico de carbenos foi recentemente utilizado neste acoplamento cruzado, devido à instabilidade do ligante fosfina nas condições de reação de Suzuki. Os carbenos N-heterocíclicos são mais ricos em elétrons e mais volumosos do que o ligante fosfina. Portanto, ambos os fatores estéricos e eletrônicos do ligante carbeno N-heterocíclico ajudam a estabilizar o catalisador Pd (0) ativo.
Vantagens
As vantagens do acoplamento Suzuki sobre outras reações semelhantes incluem a disponibilidade de ácidos borônicos comuns, condições de reação moderadas e sua natureza menos tóxica. Os ácidos borônicos são menos tóxicos e mais seguros para o meio ambiente do que os compostos organo - estanho e organozinco . É fácil remover os subprodutos inorgânicos da mistura de reação. Além disso, esta reação é preferível porque usa reagentes relativamente baratos e facilmente preparados. Ser capaz de usar água como solvente torna essa reação mais econômica, ecológica e prática para uso com uma variedade de reagentes solúveis em água. Uma grande variedade de reagentes pode ser usado para o acoplamento de Suzuki, por exemplo, aril - ou vinil ácidos bor�ico e aril - ou vinil -halogenetos. O trabalho também ampliou o escopo da reação para incorporar brometos de alquila. Além de muitos tipos diferentes de halogenetos serem possíveis para a reação de acoplamento de Suzuki, a reação também funciona com pseudo - halogenetos como triflatos (OTf), como substitutos para halogenetos . A reatividade relativa do parceiro de acoplamento com o haleto ou pseudo-haleto é: R 2 –I> R 2 –OTf> R 2 –Br >> R 2 –Cl. Ésteres borônicos e sais organotrifluoroborato podem ser usados em vez de ácidos borônicos. O catalisador também pode ser um catalisador à base de nanomaterial de paládio . Com um novo ligante de organofosfina ( SPhos ), uma carga de catalisador de até 0,001 mol% foi relatada :. Esses avanços e a flexibilidade geral do processo tornaram o acoplamento Suzuki amplamente aceito para síntese química.
Formulários
Aplicações industriais
A reação de acoplamento Suzuki é escalonável e econômica para uso na síntese de intermediários para produtos farmacêuticos ou produtos químicos finos . A reação de Suzuki já foi limitada por altos níveis de catalisador e pela disponibilidade limitada de ácidos borônicos . Substituições para haletos também foram encontradas, aumentando o número de parceiros de acoplamento para haletos ou pseudo-haletos. Reações em escala foram realizadas na síntese de uma série de compostos biológicos importantes, como CI-1034, que usou um triflato e parceiros de acoplamento de ácido borônico que foi executado em uma escala de 80 quilogramas com um rendimento de 95%.
Outro exemplo é o acoplamento de 3-piridilborano e 1-bromo-3- (metilsulfonil) benzeno que formou um intermediário que foi usado na síntese de um potencial agente do sistema nervoso central. A reação de acoplamento para formar o intermediário produziu (278 quilogramas) com um rendimento de 92,5%.
Esforços significativos foram colocados no desenvolvimento de catalisadores heterogêneos para a reação de Suzuki CC, motivados pelos ganhos de desempenho no processo industrial (eliminando a separação do catalisador do substrato), e recentemente um catalisador heterogêneo de átomo único de Pd demonstrou superar o Catalisador Pd (PPh 3 ) 4 homogêneo padrão da indústria .
Aplicações sintéticas
O acoplamento Suzuki tem sido freqüentemente usado em sínteses de compostos complexos. O acoplamento Suzuki tem sido usado em um derivado citronelal para a síntese de caparratriene , um produto natural que é altamente ativo contra a leucemia:
Variações
Catalisador de metal
Vários usos catalíticos de metais diferentes do paládio (especialmente níquel) foram desenvolvidos. A primeira reação de acoplamento cruzado catalisada por níquel foi relatada por Percec e colaboradores em 1995 usando mesilatos de arila e ácidos borônicos. Embora uma quantidade maior de catalisador de níquel fosse necessária para a reação, em torno de 5% molar, o níquel não é um metal tão caro ou precioso quanto o paládio . A reação de acoplamento de Suzuki catalisada por níquel também permitiu uma série de compostos que não funcionaram ou funcionaram pior para o sistema catalisado por paládio do que para o sistema catalisado por níquel. O uso de catalisadores de níquel permitiu que eletrófilos se mostrassem desafiadores para o acoplamento Suzuki original usando paládio, incluindo substratos como fenóis, éteres arílicos, ésteres, fosfatos e fluoretos.
A investigação sobre o acoplamento cruzado catalisado por níquel continuou e aumentou o escopo da reação depois que esses primeiros exemplos foram mostrados e o interesse da pesquisa cresceu. Miyaura e Inada relataram em 2000 que um catalisador de níquel mais barato poderia ser utilizado para o acoplamento cruzado , usando trifenilfosfina (PPh 3 ) em vez dos ligantes mais caros usados anteriormente. No entanto, o acoplamento cruzado catalisado por níquel ainda exigia altas cargas de catalisador (3-10%), ligava em excesso (1-5 equivalentes) e permanecia sensível ao ar e à umidade. Os avanços de Han e colegas de trabalho tentaram resolver esse problema desenvolvendo um método usando baixas quantidades de catalisador de níquel (<1 mol%) e nenhum equivalente adicional de ligante.
Também foi relatado por Wu e colaboradores em 2011 que um catalisador de níquel altamente ativo para o acoplamento cruzado de cloretos de arila poderia ser usado, exigindo apenas 0,01-0,1 mol% de catalisador de níquel. Eles também mostraram que o catalisador pode ser reciclado até seis vezes sem praticamente nenhuma perda na atividade catalítica. O catalisador era reciclável porque era um catalisador de nanopartícula de fosfina níquel (G 3 DenP-Ni) feito de dendrímeros .
Vantagens e desvantagens se aplicam às reações de acoplamento de Suzuki catalisadas por paládio e níquel. Além do sistema de catalisador de Pd e Ni, fontes de metal baratas e não tóxicas, como ferro e cobre, têm sido usadas na reação de acoplamento de Suzuki. O grupo de pesquisa de Bedford e o grupo de pesquisa Nakamura trabalharam extensivamente no desenvolvimento da metodologia da reação de acoplamento Suzuki catalisada por ferro. O rutênio é outra fonte de metal que tem sido usada na reação de acoplamento da Suzuki.
Acoplamento de amida
A catálise de níquel pode construir ligações CC a partir de amidas. Apesar da natureza inerentemente inerte das amidas como sintons, a seguinte metodologia pode ser usada para preparar ligações CC. O procedimento de acoplamento é leve e tolerante a uma miríade de grupos funcionais, incluindo: aminas, cetonas, heterociclos, grupos com prótons ácidos. Essa técnica também pode ser usada para preparar moléculas bioativas e unir heterociclos de maneiras controladas por meio de acoplamentos cruzados sequenciais astutos. Uma revisão geral do esquema de reação é fornecida abaixo.
A síntese do composto ligante da tubulina ( agente antiproliferativo ) foi realizada utilizando trimetoxiamida e um fragmento heterocíclico.
Organoboranos
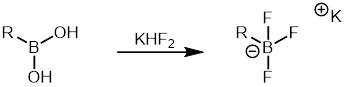
Os ácidos aril borônicos são comparativamente mais baratos do que outros organoboranos e uma grande variedade de ácidos aril borônicos estão disponíveis comercialmente. Portanto, tem sido amplamente utilizado na reação de Suzuki como parceiro organoborano. Os sais de ariltrifluoroborato são outra classe de organoboranos frequentemente usados porque são menos propensos à protodeboronação em comparação com os ácidos aril borônicos . Eles são fáceis de sintetizar e podem ser facilmente purificados. Os sais de ariltrifluoroborato podem ser formados a partir de ácidos borônicos pelo tratamento com fluoreto de hidrogênio de potássio que pode então ser usado na reação de acoplamento de Suzuki.
Variações de solvente
A reação de acoplamento Suzuki é diferente de outras reações de acoplamento porque pode ser executada em água orgânica bifásica, somente água ou sem solvente. Isso aumentou o escopo das reações de acoplamento, já que uma variedade de bases solúveis em água, sistemas de catalisador e reagentes podiam ser usados sem preocupação com sua solubilidade em solvente orgânico. O uso de água como sistema solvente também é atraente devido às vantagens econômicas e de segurança. Freqüentemente usados em sistemas de solvente para acoplamento Suzuki são tolueno , THF , dioxano e DMF . As bases mais frequentemente usadas são K 2 CO 3 , KO t Bu , Cs 2 CO 3 , K 3 PO 4 , NaOH e NEt 3 .
Veja também
- Acoplamento Chan-Lam
- Reação diabólica
- Acoplamento Hiyama
- Acoplamento Kumada
- Acoplamento negishi
- Reação de Petasis
- Acoplamento sonogashira
- Reação de Stille
- Lista de reações orgânicas

![{\ displaystyle {\ ce {{\ overset {organoboro \ espécies} {R1-BY2}} + {\ overset {haleto} {R2-X}} -> [{} \ atop {{\ text {Pd}} \ sobre o {\ text {catalyst}}}] [{\ text {Base}}] R1-R2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c43b40292dc12a954f37f136ec4bfb39d595c3e1)