Ácido borônico - Boronic acid

Um ácido borônico é um composto relacionado ao ácido bórico no qual um dos três grupos hidroxila é substituído por um grupo alquila ou arila . Como um composto contendo uma ligação carbono-boro , os membros desta classe pertencem à classe maior dos organoboranos . Os ácidos borônicos atuam como ácidos de Lewis . A sua característica única é que eles são capazes de formar complexos covalentes reverseis com açúcares , amino ácidos , ácidos hidroxâmicos , etc. (moléculas com vicinal , (1,2) ou, ocasionalmente, (1,3) doadores de base de Lewis substituídos ( álcool , amina , carboxilato)). O p K a de um ácido borônico é ~ 9, mas eles podem formar complexos tetraédricos de boronato com p K a ~ 7. Eles são ocasionalmente usados na área de reconhecimento molecular para se ligar a sacarídeos para detecção fluorescente ou transporte seletivo de sacarídeos através das membranas.
Os ácidos borônicos são usados extensivamente na química orgânica como blocos de construção químicos e intermediários, predominantemente no acoplamento Suzuki . Um conceito chave em sua química é a transmetalação de seu resíduo orgânico em um metal de transição.
O composto bortezomibe com um grupo de ácido borônico é um medicamento usado em quimioterapia . O átomo de boro nesta molécula é uma subestrutura fundamental porque, por meio dele, certos proteassomas são bloqueados, o que de outra forma degradaria as proteínas. Os ácidos borônicos são conhecidos por se ligarem às serinas do sítio ativo e fazem parte dos inibidores da lipase pancreática suína , da subtilisina e da protease Kex2 . Além disso, os derivados de ácido borônico constituem uma classe de inibidores para a acilproteína tioesterase humana 1 e 2, que são alvos de drogas contra o câncer dentro do ciclo de Ras .
O grupo funcional do ácido borônico tem a reputação de ter baixa toxicidade inerente. Esta é uma das razões da popularidade do acoplamento Suzuki no desenvolvimento e síntese de agentes farmacêuticos. No entanto, descobriu-se recentemente que uma fração significativa dos ácidos borônicos comumente usados e seus derivados dão um teste de Ames positivo e agem como mutagênicos químicos . Acredita-se que o mecanismo de mutagenicidade envolva a geração de radicais orgânicos por meio da oxidação do ácido borônico pelo oxigênio atmosférico.
Estrutura e síntese
Em 1860, Edward Frankland foi o primeiro a relatar a preparação e o isolamento de um ácido borônico. O ácido etilborônico foi sintetizado por um processo de duas etapas. Primeiro, dietilzinco e trietilborato reagiram para produzir trietilborano . Este composto então oxidado no ar para formar ácido etilborônico. Várias rotas sintéticas estão agora em uso comum, e muitos ácidos borônicos estáveis ao ar estão disponíveis comercialmente.
Os ácidos borônicos normalmente têm altos pontos de fusão. Eles são propensos a formar anidridos pela perda de moléculas de água, normalmente para dar trímeros cíclicos .
| Ácido borônico | R | Estrutura | Massa molar | Número CAS | Ponto de fusão ° C |
|---|---|---|---|---|---|
| Ácido fenilborônico | Fenil |  |
121,93 | 98-80-6 | 216-219 |
| Ácido 2-tienilborônico | Thiophen |  |
127,96 | 6165-68-0 | 138-140 |
| Ácido metilborônico | Metilo |  |
59,86 | 13061-96-6 | 91-94 |
| ácido cis- propenilborônico | propeno | 85,90 | 7547-96-8 | 65-70 | |
| ácido trans- propenilborônico | propeno |  |
85,90 | 7547-97-9 | 123-127 |
Síntese
Os ácidos borônicos podem ser obtidos por meio de vários métodos. A forma mais comum é a reação de compostos organometálicos à base de lítio ou magnésio ( Grignards ) com ésteres de borato . Por exemplo, o ácido fenilborônico é produzido a partir de brometo de fenilmagnésio e borato de trimetila seguido por hidrólise
- PhMgBr + B (OMe) 3 → PhB (OMe) 2 + MeOMgBr
- PhB (OMe) 2 + H 2 O → PhB (OH) 2 + MeOH
Outro método é a reação de um arilsilano (RSiR 3 ) com tribrometo de boro (BBr 3 ) em uma transmetalação para RBBr 2 seguida por hidrólise ácida.
Um terceiro método é por reação catalisada por paládio de haletos e triflatos de arila com ésteres de diboronila em uma reação de acoplamento conhecida como reação de borilação de Miyaura . Uma alternativa aos ésteres neste método é o uso de ácido diborônico ou tetrahidroxidiboro ([B (OH 2 )] 2 ).
Ésteres borônicos (também chamados de ésteres borônicos)
Os ésteres borônicos são ésteres formados entre um ácido borônico e um álcool.
| Composto | Fórmula geral | Estrutura geral |
|---|---|---|
| Ácido borônico | RB (OH) 2 |
 |
| Éster borônico | RB (OR) 2 |
 |
Os compostos podem ser obtidos a partir de ésteres de borato por condensação com álcoois e dióis . O ácido fenilborônico pode ser autocondensado no trímero cíclico denominado anidrido trifenil ou trifenilboroxina.
| Éster borônico | Diol | Fórmula estrutural | Massa molar | Número CAS | Ponto de ebulição (° C) |
|---|---|---|---|---|---|
| Éster de pinacol de ácido alilborônico | pinacol | 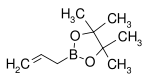 |
168,04 | 72824-04-5 | 50–53 (5 mmHg) |
| Éster de trimetilenoglicol de ácido fenil borônico | trimetilenoglicol |  |
161,99 | 4406-77-3 | 106 (2 mm Hg) |
| Diisopropoximetilborano | isopropanol |  |
144,02 | 86595-27-9 | 105 -107 |
Compostos com estruturas cíclicas de 5 membros contendo a ligação C – O – B – O – C são chamados de dioxaborolanos e aqueles com anéis de 6 membros são dioxaborinanos .
Aplicações de química orgânica
Reação de acoplamento Suzuki
Os ácidos borônicos são usados na química orgânica na reação de Suzuki . Nesta reação, o átomo de boro troca seu grupo arila por um grupo alcoxi de paládio.
-
( 1 )
Acoplamento Chan-Lam
No acoplamento Chan-Lam, o ácido alquil, alquenil ou aril borônico reage com um composto contendo N-H ou O-H com Cu (II), como acetato de cobre (II) e oxigênio e uma base como piridina, formando um novo carbono - ligação de nitrogênio ou ligação carbono-oxigênio, por exemplo, nesta reação de 2-piridona com ácido trans -1-hexenilborônico:
A sequência do mecanismo de reação é a desprotonação da amina, coordenação da amina para o cobre (II), transmetalação (transferência do grupo alquil boro para cobre e do grupo acetato de cobre para boro), oxidação de Cu (II) para Cu (III) por oxigênio e finalmente eliminação redutiva de Cu (III) em Cu (I) com a formação do produto. A eliminação redutiva direta de Cu (II) em Cu (0) também ocorre, mas é muito lenta. Em sistemas catalíticos, o oxigênio também regenera o catalisador Cu (II).
Acoplamento Liebeskind-Srogl
No acoplamento de Liebeskind-Srogl, um éster de tiol é acoplado a um ácido borônico para produzir uma cetona .
Adição de conjugado
O resíduo orgânico de ácido borônico é um nucleófilo em adição de conjugado também em conjunto com um metal. Em um estudo, o éster de pinacol de ácido alilborônico é reagido com dibenzilideno acetona em tal adição de conjugado:
- O sistema de catalisador nesta reação é tris (dibenzilidenoacetona) dipaládio (0) / triciclohexilfosfina .
Outra adição de conjugado é a de gramina com ácido fenilborônico catalisada por dímero de cloreto de ródio ciclo- octadieno :
Oxidação
Os ésteres borônicos são oxidados aos álcoois correspondentes com base e peróxido de hidrogênio (para ver um exemplo: carbenóide )
Homologação
- Na homologação de éster borônico, um grupo alquil muda de boro em um boronato para carbono:
Nesta reação, o diclorometil- lítio converte o éster borônico em um boronato. Um ácido de Lewis então induz um rearranjo do grupo alquil com deslocamento do grupo cloro. Finalmente, um reagente organometálico como um reagente de Grignard desloca o segundo átomo de cloro efetivamente levando à inserção de um grupo RCH 2 na ligação CB. Outra reação que caracteriza uma migração de alquil boronato é a reação de Petasis .
Mudanças alil eletrofílicas
Os ésteres alil borônicos se envolvem em mudanças alil eletrofílicas de maneira muito parecida com o pendente de silício na reação de Sakurai . Em um estudo, um reagente de dialilação combina os dois:
Hidrólise
A hidrólise de ésteres borônicos de volta ao ácido borônico e ao álcool pode ser realizada em certos sistemas com cloreto de tionila e piridina . Ácidos ou ésteres arilborônicos podem ser hidrolisados nos fenóis correspondentes por reação com hidroxilamina à temperatura ambiente.
Reações de acoplamento C – H
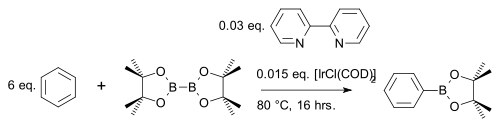
O composto de diboro bis (pinacolato) diboro reage com heterociclos aromáticos ou arenos simples a um éster de arilboronato com catalisador de irídio [IrCl (COD)] 2 (uma modificação do catalisador de Crabtree ) e base 4,4′-di-terc-butil-2 , 2′-bipiridina em uma reação de acoplamento de CH , por exemplo, com benzeno :
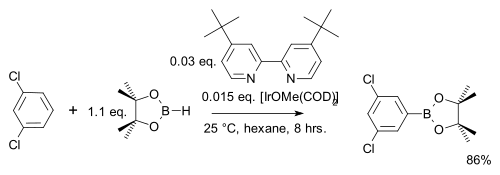
Em uma modificação, o areno reage usando apenas um equivalente estequiométrico em vez de um grande excesso usando o pinacolborano mais barato :
Ao contrário da substituição eletrofílica aromática comum (EAS), onde os efeitos eletrônicos dominam, a regiosseletividade neste tipo de reação é determinada exclusivamente pelo volume estérico do complexo de irídio. Isso é explorado em uma meta-brominação de m- xileno que, pelo AES padrão, daria o produto orto:
Protonólise
A protodeboronação é uma reação química envolvendo a protonólise de um ácido borônico (ou outro composto organoborano) em que uma ligação carbono-boro é quebrada e substituída por uma ligação carbono-hidrogênio. A protodeboronação é uma reação lateral indesejada bem conhecida e frequentemente associada a reações de acoplamento catalisadas por metal que utilizam ácidos borônicos (ver reação de Suzuki ). Para um determinado ácido borônico, a propensão a sofrer protodeboronação é altamente variável e dependente de vários fatores, como as condições de reação empregadas e o substituinte orgânico do ácido borônico:
Química supramolecular
Reconhecimento de sacarídeo
A interação covalente de pares entre ácidos borônicos e grupos hidroxila, como encontrada em álcoois e ácidos, é rápida e reversível em soluções aquosas . O equilíbrio estabelecido entre os ácidos borônicos e os grupos hidroxila presentes nos sacarídeos tem sido empregado com sucesso para desenvolver uma gama de sensores para sacarídeos. Uma das principais vantagens desta estratégia covalente dinâmica reside na capacidade dos ácidos borônicos de superar o desafio de se ligar a espécies neutras em meio aquoso. Se arranjado corretamente, a introdução de uma amina terciária dentro desses sistemas supramoleculares permitirá que a ligação ocorra em pH fisiológico e permitirá que mecanismos de sinalização, como a emissão de fluorescência mediada por transferência de elétrons fotoinduzida, relatem o evento de ligação.
As aplicações potenciais para esta pesquisa incluem sistemas de monitoramento de glicose no sangue para ajudar a controlar o diabetes mellitus . Como os sensores empregam uma resposta óptica, o monitoramento pode ser alcançado usando métodos minimamente invasivos, um exemplo é a investigação de uma lente de contato que contém uma molécula de sensor à base de ácido borônico para detectar os níveis de glicose nos fluidos oculares .

![A reação da Suzuki {\ displaystyle {\ begin {matrix} {} \\ {\ ce {{R1-BY2} + R2-X -> [{\ underset {\ text {catalyst}} {\ text {Pd}}}] [{ \ text {Base}}] R1-R2}} \\ {} \ end {matriz}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)