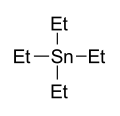Química organoestânica - Organotin chemistry
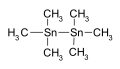
Os compostos organoestânicos ou estananos são compostos químicos à base de estanho com substituintes de hidrocarbonetos . A química organoestânica faz parte do campo mais amplo da química organometálica . O primeiro composto organoestânico foi o diiodeto de dietiltina ((C 2 H 5 ) 2 SnI 2 ), descoberto por Edward Frankland em 1849. A área cresceu rapidamente na década de 1900, especialmente após a descoberta dos reagentes de Grignard , úteis para a produção de Sn- Ligações C. A área continua rica, com muitas aplicações na indústria e atividades contínuas no laboratório de pesquisa.
Estrutura
Os compostos organoestânicos são geralmente classificados de acordo com seus estados de oxidação. Os compostos de estanho (IV) são muito mais comuns e úteis.
Derivados orgânicos de estanho (IV)
Os derivados de tetraorgano são invariavelmente tetraédricos. Os compostos do tipo SnRR'R''R '' 'foram resolvidos em enantiómeros individuais.
Halogenetos organoestânicos
Os cloretos organoestânicos têm a fórmula R 4− n SnCl n para valores de n até 3. Brometos, iodetos e fluoretos também são conhecidos, mas menos importantes. Esses compostos são conhecidos por muitos grupos R. Eles são sempre tetraédricos. Os tri e dihalides formam adutos com boas bases de Lewis, como a piridina . Os fluoretos tendem a se associar de modo que o difluoreto de dimetilestanho forme polímeros em forma de folha. Os halogenetos de di e especialmente triorganoestanho, por exemplo , cloreto de tributilestanho , exibem toxicidades próximas da do cianeto de hidrogênio .
Hidretos organoestânicos
Os hidretos organoestânicos têm a fórmula R 4− n SnH n para valores de n até 4. O membro pai desta série, o estanano (SnH 4 ), é um gás incolor instável. A estabilidade está correlacionada com o número de substituintes orgânicos. O hidreto de tributilestanho é usado como fonte de radical hidreto em algumas reações orgânicas.
Óxidos e hidróxidos organoestânicos
Óxidos e hidróxidos organoestânicos são produtos comuns da hidrólise de halogenetos organoestânicos. Ao contrário dos derivados correspondentes de silício e germânio, os óxidos e hidróxidos de estanho freqüentemente adotam estruturas com centros de estanho penta- e até hexacoordenados, especialmente para os derivados diorgano- e monoorgano. O grupo Sn-O-Sn é denominado estanoxano . Estruturalmente mais simples dos óxidos e hidróxidos são os derivados de triorganoestanho. Um hidróxido de triorganoestanho comercialmente importante é o acaricida Ciexatina (também denominado Plictran), ( C 6 H 11 ) 3 SnOH. Esses hidróxidos de triorganoestanho existem em equilíbrio com os distanoxanos:
- 2 R 3 SnOH ⇌ R 3 SnOSnR 3 + H 2 O
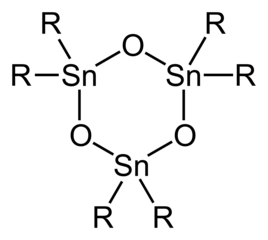
Com apenas dois substituintes orgânicos em cada centro de Sn, os óxidos e hidróxidos de diorganoestanho são estruturalmente mais complexos do que os derivados de triorgano. Os dióis geminais simples (R 2 Sn (OH) 2 ) e estananonas monoméricas (R 2 Sn = O) são desconhecidos. Os óxidos de diorganotina (R 2 SnO) são polímeros, exceto quando os substituintes orgânicos são muito volumosos, caso em que trímeros cíclicos ou, no caso de R = CH (SiMe 3 ) 2 dímeros, com anéis de Sn 3 O 3 e Sn 2 O 2 . Os distanoxanos existem como dímeros de dímeros com a fórmula [R 2 SnX] 2 O 2 em que os grupos X (por exemplo, cloreto, hidróxido, carboxilato) podem ser terminais ou em ponte (ver Tabela). A hidrólise dos trihaletos mono-organotínicos tem o potencial de gerar ácidos estananóicos, RSnO2H. Quanto aos óxidos / hidróxidos de diorgano-estanho, as espécies mono-orga-estanho formam-se estruturalmente complexas devido à ocorrência de desidratação / hidratação, agregação. Ilustrativo é a hidrólise de tricloreto de butilestanho para dar [(BuSn) 12 O 14 (OH) 6 ] 2+ .
Estananos hipercoordenados
Ao contrário dos análogos de carbono (IV), mas um pouco parecido com os compostos de silício, o estanho (IV) também pode ser coordenado em cinco e até seis átomos em vez dos quatro regulares. Esses compostos hipercoordenados geralmente têm substituintes eletronegativos . Numerosos exemplos de hipervalência são fornecidos pelos óxidos de organoestanho e carboxilatos associados e derivados de pseudo-halogenetos relacionados. Os halogenetos de organoestanho para adutos, por exemplo, Me 2 SnCl 2 ( bipiridina ).
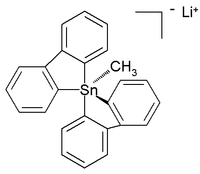
Os penta- e hexaorganostanatos totalmente orgânicos foram caracterizados, enquanto no ano subsequente um composto de tetraorganotina de seis coordenadas foi relatado. Uma estrutura cristalina de pentaorganostanano totalmente em carbono estável à temperatura ambiente (em argônio ) foi relatada como o sal de lítio com esta estrutura:
Nesta estrutura bipiramidal trigonal distorcida , os comprimentos das ligações de carbono para estanho (2,26 Å apical , 2,17 Å equatorial) são maiores do que ligações C-Sn regulares (2,14 Å) refletindo sua natureza hipervalente .
Cátions triorganoestânicos
Algumas reações de haletos de triorganotina implicam um papel para intermediários R3Sn +. Esses cátions são análogos aos carbocations . Eles foram caracterizados cristalograficamente quando os substituintes orgânicos são grandes, como 2,4,6-triisopropilfenil.
Radicais de estanho (derivados orgânicos de estanho (III))
Os radicais estanho, com a fórmula R 3 Sn, são denominados radicais estanilo . Eles são invocados como intermediários em certas reações de transferência de átomos. Por exemplo, o hidreto de tributilestanho (tri-n-butilestanano) serve como uma fonte útil de "átomos de hidrogênio" devido à estabilidade do radical tributitina.
Derivados orgânicos de estanho (II)
Os compostos organoestânicos (II) são um tanto raros. Os compostos com a fórmula empírica SnR 2 são um tanto frágeis e existem como anéis ou polímeros quando R não é volumoso. Os polímeros, chamados polistananos , têm a fórmula (SnR 2 ) n .
Em princípio, pode-se esperar que compostos divalentes de estanho formem análogos de alquenos com uma dupla ligação formal . De fato, os compostos com a fórmula Sn 2 R 4 , chamados distanenos , são conhecidos para certos substituintes orgânicos. Os centros Sn tendem a ser altamente piramidais. Os compostos monoméricos com a fórmula SnR 2 , análogos de carbenos, também são conhecidos em alguns casos. Um exemplo é Sn (SiR 3 ) 2 , onde R é o CH muito volumoso (SiMe 3 ) 2 (Me = metil). Essas espécies dimerizam reversivelmente em distanileno após a cristalização:
- 2 R 2 Sn ⇌ (R 2 Sn) 2
Estanenos , compostos com ligações duplas de estanho-carbono, são exemplificados por derivados de estanabenzeno . Os estanóis , análogos estruturais do ciclopentadieno , exibem pouco caráter de ligação dupla C-Sn.
Derivados orgânicos de estanho (I)
Os compostos de Sn (I) são raros e apenas observados com ligantes muito volumosos. Uma família proeminente de gaiolas é acessada por pirólise do tristanileno substituído com 2,6-dietilfenil [Sn (C 6 H 3 -2,6-Et 2 ) 2 ] 3 , que fornece o aglomerado do tipo cubano e um prismane . Essas gaiolas contêm Sn (I) e têm a fórmula [Sn (C 6 H 3 -2,6-Et 2 )] n onde n = 8, 10. Um stannyne contém uma ligação tripla de carbono para estanho e um distannyne uma ligação tripla entre dois átomos de estanho (RSnSnR). Distannynes só existem para substituintes extremamente volumosos. Ao contrário dos alcinos , o núcleo C-Sn-Sn-C desses distannynes são não lineares, embora sejam planares. A distância Sn-Sn é 3,066 (1) Å, e os ângulos Sn-Sn-C são 99,25 (14) °. Esses compostos são preparados por redução de halogenetos de arilestanho (II) volumosos.
Preparação
Os compostos organoestânicos podem ser sintetizados por vários métodos. Classic é a reação de um reagente de Grignard com halogenetos de estanho, por exemplo tetracloreto de estanho . Um exemplo é fornecido pela síntese de tetraetilestanho:
- 4 EtMgBr + SnCl 4 → Et 4 Sn + 4 MgClBr
Os compostos simétricos de tetraorganotina, especialmente derivados de tetraalquil, podem então ser convertidos em vários cloretos mistos por reações de redistribuição (também conhecido como "comproporção de Kocheshkov" no caso de compostos organoestânicos):
- 3 R 4 Sn + SnCl 4 → 4 R 3 SnCl
- R 4 Sn + SnCl 4 → 2 R 2 SnCl 2
- R 4 Sn + 3 SnCl 4 → 4 RSnCl 3
Um método relacionado envolve a redistribuição de haletos de estanho com compostos de organoalumínio .
Os compostos de organo-halo estanho mistos podem ser convertidos em derivados orgânicos mistos, conforme ilustrado pela síntese de dibutildivinilestanho:
- Bu 2 SnCl 2 + 2 C 2 H 3 MgBr → Bu 2 Sn (C 2 H 3 ) 2 + 2 MgBrCl
Os hidretos organoestânicos são gerados pela redução dos cloretos de alquila mistos. Por exemplo, o tratamento de dicloreto de dibutilestanho com hidreto de alumínio e lítio dá o di-hidreto de dibutilestanho, um óleo destilável incolor:
O acoplamento do tipo Wurtz de compostos de alquil sódio com halogenetos de estanho produz compostos de tetraorganotina.
A hidrostanilação envolve a adição catalisada por metal de hidretos de estanho em substratos insaturados.
Reações
Reações importantes, discutidas acima, geralmente se concentram em halogenetos de organoestanho e pseudo - halogenetos com nucleófilos. Na área de síntese orgânica , a reação de Stille é considerada importante. Isso envolve a reação de acoplamento com haletos orgânicos hibridizados com sp2 catalisados por paládio:
e adições de organostanano ( adição nucleofílica de um alil-, alenil- ou propargilestanano a um aldeído e iminas). Os compostos organoestânicos também são usados extensivamente na química radical (por exemplo , ciclizações radicais , desoxigenação de Barton-McCombie , descarboxilação de Barton , etc.).
Formulários
Um composto organoestânico é comercialmente aplicado como estabilizantes em cloreto de polivinila . Nessa capacidade, eles suprimem a degradação removendo grupos de cloreto alílico e absorvendo cloreto de hidrogênio. Este aplicativo consome cerca de 20.000 toneladas de estanho por ano. A principal classe de compostos de organo-estanho são dithiolates diorganoestanho com a fórmula R 2 Sn (SR ') 2 . A ligação Sn-S é o componente reativo. Carboxilatos de diorganoestanho, por exemplo, dilaurato de dibutilestanho , são usados como catalisadores para a formação de poliuretanos , para vulcanização de silicones e transesterificação .
O tricloreto de n-butilestanho é usado na produção de camadas de dióxido de estanho em garrafas de vidro por deposição química de vapor .
Aplicações biológicas
" Tributilestanho " são usados como biocidas industriais , por exemplo, como agentes antifúngicos em têxteis e papel, polpa de madeira e sistemas de fábricas de papel, cervejarias e sistemas de resfriamento industriais. Derivados de trifenilestanho são usados como componentes ativos de tintas antifúngicas e fungicidas agrícolas. Outros triorganotins são usados como miticidas e acaricidas . O óxido de tributilestanho tem sido amplamente utilizado como conservante de madeira .
Os compostos de tributilestanho já foram amplamente usados como agentes marinhos anti- biofouling para melhorar a eficiência dos navios oceânicos. As preocupações com a toxicidade desses compostos (alguns relatórios descrevem efeitos biológicos para a vida marinha em uma concentração de 1 nanograma por litro) levou a uma proibição mundial pela Organização Marítima Internacional . Como compostos anti-incrustantes, os compostos organoestânicos foram substituídos por diclorooctilisotiazolinona .
- Compostos organoestânicos
Óleo de tetrabutilestanho incolor, precursor dos outros compostos de butil-estanho
Óxido de tributilestanho , um líquido incolor a amarelo claro usado na preservação de madeira
Acetato de trifenilestanho , um sólido cristalino esbranquiçado, usado como inseticida e fungicida
Cloreto de trifenilestanho , um sólido branco altamente tóxico, usado como biocida
Cloreto de trimetilestanho , um sólido branco tóxico, uma vez usado como biocida
Hidróxido de trifenilestanho , um pó esbranquiçado, usado como fungicida
Azociclotina , um sólido branco, usado como acaricida de longa ação para o controle de ácaros-aranha em plantas
Hexametilditina usada como intermediário na síntese química
Tetraetilestanho , ponto de ebulição 63-65 ° / 12 mm é um catalisador
Toxicidade
As toxicidades dos compostos de tributilestanho e derivados do trifenilestanho são comparáveis às do cianeto de hidrogênio . Além disso, tri- n- alquilestanho são fitotóxicos e, portanto, não podem ser usados na agricultura. Dependendo dos grupos orgânicos, eles podem ser bactericidas e fungicidas poderosos . Refletindo sua alta bioatividade, os "tributilestanho" já foram usados em tintas marítimas antivegetativas .
Em contraste com os compostos de triorgano-estanho, os compostos monoorgano, diorgano- e tetra-orgânico são muito menos perigosos.
DBT pode, no entanto, ser imunotóxico.







![Esquema de reação de Stille {\ displaystyle {\ ce {{RX} + R'-SnR''3 -> [{\ ce {Pd \ catalyst}}] {R-R '} + XSnR''3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16d2a781e9a7142312c1fd6052ce33fc93f0814a)