Beta-glucuronidase - Beta-glucuronidase
| beta-glucuronidase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Homotetrâmero de glucuronidase
(unidade biológica assumida) | |||||||||
| Identificadores | |||||||||
| EC nº | 3.2.1.31 | ||||||||
| CAS no. | 9001-45-0 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
| glucuronidase, beta | |||||||
|---|---|---|---|---|---|---|---|
 Unidade assimétrica de beta-glucuronidase mostrando os resíduos do sítio ativo Glu451, Tyr504 e Glu540, junto com o resíduo Asn450 potencialmente de suporte
| |||||||
| Identificadores | |||||||
| Símbolo | GUSB | ||||||
| Gene NCBI | 2990 | ||||||
| HGNC | 4696 | ||||||
| OMIM | 611499 | ||||||
| RefSeq | NM_000181 | ||||||
| UniProt | P08236 | ||||||
| Outros dados | |||||||
| Número CE | 3.2.1.31 | ||||||
| Locus | Chr. 7 q11.21 | ||||||
| |||||||
As beta-glucuronidases são membros da família das enzimas glicosidase que catalisam a quebra de carboidratos complexos . A β-glucuronidase humana é um tipo de glucuronidase (um membro da família da glicosidase 2) que catalisa a hidrólise de resíduos de ácido β-D- glucurônico da extremidade não redutora dos mucopolissacarídeos (também chamados de glicosaminoglicanos ), como o sulfato de heparano . A β-glucuronidase humana está localizada no lisossoma . No intestino, a β-glucuronidase da borda em escova converte a bilirrubina conjugada na forma não conjugada para reabsorção. A beta-glucuronidase também está presente no leite materno, o que contribui para a icterícia neonatal . A proteína é codificada pelo gene GUSB em humanos e pelo gene uidA em bactérias.
Estrutura
A β-glucuronidase humana é sintetizada como um monômero de 80 kDa (653 aminoácidos ) antes que a proteólise remova 18 aminoácidos da extremidade C-terminal para formar um monômero de 78 kDa. A beta-glucuronidase existe como um homotetrâmero de 332 kDa . A beta-glucuronidase contém várias formações estruturais notáveis, incluindo um tipo de barril beta conhecido como barril de gelatina e barril TIM .
Mecanismo de catálise
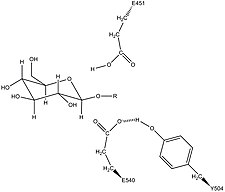
A β-glucuronidase humana é homóloga à enzima Escherichia coli β-galactosidase . Essa relação homóloga, juntamente com o conhecimento de que as glicosidases freqüentemente realizam hidrólise catalisada por dois resíduos ácidos , possibilitou o desenvolvimento de uma hipótese mecanística. Esta hipótese propõe que os dois resíduos de ácido glutâmico Glu540 e Glu451 são os resíduos nucleofílico e ácido , respectivamente, e que o resíduo de tirosina Tyr504 também está envolvido na catálise. Para apoiar esta hipótese, as mutações experimentais em qualquer um desses três resíduos resultam em grandes diminuições da atividade enzimática. A atividade aumentada de uma enzima mutante E451A (onde Glu451 é substituído por um resíduo de alanina ) após a adição de azida é consistente com Glu451 como o resíduo ácido / base. Usando a análise de peptídeos β-glucuronidase marcados após a hidrólise de um substrato que entra em um estágio intermediário muito estável, os pesquisadores determinaram que Glu540 é o resíduo nucleofílico.
Embora o tipo particular de substituição nucleofílica empregado pela β-glucuronidase não seja claro, a evidência dos mecanismos de seus homólogos na família da glicosidase sugere que essas reações são qualitativamente S N 2 . As reações passam por um estado de transição com características do íon oxocarbênio . Inicialmente, esses mecanismos, devido a esta característica do oxocarbênio no estado de transição, foram sugeridos como sendo reações S N 1 procedentes de um discreto intermediário do íon oxocarbênio . No entanto, evidências mais recentes sugerem que esses estados de íons de oxocarbênio têm tempos de vida de 10 femtossegundos - 0,1 nanossegundos (semelhante ao de um período de vibração de ligação ). Essas vidas são muito curtas para serem atribuídas a um intermediário de reação. A partir dessa evidência, parece que essas reações, embora tenham uma aparência S N 1 devido às características do íon oxocarbênio de seus estados de transição, devem ser qualitativamente reações S N 2.
A atividade específica de Tyr504 no mecanismo catalítico não é clara. Por comparação com os dados estruturais da enzima xilanase homóloga , foi sugerido que Tyr504 da β-glucuronidase pode estabilizar o nucleófilo de saída (Glu540) ou modular a sua atividade.
Além desses resíduos, um resíduo conservado de asparagina (Asn450) foi sugerido para estabilizar o substrato através da ação de uma ligação de hidrogênio no grupo 2-hidroxila do substrato de açúcar.
Unidade de repetição do substrato de sulfato de heparano de β-glucuronidase
Mecanismo de hidrólise de β-glucuronidase de um substrato de açúcar com estados de transição de alta energia mostrando o caráter de íon oxocarbênio representado
Síndrome manhosa
As deficiências na β-glucuronidase resultam na doença metabólica hereditária autossômica recessiva conhecida como síndrome de Sly ou Mucopolissacaridose VII. A deficiência dessa enzima resulta no acúmulo de mucopolissacarídeos não hidrolisados no paciente. Esta doença pode ser extremamente debilitante para o paciente ou pode resultar em hidropisia fetal antes do nascimento. Além disso, retardo mental, baixa estatura, características faciais ásperas, anormalidades da coluna e aumento do fígado e baço são observados em pacientes sobreviventes. Esta doença foi modelada em uma linhagem de camundongos e também em uma família de cães. Mais recentemente, pesquisadores descobriram uma família felina que exibe deficiências na atividade da β-glucuronidase. A fonte desta redução de atividade foi identificada como uma mutação E351K (Glu351 é mutado para um resíduo de lisina). Glu351 é conservado em espécies de mamíferos, o que sugere uma função importante para este resíduo. O exame da estrutura de cristal de raios-X humana sugere que este resíduo (Glu352 na enzima humana), que está enterrado profundamente no domínio do cilindro TIM , pode ser importante para a estabilização da estrutura terciária da enzima. Na estrutura cristalina, parece que Arg216, um membro do domínio do jelly roll da proteína, forma uma ponte de sal com Glu352; portanto, Glu352 está provavelmente envolvido na estabilização da interação entre dois domínios tridimensionais diferentes da enzima.
Aplicações moleculares: use como um gene repórter
Em biologia molecular , a β-glucuronidase é usada como um gene repórter para monitorar a expressão gênica em células de mamíferos e plantas. O monitoramento da atividade da β-glucuronidase através do uso de um ensaio GUS permite a determinação da expressão espacial e temporal do gene em questão.
- Imagens moleculares gráficas foram produzidas usando o pacote UCSF Chimera do Resource for Biocomputing, Visualization, and Informatics da University of California, San Francisco (apoiado por NIH P41 RR-01081).
Veja também
Referências
Leitura adicional
- George J (junho de 2008). “A beta-glucuronidase sérica elevada reflete a fragilidade lisossomal hepática após lesão tóxica do fígado em ratos”. Bioquímica e Biologia Celular . 86 (3): 235–43. doi : 10.1139 / O08-038 . PMID 18523484 .
- Bell CE, Sly WS, Brot FE (janeiro de 1977). "Mucopolissacaridose por deficiência de beta-glucuronidase humana: identificação de antígeno de reação cruzada em cultura de fibroblastos de pacientes deficientes por imunoensaio enzimático" . The Journal of Clinical Investigation . 59 (1): 97–105. doi : 10.1172 / JCI108627 . PMC 333336 . PMID 401508 .
- Tanaka J, Gasa S, Sakurada K, Miyazaki T, Kasai M, Makita A (janeiro de 1992). "Caracterização das subunidades e da porção de açúcar da placenta humana e da beta-glucuronidase leucêmica". Biological Chemistry Hoppe-Seyler . 373 (1): 57–62. doi : 10.1515 / bchm3.1992.373.1.57 . PMID 1311180 .
- Wolfe JH, Sands MS, Barker JE, Gwynn B, Rowe LB, Vogler CA, Birkenmeier EH (1993). "Reversão da patologia na mucopolissacaridose murina tipo VII por transferência de genes de células somáticas". Nature . 360 (6406): 749–53. doi : 10.1038 / 360749a0 . PMID 1465145 . S2CID 4337590 .
- Tomatsu S, Fukuda S, Sukegawa K, Ikedo Y, Yamada S, Yamada Y, Sasaki T, Okamoto H, Kuwahara T, Yamaguchi S (janeiro de 1991). "Mucopolissacaridose tipo VII: caracterização de mutações e heterogeneidade molecular" . American Journal of Human Genetics . 48 (1): 89–96. PMC 1682743 . PMID 1702266 .
- Shipley JM, Miller RD, Wu BM, Grubb JH, Christensen SG, Kyle JW, Sly WS (agosto de 1991). "Análise da região flanqueadora 5 'do gene da beta-glucuronidase humana". Genômica . 10 (4): 1009–18. doi : 10.1016 / 0888-7543 (91) 90192-H . PMID 1916806 .
- Ono M, Taniguchi N, Makita A, Fujita M, Sekiya C, Namiki M (abril de 1988). "Fosforilação de beta-glucuronidases de fígado normal humano e hepatoma por proteína quinase dependente de cAMP" . The Journal of Biological Chemistry . 263 (12): 5884–9. doi : 10.1016 / S0021-9258 (18) 60648-9 . PMID 2833520 .
- Guise KS, Korneluk RG, Waye J, Lamhonwah AM, Quan F, Palmer R, Ganschow RE, Sly WS, Gravel RA (1985). "Isolamento e expressão em Escherichia coli de um clone de cDNA que codifica beta-glucuronidase humana". Gene . 34 (1): 105–10. doi : 10.1016 / 0378-1119 (85) 90300-2 . PMID 3924735 .
- Ho YC, Ho LH, Ho KJ (1985). "Beta-glucuronidase hepática humana: um estudo cinético enzimático". Enzyme . 33 (1): 9–17. doi : 10.1159 / 000469398 . PMID 3987656 .
- Shipley JM, Klinkenberg M, Wu BM, Bachinsky DR, Grubb JH, Sly WS (março de 1993). "Análise mutacional de um paciente com mucopolissacaridose tipo VII e identificação de pseudogenes" . American Journal of Human Genetics . 52 (3): 517–26. PMC 1682147 . PMID 7680524 .
- Vervoort R, Lissens W., Liebaers I (1994). "Análise molecular de um paciente com hidropisia fetal causada por deficiência de beta-glucuronidase e evidência de pseudogenes adicionais". Mutação Humana . 2 (6): 443–5. doi : 10.1002 / humu.1380020604 . PMID 8111412 . S2CID 46432543 .
- Wu BM, Sly WS (1994). "Estudos mutacionais em um paciente com a forma de hidropisia fetal de mucopolissacaridose tipo VII". Mutação Humana . 2 (6): 446–57. doi : 10.1002 / humu.1380020605 . PMID 8111413 . S2CID 21484555 .
- Maruyama K, Sugano S (janeiro de 1994). "Oligo-capping: um método simples para substituir a estrutura cap de mRNAs eucarióticos por oligoribonucleotídeos". Gene . 138 (1–2): 171–4. doi : 10.1016 / 0378-1119 (94) 90802-8 . PMID 8125298 .
- Moullier P, Bohl D, Heard JM, Danos O (junho de 1993). "Correção do armazenamento lisossomal no fígado e baço de camundongos MPS VII por implantação de fibroblastos de pele geneticamente modificados". Nature Genetics . 4 (2): 154–9. doi : 10.1038 / ng0693-154 . PMID 8348154 . S2CID 26122567 .
- Shipley JM, Grubb JH, Sly WS (junho de 1993). "O papel da glicosilação e fosforilação na expressão da beta-glucuronidase humana ativa" . The Journal of Biological Chemistry . 268 (16): 12193–8. doi : 10.1016 / S0021-9258 (19) 50325-8 . PMID 8505339 .
- Nishimura Y, Kato K, Himeno M (julho de 1995). "Caracterização bioquímica do fígado microssomal, Golgi, lisossomal e soro beta-glucuronidases em ratos tratados com fosfato de dibutila". Journal of Biochemistry . 118 (1): 56–66. doi : 10.1093 / oxfordjournals.jbchem.a124892 . PMID 8537326 .
- Jain S, Drendel WB, Chen ZW, Mathews FS, Sly WS, Grubb JH (abril de 1996). "Estrutura da beta-glucuronidase humana revela o candidato a direcionamento lisossomal e motivos de sítio ativo". Nature Structural Biology . 3 (4): 375–81. doi : 10.1038 / nsb0496-375 . PMID 8599764 . S2CID 28862883 .
- Vervoort R, Islam MR, Sly WS, Zabot MT, Kleijer WJ, Chabas A, Fensom A, Young EP, Liebaers I, Lissens W (março de 1996). "Análise molecular de pacientes com deficiência de beta-glucuronidase que se apresenta como hidropisia fetal ou como mucopolissacaridose VII precoce" . American Journal of Human Genetics . 58 (3): 457–71. PMC 1914559 . PMID 8644704 .
- Bonaldo MF, Lennon G, Soares MB (setembro de 1996). "Normalização e subtração: duas abordagens para facilitar a descoberta do gene" . Genome Research . 6 (9): 791–806. doi : 10.1101 / gr.6.9.791 . PMID 8889548 .
- Dentino AR, Raj PA, De Nardin E (janeiro de 1997). "Diferenças sutis entre os receptores de neutrófilos humanos e de coelho mostradas pela atividade do secretagogo de peptídeos formil restritos". Arquivos de Bioquímica e Biofísica . 337 (2): 267–74. doi : 10.1006 / abbi.1996.9791 . PMID 9016822 .
links externos
- Glucuronidase nos cabeçalhos de assuntos médicos da Biblioteca Nacional de Medicina dos EUA (MeSH)
- Pesquisa atualizada sobre repórter glucuronidase e outros repórteres da Reportergene
- Banco de dados de pesquisa de mecanismo catalítico e outras informações sobre beta-glucuronidase