Oxocarbenium - Oxocarbenium
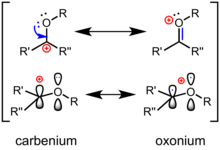
Um íon oxocarbênio (ou íon oxacarbênio ) é uma espécie química caracterizada por um carbono hibridizado sp 2 central, um substituinte de oxigênio e uma carga positiva geral que é deslocalizada entre os átomos de carbono e oxigênio centrais. Um íon oxocarbênio é representado por duas estruturas de ressonância limitantes, uma na forma de um íon carbênio com carga positiva no carbono e a outra na forma de uma espécie de oxônio com carga formal no oxigênio. Como um híbrido de ressonância, a verdadeira estrutura fica entre os dois. Em comparação com compostos de carbonila neutros como cetonas ou ésteres, a forma de íon carbênio é um contribuinte maior para a estrutura. Eles são intermediários reativos comuns na hidrólise de ligações glicosídicas e são uma estratégia comumente usada para glicosilação química . Esses íons têm sido propostos como intermediários reativos em uma ampla gama de transformações químicas e têm sido utilizados na síntese total de vários produtos naturais. Além disso, eles comumente aparecem em mecanismos de biossíntese catalisada por enzimas e hidrólise de carboidratos na natureza. As antocianinas são corantes flavílio naturais , compostos de oxocarbênio estabilizados. As antocianinas são responsáveis pelas cores de uma grande variedade de flores comuns, como amores - perfeitos e plantas comestíveis, como berinjela e mirtilo .
Distribuição e reatividade de elétrons
A melhor estrutura de Lewis para um íon oxocarbênio contém uma ligação dupla oxigênio-carbono , com o átomo de oxigênio ligado a um grupo adicional e, conseqüentemente, assumindo uma carga formal positiva. Na linguagem das estruturas canônicas (ou "ressonância"), a polarização da ligação π é descrita por uma forma de ressonância carbocitária secundária, com uma carga formal positiva no carbono (veja acima). Em termos de teoria de orbitais moleculares de fronteira , o orbital molecular desocupado mais baixo (LUMO) do íon oxocarbênio é um orbital π * que tem o lóbulo grande no átomo de carbono; quanto mais oxigênio eletronegativo contribui menos para o LUMO. Conseqüentemente, em um evento de ataque nucleofílico , o carbono é o sítio eletrofílico . Em comparação com uma cetona , a polarização de um íon oxocarbênio é acentuada: eles se parecem mais com um carbocátion "verdadeiro" e são mais reativos com os nucleófilos. Em reações orgânicas, as cetonas são comumente ativadas pela coordenação de um ácido de Lewis ou ácido de Brønsted ao oxigênio para gerar um íon oxocarbênio como intermediário.
Numericamente, uma carga parcial típica (derivada de cálculos Hartree-Fock) para o carbono carbonílico de uma cetona R 2 C = O (como a acetona) é δ + = 0,51. Com a adição de um hidrogênio ácido ao átomo de oxigênio para produzir [R 2 C = OH] + , a carga parcial aumenta para δ + = 0,61. Em comparação, os análogos de nitrogênio de cetonas e íons oxocarbênio, iminas (R 2 C = NR) e íons imínio ([R 2 C = NRH] + ), respectivamente, têm cargas parciais de δ + = 0,33 e δ + = 0,54, respectivamente. A ordem da carga positiva parcial no carbono carbonílico é, portanto, imina <cetona <imínio <oxocarbênio.
Esta também é a ordem de eletrofilicidade para espécies contendo ligações C = X (X = O, NR). Esta ordem é sinteticamente significativa e explica, por exemplo, por que aminações redutivas são frequentemente melhor realizadas em pH = 5 a 6 usando cianoboro-hidreto de sódio (Na + [H 3 B (CN)] - ) ou triacetoxiboro-hidreto de sódio (Na + [HB ( OAc) 3 ] - ) como reagente. Com um grupo de retirada de elétrons, o cianoboro-hidreto de sódio e o triacetoxiboro-hidreto de sódio são agentes redutores mais fracos do que o boro-hidreto de sódio, e sua reação direta com cetonas é geralmente um processo lento e ineficiente. No entanto, o íon imínio (mas não a própria imina) formado in situ durante uma reação de aminação redutiva é um eletrófilo mais forte do que o material de partida cetona e reagirá com a fonte de hidreto a uma taxa sinteticamente útil. É importante ressaltar que a reação é conduzida sob condições levemente ácidas que protonam o intermediário de imina em uma extensão significativa, formando o íon imínio, embora não seja fortemente ácido o suficiente para protonar a cetona, que formaria o íon oxocarbênio ainda mais eletrofílico. Assim, as condições de reação e o reagente garantem que a amina seja formada seletivamente a partir da redução do imínio, em vez da redução direta do grupo carbonila (ou sua forma protonada) para formar um álcool.
Formação
A formação de íons oxocarbênio pode ocorrer por várias vias diferentes. Mais comumente, o oxigênio de uma cetona se liga a um ácido de Lewis , que ativa a cetona, tornando-a um eletrófilo mais eficaz. O ácido de Lewis pode ser uma ampla gama de moléculas, desde um simples átomo de hidrogênio até complexos metálicos. O restante deste artigo se concentrará em íons alquil oxocarbênio, no entanto, onde o átomo adicionado ao oxigênio é um carbono. Uma maneira pela qual esse tipo de íon se formará é a eliminação de um grupo eliminável . Na química dos carboidratos, esse grupo eliminável costuma ser um éter ou éster . Uma alternativa para a eliminação é a desprotonação direta da molécula para formar o íon, no entanto, isso pode ser difícil e requer bases fortes para se conseguir.
Aplicações para síntese
Anéis de 5 membros
A estereoquímica envolvida nas reações de anéis de cinco membros pode ser prevista por um modelo de estado de transição de envelope. Os nucleófilos favorecem a adição "de dentro" do envelope ou do topo da figura à direita. A adição "interna" produz resultados em uma conformação escalonada , em vez da conformação eclipsada que resulta da adição "externa".
Anéis de 6 membros
O modelo de estado de transição para um anel de oxocarbênio de seis membros foi proposto no início de 1992 por Woods et al. A estratégia geral para determinar a estereoquímica de uma adição nucleofílica a um anel de seis membros segue um procedimento semelhante ao caso do anel de cinco membros. A suposição que se faz para esta análise é que o anel está na mesma conformação do ciclohexeno , com três carbonos e o oxigênio em um plano com os outros dois átomos de carbono enrugados para fora do plano, com um acima e outro abaixo (ver o figura à direita). Com base nos substituintes presentes no anel, a conformação de energia mais baixa é determinada, tendo em mente os efeitos estéricos e esteroeletrônicos (consulte a seção abaixo para uma discussão sobre os efeitos estereeletrônicos em anéis de oxocarbênio). Uma vez estabelecida essa conformação, pode-se considerar a adição nucleofílica. A adição irá prosseguir através do estado de transição da cadeira de baixa energia, ao invés do barco de torção de energia relativamente alta. Um exemplo desse tipo de reação pode ser visto a seguir. O exemplo também destaca como o efeito estereeletrônico exercido por um substituinte eletronegativo vira a conformação de energia mais baixa e leva à seletividade oposta.
Efeitos estereeletrônicos
Em um anel alqueno que não contém um átomo de oxigênio, qualquer substituinte grande prefere estar em uma posição equatorial, a fim de minimizar os efeitos estéricos . Foi observado em anéis contendo íons oxocarbênio que substituintes eletronegativos preferem as posições axial ou pseudo-axial. Quando o átomo eletronegativo está na posição axial, sua densidade de elétrons pode ser doada através do espaço para o átomo de oxigênio carregado positivamente no anel. Essa interação eletrônica estabiliza a conformação axial. Grupos hidroxila , éteres e halogênios são exemplos de substituintes que apresentam esse fenômeno. Os efeitos estereeletrônicos devem ser levados em consideração ao determinar a conformação de energia mais baixa na análise para adição nucleofílica a um íon oxocarbênio.
Cycloadditions
Na síntese orgânica, os íons de vinil oxocarbênio (estrutura à direita) podem ser utilizados em uma ampla gama de reações de cicloadição . Eles são comumente empregados como dienófilos na reação de Diels-Alder . Uma cetona que retira elétrons é frequentemente adicionada ao dienófilo para aumentar a taxa da reação, e essas cetonas são frequentemente convertidas em íons de vinil oxocarbênio durante a reação. Não está claro se um íon de oxocarbênio necessariamente se formará, mas Roush e colaboradores demonstraram o intermediário oxocarbênio na ciclização mostrada abaixo. Dois produtos foram observados nesta reação, que só poderiam se formar se o anel oxocarbenium estivesse presente como um intermediário. As cicloadições [4 + 3], [2 + 2], [3 + 2] e [5 + 2] com intermediários de oxocarbênio também foram relatadas.
Reação aldólica
Os íons oxocarbênio quirais têm sido explorados para realizar reações de adição de acetato aldólico altamente diastereosseletivas e enantiosseletivas. O íon oxocarbênio é usado como eletrófilo na reação. Quando o grupo metil aumenta de tamanho, a diastereosselevividade aumenta.
Exemplos de síntese total
Os íons oxocarbênio foram utilizados na síntese total em várias ocasiões. Uma subunidade principal de (+) - clavosolídeo foi sintetizada com uma redução de um anel de oxocarbênio de seis membros. Todos os grandes substituintes foram encontrados em posição equatorial, e a transformação passou pelo estado de transição da cadeira, conforme previsto.
Um segundo exemplo é visto na etapa chave da síntese de (-) - neopeltolida, que usa outra redução de anel de oxocarbênio de seis membros para uma adição de hidreto diastereosseletiva.
Aplicações à biologia
Em sistemas biológicos, os íons oxocarbênio são vistos principalmente durante reações de carboidratos . Como os açúcares estão presentes na estrutura dos ácidos nucléicos , com um açúcar ribose presente no RNA e uma desoxirribose na estrutura do DNA , sua química desempenha um papel importante em uma ampla gama de funções celulares dos ácidos nucléicos. Além de suas funções nos nucleotídeos, os açúcares também são usados para componentes estruturais dos organismos, como moléculas de armazenamento de energia, moléculas de sinalização celular, modificação de proteínas e desempenham papéis fundamentais no sistema imunológico , fertilização , prevenção da patogênese , coagulação do sangue e desenvolvimento . A abundância da química do açúcar nos processos biológicos leva muitos mecanismos de reação a ocorrerem por meio dos íons oxocarbênio. Várias reações biológicas importantes que utilizam íons oxocarbênio são descritas nesta seção.
Biossíntese de nucleotídeos
Os nucleotídeos podem sofrer ciclização intramolecular catalisada por enzimas para produzir várias moléculas biológicas importantes. Essas ciclizações normalmente ocorrem por meio de um intermediário de oxocarbênio. Um exemplo dessa reação pode ser visto na ciclização ADP ribose cíclica , que é uma molécula importante para a sinalização do cálcio intracelular .
Glicosidases
A glicosidase é uma enzima que catalisa a quebra de uma ligação glicosídica para produzir dois açúcares menores. Esse processo tem implicações importantes na utilização da energia armazenada, como o glicogênio em animais, bem como na quebra da celulose por organismos que se alimentam de plantas. Em geral, resíduos de ácido aspártico ou glutâmico no sítio ativo da enzima catalisam a hidrólise da ligação glicosídica. O mecanismo dessas enzimas envolve um intermediário de íon oxocarbênio, um exemplo geral do qual é mostrado abaixo.