Íon carbênio - Carbenium ion
Um íon carbênio é um íon positivo com a estrutura RR′R ″ C + , ou seja, uma espécie química com um carbono trivalente que carrega uma carga formal +1 .
Na literatura mais antiga, o nome íon de carbono era usado para esta classe, mas agora ele se refere exclusivamente a outra família de carbocations , os íons de carbono, onde o carbono carregado é pentavalente . As definições atuais foram propostas pelo químico George Andrew Olah em 1972 e agora são amplamente aceitas.
Os íons de carbênio são geralmente altamente reativos devido a ter um octeto incompleto de elétrons; entretanto, certos íons de carbênio , como o íon de tropílio , são relativamente estáveis devido à carga positiva sendo deslocalizada entre os átomos de carbono.
Nomenclatura
Os íons de carbênio são classificados como primários , secundários ou terciários, dependendo se o número de átomos de carbono ligados ao carbono ionizado é 1, 2 ou 3. (Íons com zero carbonos ligados ao carbono ionizado, como metênio , CH+
3, geralmente estão incluídos na classe primária).
Reatividade
A estabilidade normalmente aumenta com o número de grupos alquil ligados ao carbono que carrega a carga. Os carbocations terciários são mais estáveis (e se formam mais prontamente) do que os carbocations secundários, porque são estabilizados por hiperconjugação . Carbocations primários são altamente instáveis. Portanto, reações como a reação S N 1 e a reação de eliminação E1 normalmente não ocorrem se um carbênio primário for formado.
No entanto, um carbono duplamente ligado ao carbono ionizado pode estabilizar o íon por ressonância . Cátions como o cátion alil , CH
2= CH-CH+
2, e o cátion benzil , C
6H
5−CH+
2, são mais estáveis do que a maioria dos outros carbocations. As moléculas que podem formar alil ou benzil carbênios são especialmente reativas. Os íons carbênio também podem ser estabilizados por heteroátomos .
Os íons de carbênio podem sofrer reações de rearranjo de estruturas menos estáveis para outras igualmente estáveis ou mais estáveis, com constantes de velocidade superiores a 10 9 s -1 . Esse fato complica as vias sintéticas para muitos compostos. Por exemplo, quando o pentan-3-ol é aquecido com HCl aquoso, o carbocátion de 3-pentil inicialmente formado se reorganiza em uma mistura estatística de 3-pentil e 2-pentil. Esses cátions reagem com o íon cloreto para produzir 3-cloropentano e 2-cloropentano em uma proporção de aproximadamente 1: 2.
Tipos de íons de carbênio
Íons de alquílio
Os íons carbênio podem ser preparados diretamente a partir de alcanos , removendo um ânion hidreto , H-
, com um ácido forte. Por exemplo, ácido mágico , uma mistura de pentafluoreto de antimônio ( SbF
5) e ácido fluorossulfúrico ( FSO
3H ), transforma isobutano no cátion trimetilcarbênio, (CH
3)
3C+
.
Íons de carbênio aromáticos
O íon tropílio é uma espécie aromática com a fórmula C
7H+
7. Seu nome deriva da molécula tropina (em homenagem à molécula atropina ). Os sais do cátion de tropílio podem ser estáveis, por exemplo, tetrafluoroborato de tropílio . Pode ser feito de cicloheptatrieno (tropilideno) e bromo ou pentacloreto de fósforo
É um íon planar, cíclico, heptagonal ; ele também tem 6 elétrons π (4 n + 2, onde n = 1), o que cumpre a regra de aromaticidade de Hückel . Ele pode se coordenar como um ligante para átomos de metal .
A estrutura mostrada é um composto de sete contribuintes de ressonância em que cada carbono carrega parte da carga positiva.
Em 1891, G. Merling obteve um sal solúvel em água a partir de uma reação de cicloheptatrieno e bromo. A estrutura foi elucidada por Eggers Doering e Knox em 1954.
Outro íon carbênio aromático é o íon ciclopropenil ou ciclopropênio , C
3H+
3, obtido por Ronald Breslow e John T. Groves em 1970. Embora menos estável do que o cátion tropílio, este íon carbênio também pode formar sais à temperatura ambiente. As soluções de tais sais foram descobertas por Breslow e Groves como tendo propriedades espectroscópicas e químicas que correspondiam às expectativas de um íon carbênio aromático.
Catião trifenilmetil (tritil)
O trifenilcarbénio ou catião trifenilmetilo, [C (C
6H
5)
3]+
, é especialmente estável porque a carga positiva pode ser distribuída entre 10 dos átomos de carbono (os 3 átomos de carbono nas posições orto e para de cada um dos três grupos fenil, mais o átomo de carbono central). Existe nos compostos trifenilmetil hexafluorofosfato [C (C
6H
5)
3]+
[PF
6]-
, trifenilmetil tetrafluoroborato [C (C
6H
5)
3]+
[BF
4]-
, e perclorato de trifenilmetil [C (C
6H
5)
3]+
[ClO
4]-
. Seus derivados incluem os corantes triarilmetano .
Íons de arênio

Um íon arênio é um cátion ciclohexadienil que aparece como um intermediário reativo na substituição aromática eletrofílica . Por razões históricas, esse complexo também é chamado de intermediário de Wheland ou complexo σ .
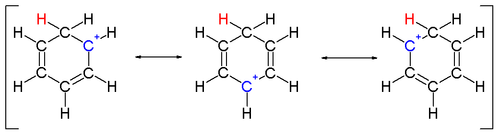
Dois átomos de hidrogênio ligados a um carbono ficam em um plano perpendicular ao anel de benzeno. O íon arênio não é mais uma espécie aromática; no entanto, é relativamente estável devido à deslocalização: a carga positiva é deslocalizada em 5 átomos de carbono através do sistema π , conforme representado nas seguintes estruturas de ressonância :
Outra contribuição para a estabilidade dos íons de arênio é o ganho de energia resultante da forte ligação entre o benzeno e o eletrófilo complexado.
O menor íon de arênio é o benzeno protonado , C
6H+
7. O íon benzênio pode ser isolado como um composto estável quando o benzeno é protonado pelo superácido carborano , H (CB 11 H (CH 3 ) 5 Br 6 ). O sal de benzênio é cristalino com estabilidade térmica de até 150 ° C. Os comprimentos de ligação deduzidos da cristalografia de raios-X são consistentes com uma estrutura de cátions ciclohexadienil.
Íons acílio
Um íon acílio é um cátion com a fórmula RCO + . A estrutura é descrita como R − C≡O + ou R−= O. É o equivalente sintético e reativo de um carbocátion de acila, mas a estrutura real tem o oxigênio e o carbono ligados por uma ligação tripla. Essas espécies são intermediários reativos comuns, por exemplo, nas acilações de Friedel-Crafts e também em muitas outras reações orgânicas , como o rearranjo de Hayashi . Sais contendo íons de acílio podem ser gerados pela remoção do haleto de haletos de acila :
- RCOCl + SbCl 5 → RCO + SbCl-
6
A distância C – O nesses cátions é próxima a 1,1 ångströms , ainda mais curta do que no monóxido de carbono . Os cátions acílio são fragmentos característicos observados em espectros de massa EI de cetonas .