Alkane - Alkane

Em química orgânica , um alcano , ou parafina (um nome histórico trivial que também tem outros significados ), é um hidrocarboneto saturado acíclico . Em outras palavras, um alcano consiste em átomos de hidrogênio e carbono dispostos em uma estrutura de árvore na qual todas as ligações carbono-carbono são únicas . Alcanos tem a fórmula química geral C n H 2 N 2 . Os alcanos variam em complexidade desde o caso mais simples de metano (CH 4 ), onde n = 1 (às vezes chamado de molécula-mãe), a moléculas arbitrariamente grandes e complexas, como pentacontano (C 50 H 102 ) ou 6-etil-2- metil-5- (1-metiletil) octano, um isômero de tetradecano (C 14 H 30 ).
A União Internacional de Química Pura e Aplicada (IUPAC) define alcanos como "ramificado aciclico ou hidrocarbonetos não ramificados que possuem a fórmula geral C n H 2 n 2 , e, por conseguinte, consistindo inteiramente de átomos de hidrogénio e átomos de carbono saturados." No entanto, algumas fontes usam o termo para denotar qualquer hidrocarboneto saturado, incluindo aqueles que são monocíclicos (isto é, os cicloalcanos ) ou policíclicos, apesar de terem uma fórmula geral distinta (isto é, os cicloalcanos são C n H 2 n ).
Em um alcano, cada átomo de carbono é hibridizado com sp 3 com 4 ligações sigma (C – C ou C – H ), e cada átomo de hidrogênio é unido a um dos átomos de carbono (em uma ligação C – H). A mais longa série de átomos de carbono ligados em uma molécula é conhecida como seu esqueleto de carbono ou estrutura de carbono. O número de átomos de carbono pode ser considerado como o tamanho do alcano.
Um grupo dos alcanos superiores são ceras , sólidos à temperatura e pressão ambiente padrão (SATP), para os quais o número de átomos de carbono na estrutura de carbono é maior do que cerca de 17. Com suas unidades repetidas de –CH 2 , os alcanos constituem um homólogo série de compostos orgânicos em que os membros diferem em massa molecular por múltiplos de 14,03 u (a massa total de cada unidade de ponte de metileno , que compreende um único átomo de carbono de massa 12,01 u e dois átomos de hidrogênio de massa ~ 1,01 u cada) .
O metano é produzido por bactérias metanogênicas e alguns alcanos de cadeia longa funcionam como feromônios em certas espécies animais ou como ceras protetoras em plantas e fungos. No entanto, a maioria dos alcanos não tem muita atividade biológica . Eles podem ser vistos como árvores moleculares nas quais podem ser pendurados os grupos funcionais mais ativos / reativos de moléculas biológicas.
Os alcanos têm duas fontes comerciais principais: petróleo ( petróleo bruto) e gás natural .
Um grupo alquil é um fragmento molecular baseado em alcano que possui uma valência aberta para ligação. Eles são geralmente abreviados com o símbolo para qualquer grupo organil, R, embora Alk às vezes seja usado para simbolizar especificamente um grupo alquil (em oposição a um grupo alquenil ou grupo aril).
Estrutura e classificação
Normalmente, a distância da ligação simples CC é 1,53 Å. Os hidrocarbonetos saturados podem ser lineares, ramificados ou cíclicos . O terceiro grupo é às vezes chamado de cicloalcanos . Estruturas muito complicadas são possíveis combinando alcanos lineares, ramificados e cíclicos.
Isomeria
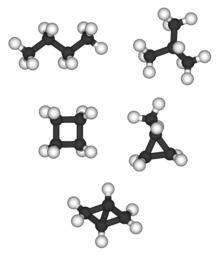
Biciclo [1.1.0] butano é o único C 4 H 6 alcano e não tem qualquer isómero alcano; tetraedrano (abaixo) é o único C 4 H 4 alcano e, portanto, não tem isômero de alcano.
Alcanos com mais de três átomos de carbono podem ser arranjados de várias maneiras, formando isômeros estruturais . O isômero mais simples de um alcano é aquele em que os átomos de carbono estão dispostos em uma única cadeia sem ramificações. Esse isômero é às vezes chamado de isômero n ( n para "normal", embora não seja necessariamente o mais comum). No entanto, a cadeia de átomos de carbono também pode ser ramificada em um ou mais pontos. O número de isômeros possíveis aumenta rapidamente com o número de átomos de carbono. Por exemplo, para alcanos acíclicos:
- C 1 : apenas metano
- C 2 : etano única
- C 3 : propano apenas
- Isômeros C 4 : 2: butano e isobutano
- Isômeros C 5 : 3: pentano , isopentano e neopentano
- Isômeros C 6 : 5: hexano , 2-metilpentano , 3-metilpentano , 2,2-dimetilbutano e 2,3-dimetilbutano
- Isômeros C 7 : 9: heptano , metilhexano (2 isômeros), dimetilpentano (4 isômeros), 3-etilpentano , 2,2,3-trimetilbutano
- C 8 : 18 isômeros: octano , 2-metilheptano , 3-metilheptano , 2,3-dimetilhexano , 3,4-dimetilhexano , 2,3,4-trimetilpentano , 3,3-dimetilhexano , 2,2-trimetilpentano , 2, 4-dimetilhexano , 2,2,4-trimetilpentano , 2,3,3-Trimetilpentano , 3,3,4-trimetil-pentano , 3,4,4-trimetilpentano , 2,4,4-trimetilpentano , (5 isômeros)
- Isômeros C 9 : 35
- C 10 : 75 isômeros
- C 12 : 355 isômeros
- C 32 : 27.711.253.769 isômeros
- C 60 : 22.158.734.535.770.411.074.184 isômeros, muitos dos quais não são estáveis.
Alcanos ramificados podem ser quirais . Por exemplo, 3-metilhexano e seus homólogos superiores são quirais devido ao seu centro estereogênico no átomo de carbono número 3. A lista acima inclui apenas diferenças de conectividade, não estereoquímica. Além dos isômeros de alcano, a cadeia de átomos de carbono pode formar um ou mais anéis. Esses compostos são chamados de cicloalcanos e também são excluídos da lista acima porque a alteração do número de anéis altera a fórmula molecular . Por exemplo, ciclobutano e metilciclopropano são isômeros um do outro (C 4 H 8 ), mas não são isômeros de butano (C 4 H 10 ).
Nomenclatura
A nomenclatura IUPAC (forma sistemática de nomear compostos) para alcanos é baseada na identificação de cadeias de hidrocarbonetos. As cadeias de hidrocarbonetos saturadas não ramificadas são nomeadas sistematicamente com um prefixo numérico grego denotando o número de carbonos e o sufixo "-ano".
Em 1866, August Wilhelm von Hofmann sugeriu sistematizar a nomenclatura usando toda a sequência de vogais a, e, i, o e u para criar os sufixos -ane, -ene, -ine (ou -yne), -one, -une, para os hidrocarbonetos C n H 2 n +2 , C n H 2 n , C n H 2 n −2 , C n H 2 n −4 , C n H 2 n −6 . Na nomenclatura moderna, os três primeiros nomeiam especificamente hidrocarbonetos com ligações simples, duplas e triplas; enquanto "-one" agora representa uma cetona .
Alcanos lineares
Alcanos de cadeia linear são às vezes indicados pelo prefixo "n-" ou " n- " (para "normal") onde existe um isômero não linear . Embora isso não seja estritamente necessário e não faça parte do sistema de nomenclatura IUPAC, o uso ainda é comum nos casos em que se deseja enfatizar ou distinguir entre os isômeros de cadeia linear e de cadeia ramificada, por exemplo, " n- butano " em vez de simplesmente "butano" para diferenciá-lo do isobutano . Nomes alternativos para este grupo usados na indústria do petróleo são parafinas lineares ou n -parafins .
Os primeiros seis membros da série (em termos de número de átomos de carbono) são nomeados da seguinte forma:
- metano
- CH 4 - um carbono e 4 hidrogênio
- etano
- C 2 H 6 - dois carbonos e 6 hidrogênio
- propano
- C 3 H 8 - três carbonos e 8 hidrogênio
- butano
- C 4 H 10 - quatro carbono e 10 hidrogênio
- pentano
- C 5 H 12 - cinco carbono e 12 hidrogênio
- hexano
- C 6 H 14 - seis carbonos e 14 hidrogênio
Os primeiros quatro nomes foram derivados de metanol , éter , ácido propiônico e ácido butírico . Alcanos com cinco ou mais átomos de carbono são nomeados adicionando o sufixo -ano ao prefixo multiplicador numérico apropriado com elisão de qualquer vogal terminal ( -a ou -o ) do termo numérico básico. Portanto, pentano , C 5 H 12 ; hexano , C 6 H 14 ; heptano , C 7 H 16 ; octano , C 8 H 18 ; etc. O prefixo numérico é geralmente grego, entretanto alcanos com uma contagem de átomos de carbono terminando em nove, por exemplo nonano , usam o prefixo latino não- . Para uma lista mais completa, consulte a lista de alcanos de cadeia linear .
Alcanos ramificados
Os alcanos ramificados simples frequentemente têm um nome comum usando um prefixo para distingui-los dos alcanos lineares, por exemplo n- pentano , isopentano e neopentano .
As convenções de nomenclatura IUPAC podem ser usadas para produzir um nome sistemático.
As etapas principais na nomeação de alcanos ramificados mais complicados são as seguintes:
- Identifique a cadeia contínua mais longa de átomos de carbono
- Nomeie esta cadeia raiz mais longa usando regras de nomenclatura padrão
- Nomeie cada cadeia lateral alterando o sufixo do nome do alcano de "-ano" para "-il"
- Numere a cadeia contínua mais longa para dar os números mais baixos possíveis para as cadeias laterais
- Numere e nomeie as cadeias laterais antes do nome da cadeia raiz
- Se houver várias cadeias laterais do mesmo tipo, use prefixos como "di-" e "tri-" para indicar como tal e numere cada uma.
- Adicione os nomes das cadeias laterais em ordem alfabética (desconsiderando os prefixos "di-" etc.) na frente do nome da cadeia raiz
| Nome comum | n- pentano | isopentano | neopentano |
|---|---|---|---|
| Nome IUPAC | pentano | 2-metilbutano | 2,2-dimetilpropano |
| Estrutura |  |

|
Hidrocarbonetos cíclicos saturados
Embora tecnicamente distinta dos alcanos, esta classe de hidrocarbonetos é referida por alguns como "alcanos cíclicos". Como sua descrição indica, eles contêm um ou mais anéis.
Os cicloalcanos simples têm um prefixo "ciclo-" para distingui-los dos alcanos. Cicloalcanos são nomeados de acordo com suas contrapartes acíclicas com relação ao número de átomos de carbono em seus backbones, por exemplo, ciclopentano (C 5 H 10 ) é um cicloalcano com 5 átomos de carbono assim como pentano (C 5 H 12 ), mas eles estão unidos em um anel de cinco membros. De maneira semelhante, propano e ciclopropano , butano e ciclobutano , etc.
Cicloalcanos substituídos são nomeados de forma semelhante aos alcanos substituídos - o anel cicloalcano é declarado, e os substituintes estão de acordo com sua posição no anel, com a numeração decidida pelas regras de prioridade Cahn-Ingold-Prelog .
Nomes triviais / comuns
O nome trivial (não sistemático ) para alcanos é 'parafinas'. Juntos, os alcanos são conhecidos como a 'série da parafina'. Nomes triviais para compostos são geralmente artefatos históricos. Eles foram cunhados antes do desenvolvimento de nomes sistemáticos e foram mantidos devido ao uso familiar na indústria. Cicloalcanos também são chamados de naftenos.
Alcanos de cadeia ramificada são chamados de isoparafinas . "Parafina" é um termo geral e frequentemente não distingue entre compostos puros e misturas de isômeros , ou seja, compostos da mesma fórmula química , por exemplo, pentano e isopentano .
- Na IUPAC
Os seguintes nomes triviais são mantidos no sistema IUPAC:
- isobutano para 2-metilpropano
- isopentano para 2-metilbutano
- neopentano para 2,2-dimetilpropano.
- Não-IUPAC
Alguns nomes triviais não IUPAC são usados ocasionalmente:
- cetano, por hexadecano
- cerano, para hexacosano
Propriedades físicas
Todos os alcanos são incolores. Alcanos com pesos moleculares mais baixos são gases, aqueles de peso molecular intermediário são líquidos e os mais pesados são sólidos cerosos.
Tabela de alcanos
| Alkane | Fórmula | Ponto de ebulição [° C] | Ponto de fusão [° C] | Densidade [kg / m 3 ] (a 20 ° C ) | Isômeros |
| Metano | CH 4 | -162 | -182 | 0,656 (gás) | 1 |
| Etano | C 2 H 6 | -89 | -183 | 1,26 (gás) | 1 |
| Propano | C 3 H 8 | -42 | -188 | 2,01 (gás) | 1 |
| Butano | C 4 H 10 | 0 | -138 | 2,48 (gás) | 2 |
| Pentano | C 5 H 12 | 36 | -130 | 626 (líquido) | 3 |
| Hexano | C 6 H 14 | 69 | -95 | 659 (líquido) | 5 |
| Heptano | C 7 H 16 | 98 | -91 | 684 (líquido) | 9 |
| Octano | C 8 H 18 | 126 | -57 | 703 (líquido) | 18 |
| Nonane | C 9 H 20 | 151 | -54 | 718 (líquido) | 35 |
| Decano | C 10 H 22 | 174 | -30 | 730 (líquido) | 75 |
| Undecane | C 11 H 24 | 196 | -26 | 740 (líquido) | 159 |
| Dodecane | C 12 H 26 | 216 | -10 | 749 (líquido) | 355 |
| Tridecano | C 13 H 28 | 235 | -5,4 | 756 (líquido) | 802 |
| Tetradecano | C 14 H 30 | 253 | 5,9 | 763 (líquido) | 1858 |
| Pentadecano | C 15 H 32 | 270 | 10 | 769 (líquido) | |
| Hexadecano | C 16 H 34 | 287 | 18 | 773 (líquido) | |
| Heptadecano | C 17 H 36 | 303 | 22 | 777 (sólido) | |
| Octadecano | C 18 H 38 | 317 | 28 | 781 (sólido) | |
| Nonadecane | C 19 H 40 | 330 | 32 | 785 (sólido) | |
| Icosano | C 20 H 42 | 343 | 37 | 789 (sólido) | |
| Triacontane | C 30 H 62 | 450 | 66 | 810 (sólido) | |
| Tetracontano | C 40 H 82 | 525 | 82 | 817 (sólido) | |
| Pentacontano | C 50 H 102 | 575 | 91 | 824 (sólido) | |
| Hexacontano | C 60 H 122 | 625 | 100 | 829 (sólido) | |
| Heptacontano | C 70 H 142 | 653 | 109 | 869 (sólido) |
Ponto de ebulição
Alcanos experimentam forças intermoleculares de van der Waals . Forças intermoleculares mais fortes de van der Waals dão origem a maiores pontos de ebulição dos alcanos.
Existem dois determinantes para a intensidade das forças de van der Waals:
- o número de elétrons ao redor da molécula , que aumenta com o peso molecular do alcano
- a área de superfície da molécula
Sob condições padrão , de CH 4 a C 4 H 10 alcanos são gasosos; de C 5 H 12 a C 17 H 36 são líquidos; e após C 18 H 38 eles são sólidos. Como o ponto de ebulição dos alcanos é determinado principalmente pelo peso, não deve ser surpresa que o ponto de ebulição tenha uma relação quase linear com o tamanho ( peso molecular ) da molécula. Como regra geral, o ponto de ebulição aumenta 20-30 ° C para cada carbono adicionado à cadeia; esta regra se aplica a outras séries homólogas.
Um alcano de cadeia linear terá um ponto de ebulição mais alto do que um alcano de cadeia ramificada devido à maior área de superfície em contato, portanto, às maiores forças de van der Waals, entre as moléculas adjacentes. Por exemplo, compare o isobutano (2-metilpropano) e o n-butano (butano), que fervem a -12 e 0 ° C, e 2,2-dimetilbutano e 2,3-dimetilbutano, que fervem a 50 e 58 ° C, respectivamente .
Por outro lado, os cicloalcanos tendem a ter pontos de ebulição mais altos do que suas contrapartes lineares devido às conformações bloqueadas das moléculas, que fornecem um plano de contato intermolecular.
Pontos de fusão
Os pontos de fusão dos alcanos seguem uma tendência semelhante aos pontos de ebulição pela mesma razão delineada acima. Isto é, (todas as outras coisas sendo iguais) quanto maior a molécula, maior o ponto de fusão. Há uma diferença significativa entre os pontos de ebulição e os pontos de fusão. Os sólidos têm estrutura mais rígida e fixa do que os líquidos. Essa estrutura rígida requer energia para se quebrar. Assim, as estruturas sólidas mais bem montadas exigirão mais energia para se fragmentar. Para alcanos, isso pode ser visto no gráfico acima (ou seja, a linha azul). Os alcanos ímpares têm uma tendência menor nos pontos de fusão do que os alcanos pares. Isso ocorre porque os alcanos de numeração par compactam-se bem na fase sólida, formando uma estrutura bem organizada, que requer mais energia para se fragmentar. Os alcanos ímpares empacotam menos bem e, portanto, a estrutura de empacotamento sólida organizada "mais solta" requer menos energia para se quebrar. Para uma visualização das estruturas cristalinas, consulte.
Os pontos de fusão dos alcanos de cadeia ramificada podem ser superiores ou inferiores aos dos alcanos de cadeia linear correspondentes, novamente dependendo da capacidade do alcano em questão de se compactar bem na fase sólida.
Condutividade e solubilidade
Os alcanos não conduzem eletricidade de forma alguma, nem são substancialmente polarizados por um campo elétrico . Por esse motivo, eles não formam ligações de hidrogênio e são insolúveis em solventes polares, como a água. Uma vez que as ligações de hidrogênio entre as moléculas de água individuais estão alinhadas longe de uma molécula de alcano, a coexistência de um alcano e água leva a um aumento na ordem molecular (uma redução na entropia ). Como não há ligação significativa entre as moléculas de água e as moléculas de alcano, a segunda lei da termodinâmica sugere que essa redução na entropia deve ser minimizada, minimizando o contato entre o alcano e a água: os alcanos são considerados hidrofóbicos , pois são insolúveis em água.
Sua solubilidade em solventes não polares é relativamente alta, uma propriedade chamada lipofilicidade . Os alcanos são, por exemplo, miscíveis entre si em todas as proporções.
A densidade dos alcanos geralmente aumenta com o número de átomos de carbono, mas permanece menor que a da água. Conseqüentemente, os alcanos formam a camada superior de uma mistura de alcano-água.
Geometria molecular

A estrutura molecular dos alcanos afeta diretamente suas características físicas e químicas. É derivado da configuração eletrônica do carbono , que possui quatro elétrons de valência . Os átomos de carbono em alcanos são descritos como híbridos sp 3 , ou seja, numa boa aproximação, os elétrons de valência estão em orbitais direcionados para os cantos de um tetraedro que são derivados da combinação do orbital 2s e dos três 2p orbitais. Geometricamente, o ângulo entre as ligações é cos −1 (-1/3) ≈ 109,47 °. Isso é exato para o caso do metano, enquanto os alcanos maiores contendo uma combinação de ligações C – H e C – C geralmente têm ligações que estão dentro de vários graus deste valor idealizado.
Comprimentos de união e ângulos de união
Um alcano tem apenas ligações simples C – H e C – C. O primeiro resulta da sobreposição de um orbital sp 3 de carbono com o orbital 1s de um hidrogênio; o último pela sobreposição de dois orbitais sp 3 em átomos de carbono adjacentes. Os comprimentos da ligação chegam a 1,09 × 10 −10 m para uma ligação C – H e 1,54 × 10 −10 m para uma ligação C – C.
O arranjo espacial das ligações é semelhante ao dos quatro orbitais sp 3 - eles são arranjados tetraedricamente, com um ângulo de 109,47 ° entre eles. As fórmulas estruturais que representam as ligações em ângulos retos entre si, embora sejam comuns e úteis, não representam a geometria com precisão.
Conformação
A fórmula estrutural e os ângulos de ligação geralmente não são suficientes para descrever completamente a geometria de uma molécula. Há um outro grau de liberdade para cada ligação carbono-carbono: o ângulo de torção entre os átomos ou grupos ligados aos átomos em cada extremidade da ligação. O arranjo espacial descrito pelos ângulos de torção da molécula é conhecido como sua conformação .

O etano é o caso mais simples para estudar a conformação de alcanos, pois há apenas uma ligação C – C. Se alguém olhar para baixo no eixo da ligação C – C, verá a chamada projeção de Newman . Os átomos de hidrogênio nos átomos de carbono dianteiros e traseiros têm um ângulo de 120 ° entre eles, resultante da projeção da base do tetraedro em um plano plano. No entanto, o ângulo de torção entre um dado átomo de hidrogênio ligado ao carbono frontal e um dado átomo de hidrogênio ligado ao carbono traseiro pode variar livremente entre 0 ° e 360 °. Isso é uma consequência da rotação livre em torno de uma ligação simples carbono-carbono. Apesar dessa aparente liberdade, apenas duas conformações limitantes são importantes: conformação eclipsada e conformação escalonada .
As duas conformações diferem em energia: a conformação escalonada é 12,6 kJ / mol (3,0 kcal / mol) mais baixa em energia (mais estável) do que a conformação eclipsada (a menos estável).
Essa diferença de energia entre as duas conformações, conhecida como energia de torção , é baixa em comparação com a energia térmica de uma molécula de etano à temperatura ambiente. Existe uma rotação constante em torno da ligação C – C. O tempo que leva para uma molécula de etano passar de uma conformação escalonada para a próxima, equivalente à rotação de um grupo CH 3 em 120 ° em relação ao outro, é da ordem de 10-11 segundos.
O caso dos alcanos superiores é mais complexo, mas baseado em princípios semelhantes, com a conformação antiperiplanar sempre sendo a mais favorecida em torno de cada ligação carbono-carbono. Por esse motivo, os alcanos geralmente são mostrados em zigue-zague em diagramas ou modelos. A estrutura real sempre será um pouco diferente dessas formas idealizadas, pois as diferenças de energia entre as conformações são pequenas em comparação com a energia térmica das moléculas: as moléculas de Alcano não têm forma estrutural fixa, seja o que for que os modelos possam sugerir.
Propriedades espectroscópicas
Praticamente todos os compostos orgânicos contêm ligações carbono-carbono e carbono-hidrogênio e, portanto, mostram algumas das características dos alcanos em seus espectros. Os alcanos são notáveis por não terem outros grupos e, portanto, pela ausência de outras características espectroscópicas características de um grupo funcional como –OH , –CHO , –COOH etc.
Espectroscopia infravermelha
O modo de alongamento carbono-hidrogênio fornece uma forte absorção entre 2850 e 2960 cm −1 , enquanto o modo de alongamento carbono-carbono absorve entre 800 e 1300 cm −1 . Os modos de curvatura do carbono-hidrogênio dependem da natureza do grupo: os grupos metil mostram bandas em 1450 cm −1 e 1375 cm −1 , enquanto os grupos metileno mostram bandas em 1465 cm −1 e 1450 cm −1 . As cadeias de carbono com mais de quatro átomos de carbono mostram uma absorção fraca em torno de 725 cm -1 .
Espectroscopia NMR
As ressonâncias de prótons dos alcanos são geralmente encontradas em δ H = 0,5-1,5. As ressonâncias do carbono-13 dependem do número de átomos de hidrogênio ligados ao carbono: δ C = 8–30 (primário, metil, –CH 3 ), 15–55 (secundário, metileno, –CH 2 -), 20–60 (terciário, metino, C – H) e quaternário. A ressonância do carbono-13 dos átomos de carbono quaternários é caracteristicamente fraca, devido à falta de efeito Overhauser nuclear e ao longo tempo de relaxamento , e pode ser perdida em amostras fracas ou em amostras que não foram executadas por um tempo suficientemente longo.
Espectrometria de massa
Os alcanos têm uma alta energia de ionização e o íon molecular geralmente é fraco. O padrão de fragmentação pode ser difícil de interpretar, mas, no caso de alcanos de cadeia ramificada, a cadeia de carbono é preferencialmente clivada em carbonos terciários ou quaternários devido à estabilidade relativa dos radicais livres resultantes . O fragmento resultante da perda de um único grupo metil ( M - 15) está freqüentemente ausente, e outros fragmentos são freqüentemente espaçados por intervalos de quatorze unidades de massa, correspondendo à perda sequencial de grupos CH 2 .
Propriedades quimicas
Os alcanos são fracamente reativos com a maioria dos compostos químicos. Os valores da constante de dissociação ácida (p K a ) de todos os alcanos são estimados na faixa de 50 a 70, dependendo do método de extrapolação, portanto, eles são ácidos extremamente fracos que são praticamente inertes às bases (ver: ácidos de carbono ). Eles também são bases extremamente fracas, não passando por nenhuma protonação observável em ácido sulfúrico puro ( H 0 ~ -12), embora superácidos que são pelo menos milhões de vezes mais fortes sejam conhecidos por protoná-los para dar íons de alcânio hipercoordenados (ver: íon metânio ) . Da mesma forma, eles apenas mostram reatividade com os mais fortes dos reagentes eletrofílicos (por exemplo, dioxiranos e sais contendo o cátion NF 4 + ). Em virtude de suas fortes ligações C – H (~ 100 kcal / mol) e ligações C – C (~ 90 kcal / mol, mas geralmente menos estericamente acessíveis), eles também são relativamente não reativos para os radicais livres, embora muitos radicais deficientes em elétrons irá reagir com alcanos na ausência de outras ligações ricas em elétrons (veja abaixo). Essa inércia é a fonte do termo parafinas (com o significado aqui de "falta de afinidade"). No petróleo bruto, as moléculas de alcano permaneceram quimicamente inalteradas por milhões de anos.
Os radicais livres , moléculas com elétrons desemparelhados, desempenham um grande papel na maioria das reações de alcanos, como craqueamento e reforma, onde alcanos de cadeia longa são convertidos em alcanos de cadeia mais curta e alcanos de cadeia linear em isômeros de cadeia ramificada. Além disso, as reações redox de alcanos envolvendo intermediários de radicais livres, em particular com oxigênio e halogênios, são possíveis porque os átomos de carbono estão em um estado fortemente reduzido; no caso do metano, o carbono está em seu estado de oxidação mais baixo possível (-4). A reação com oxigênio ( se presente em quantidade suficiente para satisfazer a estequiometria da reação ) leva à combustão sem qualquer fumaça, produzindo dióxido de carbono e água. Reações de halogenação de radical livre ocorrem com halogênios, levando à produção de haloalcanos . Além disso, foi demonstrado que os alcanos interagem e se ligam a certos complexos de metais de transição nas reações de ativação da ligação C – H.
Em alcanos altamente ramificados, o ângulo de ligação pode diferir significativamente do valor ideal (109,5 °) para acomodar grupos volumosos. Essas distorções introduzem uma tensão na molécula, conhecida como impedimento estérico ou tensão. A tensão aumenta substancialmente a reatividade.
No entanto, em geral e talvez surpreendentemente, quando a ramificação não é extensa o suficiente para fazer interações 1,2- e 1,3-alquil-alquil-estéricas altamente desfavoráveis (no valor de ~ 3,1 kcal / mol e ~ 3,7 kcal / mol no caso do eclipsando as conformações de butano e pentano, respectivamente) inevitáveis, os alcanos ramificados são na verdade mais termodinamicamente estáveis do que seus isômeros lineares (ou menos ramificados). Por exemplo, o 2,2,3,3-tetrametilbutano altamente ramificado é cerca de 1,9 kcal / mol mais estável do que seu isômero linear, n- octano. Devido à sutileza desse efeito, as razões exatas para essa regra foram vigorosamente debatidas na literatura química e ainda não foram esclarecidas. Várias explicações, incluindo a estabilização de alcanos ramificados por correlação de elétrons, desestabilização de alcanos lineares por repulsão estérica, estabilização por hiperconjugação neutra e / ou efeitos eletrostáticos foram avançados como possibilidades. A controvérsia está relacionada à questão de se a explicação tradicional da hiperconjugação é o principal fator que governa a estabilidade dos radicais alquil.
Reações com oxigênio (reação de combustão)
Todos os alcanos reagem com o oxigênio em uma reação de combustão , embora se tornem cada vez mais difíceis de inflamar à medida que o número de átomos de carbono aumenta. A equação geral para combustão completa é:
- C n H 2 n +2 + (3/2n + 1/2) O 2 → ( n + 1) H 2 O + n CO 2
- ou C n H 2 N 2 + (3 n + 1/2) O 2 → ( n + 1) H 2 O + n CO 2
Na ausência de oxigênio suficiente, pode-se formar monóxido de carbono ou mesmo fuligem , conforme mostrado abaixo:
Por exemplo, metano :
- 2 CH 4 + 3 O 2 → 4 H 2 O + 2 CO
- CH 4 + O 2 → 2 H 2 O + C
Consulte a tabela de calor de formação de alcano para obter dados detalhados. A mudança de entalpia padrão de combustão , Δ c H ⊖ , para alcanos aumenta em cerca de 650 kJ / mol por grupo de CH 2 . Os alcanos de cadeia ramificada têm valores mais baixos de Δ c H ⊖ do que os alcanos de cadeia linear com o mesmo número de átomos de carbono e, portanto, podem ser considerados um pouco mais estáveis.
Reações com halogênios
Os alcanos reagem com os halogênios em uma chamada reação de halogenação de radical livre . Os átomos de hidrogênio do alcano são progressivamente substituídos por átomos de halogênio. Os radicais livres são as espécies reativas que participam da reação, que geralmente leva a uma mistura de produtos. A reação é altamente exotérmica com flúor de halogênio e pode levar a uma explosão.
Essas reações são uma importante rota industrial para hidrocarbonetos halogenados. Existem três etapas:
- Iniciação, os radicais de halogênio se formam por homólise . Normalmente, é necessária energia na forma de calor ou luz.
- A reação em cadeia ou propagação ocorre então - o radical halogênio extrai um hidrogênio do alcano para dar um radical alquil. Isso reage ainda mais.
- Terminação da cadeia onde os radicais se recombinam.
Experimentos mostraram que toda halogenação produz uma mistura de todos os isômeros possíveis, indicando que todos os átomos de hidrogênio são suscetíveis à reação. A mistura produzida, entretanto, não é uma mistura estatística: os átomos de hidrogênio secundários e terciários são substituídos preferencialmente devido à maior estabilidade dos radicais livres secundários e terciários. Um exemplo pode ser visto na monobrominação de propano:
Rachaduras
O cracking divide moléculas maiores em menores. Isso pode ser feito com um método térmico ou catalítico. O processo de craqueamento térmico segue um mecanismo homolítico com formação de radicais livres . O processo de craqueamento catalítico envolve a presença de catalisadores ácidos (geralmente ácidos sólidos, como sílica-alumina e zeólitos ), que promovem uma quebra heterolítica (assimétrica) de ligações produzindo pares de íons de cargas opostas, geralmente um carbocátion e o ânion hidreto muito instável . Os radicais livres localizados no carbono e os cátions são altamente instáveis e sofrem processos de rearranjo da cadeia, cisão C – C na posição beta (ou seja, craqueamento) e transferência de hidrogênio intra e intermolecular ou transferência de hidreto . Em ambos os tipos de processos, os correspondentes intermediários reativos (radicais, íons) são regenerados permanentemente e, portanto, procedem por um mecanismo de cadeia de autopropagação. A cadeia de reações é eventualmente terminada por recombinação radical ou iônica.
Isomerização e reforma
Dragan e seu colega foram os primeiros a relatar sobre a isomerização em alcanos. Isomerização e reforma são processos nos quais alcanos de cadeia linear são aquecidos na presença de um catalisador de platina . Na isomerização, os alcanos tornam-se isômeros de cadeia ramificada. Ou seja, não perde nenhum carbono ou hidrogênio, mantendo o mesmo peso molecular. Na reforma, os alcanos tornam-se cicloalcanos ou hidrocarbonetos aromáticos , liberando hidrogênio como subproduto. Ambos os processos aumentam o número de octanas da substância. O butano é o alcano mais comum que é submetido ao processo de isomerização, pois produz muitos alcanos ramificados com alto número de octanas.
Outras reações
Os alcanos irão reagir com o vapor na presença de um catalisador de níquel para dar hidrogênio . Os alcanos podem ser clorossulfonados e nitrados , embora ambas as reações exijam condições especiais. A fermentação de alcanos em ácidos carboxílicos é de alguma importância técnica. Na reação de Reed , o dióxido de enxofre , o cloro e a luz convertem os hidrocarbonetos em cloretos de sulfonila . A abstração nucleofílica pode ser usada para separar um alcano de um metal. Os grupos alquila podem ser transferidos de um composto para outro por meio de reações de transmetalação . Uma mistura de pentafluoreto de antimônio (SbF 5 ) e ácido fluorossulfônico (HSO 3 F), chamada de ácido mágico , pode protonar alcanos.
Ocorrência
Ocorrência de alcanos no Universo
Os alcanos formam uma pequena porção da atmosfera dos planetas gasosos externos, como Júpiter (0,1% de metano, 2 ppm de etano), Saturno (0,2% de metano, 5 ppm de etano), Urano (1,99% de metano, 2,5 ppm de etano) e Netuno ( 1,5% de metano, 1,5 ppm de etano). Titã (1,6% metano), um satélite de Saturno, foi examinado pela sonda Huygens , que indicou que a atmosfera de Titã chove periodicamente metano líquido na superfície da lua. Também em Titã, a missão Cassini fez imagens de lagos sazonais de metano / etano perto das regiões polares de Titã. Metano e etano também foram detectados na cauda do cometa Hyakutake . A análise química mostrou que as abundâncias de etano e metano eram aproximadamente iguais, o que parece implicar que seus gelos se formaram no espaço interestelar, longe do Sol, o que teria evaporado essas moléculas voláteis. Alcanos também foram detectados em meteoritos , como condritos carbonáceos .
Ocorrência de alcanos na Terra
Traços de gás metano (cerca de 0,0002% ou 1745 ppb) ocorrem na atmosfera terrestre, produzidos principalmente por microorganismos metanogênicos , como Archaea no intestino de ruminantes.
As fontes comerciais mais importantes de alcanos são o gás natural e o petróleo . O gás natural contém principalmente metano e etano, com um pouco de propano e butano : o petróleo é uma mistura de alcanos líquidos e outros hidrocarbonetos . Esses hidrocarbonetos foram formados quando animais e plantas marinhos (zooplâncton e fitoplâncton) morreram e afundaram no fundo dos mares antigos e foram cobertos por sedimentos em um ambiente anóxico e convertidos ao longo de muitos milhões de anos em altas temperaturas e alta pressão à sua forma atual. O gás natural resultou assim, por exemplo, da seguinte reação:
- C 6 H 12 O 6 → 3 CH 4 + 3 CO 2
Esses depósitos de hidrocarbonetos, coletados em rochas porosas presas sob rochas impermeáveis, constituem campos de petróleo comerciais . Eles se formaram ao longo de milhões de anos e, uma vez exaustos, não podem ser facilmente substituídos. O esgotamento dessas reservas de hidrocarbonetos é a base do que se conhece como crise energética .
O metano também está presente no chamado biogás , produzido por animais e em matéria em decomposição, que é uma possível fonte de energia renovável .
Os alcanos têm baixa solubilidade em água, então o conteúdo nos oceanos é insignificante; no entanto, em altas pressões e baixas temperaturas (como no fundo dos oceanos), o metano pode co-cristalizar com água para formar um clatrato de metano sólido (hidrato de metano). Embora isso não possa ser explorado comercialmente no momento, a quantidade de energia combustível dos campos de clatrato de metano conhecidos excede o conteúdo de energia de todos os depósitos de gás natural e petróleo juntos. O metano extraído do clatrato de metano é, portanto, um candidato para futuros combustíveis.
Ocorrência biológica
Os alcanos acíclicos ocorrem na natureza de várias maneiras.
- Bactérias e arquéias

Certos tipos de bactérias podem metabolizar alcanos: elas preferem cadeias de carbono com números pares, pois são mais fáceis de degradar do que as cadeias com números ímpares.
Por outro lado, certas arquéias , os metanógenos , produzem grandes quantidades de metano pelo metabolismo do dióxido de carbono ou de outros compostos orgânicos oxidados . A energia é liberada pela oxidação do hidrogênio :
- CO 2 + 4 H 2 → CH 4 + 2 H 2 O
Os metanógenos também são produtores de gás do pântano em áreas úmidas . A produção de metano do gado e de outros herbívoros , que podem liberar de 30 a 50 galões por dia, e dos cupins , também se deve aos metanógenos. Eles também produzem o mais simples de todos os alcanos no intestino dos humanos. As arquéias metanogênicas estão, portanto, no final do ciclo do carbono , com o carbono sendo liberado de volta para a atmosfera após ter sido fixado pela fotossíntese . É provável que nossos depósitos atuais de gás natural tenham se formado de maneira semelhante.
- Fungos e plantas
Os alcanos também desempenham um papel, embora secundário, na biologia dos três grupos eucarióticos de organismos: fungos , plantas e animais. Algumas leveduras especializadas, por exemplo, Candida tropicale , Pichia sp., Rhodotorula sp., Podem usar alcanos como fonte de carbono ou energia. O fungo Amorphotheca resinae prefere os alcanos de cadeia mais longa em combustível de aviação e pode causar sérios problemas para aeronaves em regiões tropicais.
Nas plantas, os alcanos sólidos de cadeia longa são encontrados na cutícula da planta e na cera epicuticular de muitas espécies, mas apenas raramente são constituintes principais. Eles protegem a planta contra a perda de água, evitam a lixiviação de minerais importantes pela chuva e protegem contra bactérias, fungos e insetos nocivos. As cadeias de carbono em alcanos vegetais são geralmente ímpares, entre 27 e 33 átomos de carbono de comprimento e são feitas pelas plantas por descarboxilação de ácidos graxos de números pares . A composição exata da camada de cera não depende apenas da espécie, mas também muda com a estação e fatores ambientais como condições de iluminação, temperatura ou umidade.
Alcanos de cadeia curta mais voláteis também são produzidos e encontrados em tecidos vegetais. O pinheiro Jeffrey é conhecido por produzir níveis excepcionalmente altos de n - heptano em sua resina, razão pela qual seu destilado foi designado como o ponto zero para uma classificação de octanagem . Há muito se sabe que os aromas florais contêm componentes alcanos voláteis, e o n - nonano é um componente significativo no perfume de algumas rosas . A emissão de alcanos gasosos e voláteis como etano , pentano e hexano pelas plantas também foi documentada em níveis baixos, embora eles geralmente não sejam considerados um dos principais componentes da poluição atmosférica biogênica.
Os óleos vegetais comestíveis também contêm normalmente pequenas frações de alcanos biogênicos com um amplo espectro de números de carbono, principalmente de 8 a 35, geralmente com pico na faixa dos 20 anos, com concentrações de até dezenas de miligramas por quilograma (partes por milhão por peso) e às vezes mais de cem para a fração de alcano total.
- Animais
Os alcanos são encontrados em produtos de origem animal, embora sejam menos importantes do que os hidrocarbonetos insaturados. Um exemplo é o óleo de fígado de tubarão, que é aproximadamente 14% pristano (2,6,10,14-tetrametilpentadecano, C 19 H 40 ). Eles são importantes como feromônios , materiais mensageiros químicos, dos quais os insetos dependem para se comunicar. Em algumas espécies, por exemplo, o escaravelho de suporte Xylotrechus colonus , pentacosano (C 25 H 52 ), 3-metilpentaicosano (C 26 H 54 ) e 9-metilpentaicosano (C 26 H 54 ) são transferidos por contato corporal. Com outros como a mosca tsé - tsé Glossina morsitans morsitans , o feromônio contém os quatro alcanos 2-metilheptadecano (C 18 H 38 ), 17,21-dimetilheptatriacontano (C 39 H 80 ), 15,19-dimetilheptatriacontano (C 39 H 80 ) e 15,19,23-trimetilheptatriacontano (C 40 H 82 ), e atua pelo olfato em distâncias mais longas. As abelhas melíferas que dançam produzem e liberam dois alcanos, tricosano e pentacosano.
Relações ecológicas

Um exemplo, no qual os alcanos vegetais e animais desempenham um papel, é a relação ecológica entre a abelha da areia ( Andrena nigroaenea ) e a orquídea aranha primitiva ( Ophrys sphegodes ); o último depende para a polinização do primeiro. As abelhas da areia usam feromônios para identificar um parceiro; no caso de A. nigroaenea , as fêmeas emitem uma mistura de tricosano (C 23 H 48 ), pentacosano (C 25 H 52 ) e heptacosano (C 27 H 56 ) na proporção de 3: 3: 1, e os machos são atraídos especificamente por este odor. A orquídea aproveita esse arranjo de acasalamento para fazer com que a abelha macho colete e dissemine seu pólen; partes de sua flor não apenas se assemelham à aparência de abelhas da areia, mas também produzem grandes quantidades dos três alcanos na mesma proporção que as abelhas da areia fêmeas. Como resultado, numerosos machos são atraídos para as flores e tentam copular com seu parceiro imaginário: embora esse esforço não seja coroado de sucesso para a abelha, permite que a orquídea transfira seu pólen, que será disperso após a partida da homem frustrado para outras flores.
Produção
refinamento de petróleo
Como afirmado anteriormente, a fonte mais importante de alcanos é o gás natural e o petróleo bruto . Os alcanos são separados em uma refinaria de petróleo por destilação fracionada e processados em muitos produtos.
Fischer – Tropsch
O processo Fischer-Tropsch é um método para sintetizar hidrocarbonetos líquidos, incluindo alcanos, a partir de monóxido de carbono e hidrogênio. Este método é usado para produzir substitutos para destilados de petróleo .
Preparação de laboratório
Geralmente, há pouca necessidade de alcanos serem sintetizados em laboratório, uma vez que geralmente estão disponíveis comercialmente. Além disso, os alcanos geralmente não reagem química ou biologicamente e não sofrem interconversões de grupos funcionais de forma limpa. Quando os alcanos são produzidos em laboratório, geralmente são um subproduto de uma reação. Por exemplo, o uso de n- butil-lítio como base forte dá o ácido conjugado, n- butano como produto secundário:
- C 4 H 9 Li + H 2 O → C 4 H 10 + LiOH
No entanto, às vezes pode ser desejável fazer uma seção de uma molécula em uma funcionalidade semelhante a alcano ( grupo alquil ) usando os métodos anteriores ou semelhantes. Por exemplo, um grupo etil é um grupo alquil; quando este está ligado a um grupo hidroxilo , dá etanol , que não é um alcano. Para fazer isso, os métodos mais conhecidos são a hidrogenação de alquenos :
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alquil )
Alcanos ou grupos alquil também podem ser preparados diretamente a partir de halogenetos de alquil na reação de Corey-House-Posner-Whitesides . A desoxigenação Barton-McCombie remove grupos hidroxila de álcoois, por exemplo
e a redução de Clemmensen remove grupos carbonil de aldeídos e cetonas para formar alcanos ou compostos substituídos por alquil, por exemplo:
Preparação de alcanos de outros compostos orgânicos
Os alcanos podem ser preparados a partir de uma variedade de compostos orgânicos. Estes incluem alcenos, alcinos, haloalcanos, álcoois, aldeídos e cetonas e ácidos carboxílicos.
De alcenos e alcinos
Quando alcenos e alcinos são submetidos à reação de hidrogenação, tratando-os com hidrogênio na presença de paládio ou catalisador de platina ou níquel, eles produzem alcanos. Nesta reação, o catalisador em pó é preferido para aumentar a área de superfície de modo que a adsorção de hidrogênio no catalisador aumente. Nesta reação, o hidrogênio se liga ao catalisador para formar uma ligação hidrogênio-catalisador que leva ao enfraquecimento da ligação HH, levando à adição de hidrogênio em alcenos e alcinos. A reação é exotérmica porque o produto alcano é estável, pois tem mais ligações sigma do que os alquenos e alcinos reagentes devido à conversão da ligação pi em ligações sigma.
De haloalcanos
Os alcanos podem ser produzidos a partir de haloalcanos usando diferentes métodos.
Reação de Wurtz
Quando haloalcano é tratado com sódio em éter seco, alcano com o dobro do número de átomos de carbono é obtido. Esta reação prossegue através do intermediário de radical livre e tem possibilidade de formação de alceno no caso de haloalcanos terciários e dihaletos vicinais.
2 R − X + 2 Na → R − R + 2 Na + X. (Na presença de éter seco
Corey-House-Synthesis
Quando o haloalcano é tratado com dialquil-lítio cuprite, que também é conhecido como reagente de Gilman, qualquer alcano superior é obtido.
Li + [R – Cu – R] - + R'– X → R – R '+ "RCu" + Li + X
Reação com hidreto metálico
Quando os haloalcanos são tratados com hidreto de metal, por exemplo, hidreto de sódio e hidreto de alumínio e lítio.
Reação de Frankland
Quando haloalcano é tratado com zinco em éster, alcano é obtido.
Reação de Fittig
Quando o halogeneto de arila é tratado com sódio em éter seco, ele forma bifenila.
Síntese de biaril Ullmann
Quando o haleto de arila é tratado com cobre, ele forma bifenila.
Reação de Wurtz-Fittig
Quando o haleto de arila é tratado com haloalcano, obtemos alquilbenzeno.
Formulários
As aplicações de alcanos dependem do número de átomos de carbono. Os primeiros quatro alcanos são usados principalmente para fins de aquecimento e cozimento e, em alguns países, para geração de eletricidade. Metano e etano são os principais componentes do gás natural; normalmente são armazenados como gases sob pressão. No entanto, é mais fácil transportá-los como líquidos: isso requer compressão e resfriamento do gás.
Propano e butano são gases à pressão atmosférica que podem ser liquefeitos a pressões bastante baixas e são comumente conhecidos como gás de petróleo liquefeito (GLP). O propano é usado em queimadores de gás propano e como combustível para veículos rodoviários, o butano em aquecedores de ambiente e isqueiros descartáveis. Ambos são usados como propelentes em sprays de aerossol .
Do pentano ao octano, os alcanos são líquidos altamente voláteis. São utilizados como combustíveis em motores de combustão interna , pois vaporizam facilmente ao entrar na câmara de combustão sem formar gotas, o que prejudicaria a uniformidade da combustão. Os alcanos de cadeia ramificada são preferidos porque são muito menos propensos a ignição prematura, que causa knocking , do que seus homólogos de cadeia linear. Essa propensão à ignição prematura é medida pela octanagem do combustível, em que 2,2,4-trimetilpentano ( isooctano ) tem um valor arbitrário de 100 e o heptano tem um valor zero. Além de seu uso como combustíveis, os alcanos médios também são bons solventes para substâncias não polares.
Alcanos de nonano a, por exemplo, hexadecano (um alcano com dezesseis átomos de carbono) são líquidos de maior viscosidade , cada vez menos adequados para uso em gasolina. Em vez disso, eles formam a maior parte do diesel e do combustível de aviação . Os combustíveis diesel são caracterizados pelo seu número de cetano, sendo cetano um nome antigo para hexadecano. No entanto, os pontos de fusão mais altos desses alcanos podem causar problemas em baixas temperaturas e em regiões polares, onde o combustível se torna muito espesso para fluir corretamente.
Os alcanos, do hexadecano para cima, formam os componentes mais importantes do óleo combustível e do óleo lubrificante . Nesta última função, atuam ao mesmo tempo como agentes anticorrosivos, pois sua natureza hidrofóbica impede que a água atinja a superfície do metal. Muitos alcanos sólidos são usados como cera de parafina , por exemplo, em velas . No entanto, isso não deve ser confundido com a cera verdadeira , que consiste principalmente de ésteres .
Alcanos com um comprimento de cadeia de aproximadamente 35 ou mais átomos de carbono são encontrados no betume , usado, por exemplo, no revestimento de estradas. No entanto, os alcanos superiores têm pouco valor e geralmente são divididos em alcanos inferiores por craqueamento .
Alguns polímeros sintéticos , como polietileno e polipropileno, são alcanos com cadeias contendo centenas ou milhares de átomos de carbono. Esses materiais são usados em inúmeras aplicações, e bilhões de quilogramas desses materiais são feitos e usados a cada ano.
Transformações ambientais
Os alcanos são moléculas apolares quimicamente muito inertes que não são muito reativas como compostos orgânicos. Essa inércia gera sérios problemas ecológicos se eles forem liberados no meio ambiente. Devido à falta de grupos funcionais e baixa solubilidade em água, os alcanos apresentam baixa biodisponibilidade para microrganismos.
Existem, no entanto, alguns microrganismos que possuem a capacidade metabólica de utilizar n- alcanos como fontes de carbono e de energia. Algumas espécies de bactérias são altamente especializadas em degradar alcanos; estes são referidos como bactérias hidrocarbonoclásticas.
Perigos
O metano é inflamável, explosivo e perigoso de inalar; por ser um gás incolor e inodoro, deve-se ter cuidado especial com o metano. O etano também é extremamente inflamável, explosivo e perigoso de inalar. Ambos podem causar asfixia. O propano também é inflamável e explosivo e pode causar sonolência ou inconsciência se inalado. O butano apresenta os mesmos perigos do propano.
Alcanos também representam uma ameaça ao meio ambiente. Os alcanos ramificados têm uma biodegradabilidade mais baixa do que os alcanos não ramificados. O metano é considerado o gás de efeito estufa mais perigoso para o meio ambiente, embora a quantidade de metano na atmosfera seja relativamente baixa.