Molécula não Kekulé - Non-Kekulé molecule
Uma molécula não Kekulé é um hidrocarboneto conjugado que não pode ser atribuído a uma estrutura Kekulé clássica .
Como as moléculas não-Kekulé têm dois ou mais centros radicais de cargas formais , suas interações spin-spin podem causar condutividade elétrica ou ferromagnetismo ( ímãs baseados em moléculas ) e aplicações em materiais funcionais são esperadas. No entanto, como essas moléculas são bastante reativas e a maioria delas é facilmente decomposta ou polimerizada à temperatura ambiente, estratégias de estabilização são necessárias para seu uso prático. A síntese e observação dessas moléculas reativas são geralmente realizadas por métodos de isolamento de matriz .
Biradicais
As moléculas não Kekulé mais simples são as bi-radicais . Um biradical é um composto químico de elétrons pares com dois centros de radicais livres que agem independentemente um do outro. Eles não devem ser confundidos com a classe mais geral de diradicais .
Uma das primeiras bi-radicais foi sintetizado por Wilhelm Schlenk em 1915, seguindo a mesma metodologia como Moses Gomberg do radical trifenilmetilo . Os chamados hidrocarbonetos Schlenk-Brauns são:
Eugene Müller, com o auxílio de uma balança de Gouy , estabeleceu pela primeira vez que esses compostos são paramagnéticos com um estado fundamental tripleto .
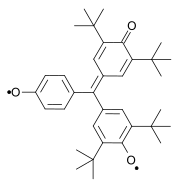
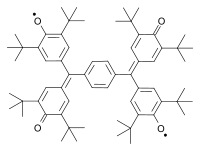
Outro biradical clássico foi sintetizado por Aleksei Chichibabin em 1907. Outros exemplos clássicos são os biradicais descritos por Yang em 1960 e por Coppinger em 1962.

|
 |
|
||
| Tschitschibabin biradical (1907) | Yang biradical (1960) | Coppinger bi-radical 1962 |
Trimetilenometano
Um biradical bem estudado é o trimetilenometano (TMM), C
4 H
6 . Em 1966, Paul Dowd determinou com ressonância de spin de elétrons que este composto também tem um estado tripleto . Em um hospedeiro cristalino, os 6 átomos de hidrogênio em TMM são idênticos.
Quinodimetanos e PAHs
Outros exemplos de moléculas não Kekulé são os quinodimetanos biradicalóides, que possuem um anel de seis membros com substituintes de metileno.
Os hidrocarbonetos aromáticos polinucleares não Kekulé são compostos de vários anéis fundidos de seis membros. O membro mais simples dessa classe é o trianguleno . Após tentativas malsucedidas de Erich Clar em 1953, o trioxitrianguleno foi sintetizado por Richard J. Bushby em 1995 e o trianguleno estabilizado cineticamente por Kazuhiro Nakasuji em 2001. No entanto, em 2017, um projeto liderado por David Fox e Anish Mistry da Universidade de Warwick em colaboração com trianguleno sintetizado e com imagem da IBM . Em 2019, homólogos maiores de trianguleno, consistindo em dez ([4] trianguleno) e quinze anéis fundidos de seis membros ([5] trianguleno) foram sintetizados em 2019. Mais recentemente, em 2021, a síntese do até então maior homólogo de trianguleno, consistindo de vinte e oito anéis fundidos de seis membros ([7trianguleno]). Uma classe relacionada de bi - radicais são para-benzinos .
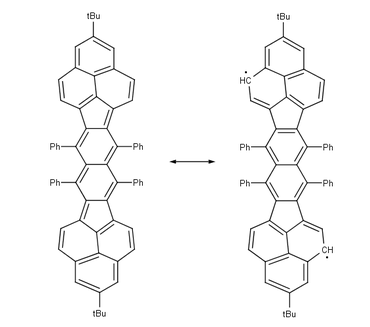
Outros bi-radicais estudados são aqueles baseados em pleiadeno , viologenos prolongados , corannulenes , nitronil-nitróxido , bis (fenalenilo) s e teranthenes .

|
|
|
| Teranthene biradical Singlet. máx. 3 sextetos clar de estabilização , rt estável, ar. 50% bi-radical, seção molecular de grafeno | Bisfenalenil biradical Singlet. máx. 6 Clar sextets estabilizadores, rt estável, ar. 42% biradical |
O pleiadeno foi sintetizado a partir de acenaftileno e ácido antranílico / nitrito de amila :

|
| Geração e dimerização de pleiadeno |
Oxialil
O oxialil diradical (OXA) é uma molécula de trimetilenometano com um grupo metileno substituído por oxigênio . Este intermediário reativo é postulado para ocorrer na abertura do anel de ciclopropanonas , óxidos de aleno e no rearranjo de Favorskii . O intermediário foi produzido pela reação de ânions radicais de oxigênio com acetona e estudado por espectroscopia de fotoelétrons . A afinidade eletrônica experimental do OXA é de 1,94 eV.
Classificação
As moléculas não Kekulé com dois centros radicais formais (diradicais não Kekulé) podem ser classificadas em não disjuntas e disjuntas pela forma de seus dois orbitais moleculares não ligados (NBMOs).
Ambos os NBMOs de moléculas com características não disjuntas , como trimetilenometano, têm densidade de elétrons no mesmo átomo . De acordo com a regra de Hund , cada orbital é preenchido com um elétron com spin paralelo, evitando a repulsão de Coulomb ao preencher um orbital com dois elétrons. Portanto, espera-se que tais moléculas com NBMOs não disjuntos prefiram um estado fundamental tripleto .
Em contraste, os NBMOs das moléculas com características disjuntas , como tetrametilenotano, podem ser descritos sem ter densidade de elétrons no mesmo átomo. Com tais MOs, o fator de desestabilização pela repulsão de Coulomb torna-se muito menor do que com moléculas do tipo não disjuntas e, portanto, a estabilidade relativa do estado fundamental singleto para o estado fundamental tripleto será quase igual, ou mesmo revertido por causa da interação de troca .
Referências
- ^ Definições do livro IUPAC Gold de biradical e diradicals
- ^ Robert A. Moss ed. (2004), "Reactive Intermediate Chemistry" (Livro) Wiley-Interscience. ISBN 0-471-23324-2
- ^ Tschitschibabin, AE (1907). "Über einige phenylierte Derivate des p, p-Ditolyls" . Berichte der Deutschen Chemischen Gesellschaft . 40 (2): 1810–1819. doi : 10.1002 / cber.19070400282 .
- ^ Montgomery, Lawrence K .; Huffman, John C .; Jurczak, Edward A .; Grendze Jr, Martin P. (1986). "As estruturas moleculares dos hidrocarbonetos de Thiele e Chichibabin". Journal of the American Chemical Society . 108 (19): 6004–6011. doi : 10.1021 / ja00279a056 . PMID 22175364 .
- ^ Yang, NC; Castro, AJ (1960). "Synthesis of a stable biradical" n P. Grendze Jr. (1986), "The molecular structure of Thiele's and Chichibabin's hydrocarbonbons". Journal of the American Chemical Society . 82 (23): 6208. doi : 10.1021 / ja01508a067 .
- ^ Coppinger, GM (1962). "Um radical fenoxi estável inerte ao oxigênio". Tetraedro . 18 (1): 61–65. doi : 10.1016 / 0040-4020 (62) 80024-6 .
- ^ Coppinger, GM (1964). "Reações de inibição de fenóis impedidos". Journal of the American Chemical Society . 86 (20): 4385–4388. doi : 10.1021 / ja01074a032 .
- ^ M. Baumgarten (2003/2004), "High spin moléculas dirigidas a ímãs moleculares", capítulo 12 em "EPR de radicais livres em sólidos, Tendências em métodos e aplicação", A. Lund, M. Shiotani (eds), Kluwer , páginas 491-528
- ^ Pavliček, Niko; Mistry, Anish; Majzik, Zsolt; Moll, Nikolaj; Meyer, Gerhard; Fox, David J .; Gross, Leo (13/02/2017). "Síntese e caracterização do trianguleno" (PDF) . Nature Nanotechnology . publicação online antecipada (4): 308–311. Bibcode : 2017NatNa..12..308P . doi : 10.1038 / nnano.2016.305 . ISSN 1748-3395 . PMID 28192389 .
- ^ Mishra, Shantanu; Beyer, Doreen; Eimre, Kristjan; Liu, Junzhi; Berger, Reinhard; Gröning, Oliver; Pignedoli, Carlo A .; Müllen, Klaus; Fasel, romano; Feng, Xinliang; Ruffieux, Pascal (10/07/2019). "Síntese e Caracterização do Trianguleno π-Estendido" . Journal of the American Chemical Society . 141 (27): 10621–10625. doi : 10.1021 / jacs.9b05319 . ISSN 0002-7863 . PMID 31241927 .
- ^ Su, Jie; Telychko, Mykola; Hu, Pan; Macam, Gennevieve; Mutombo, Pingo; Zhang, Hejian; Bao, Yang; Cheng, Fang; Huang, Zhi-Quan; Qiu, Zhizhan; Tan, Sherman JR (01/07/2019). "Síntese de baixo para cima atômica precisa de trianguleno estendido com π [5]" . Science Advances . 5 (7): eaav7717. doi : 10.1126 / sciadv.aav7717 . ISSN 2375-2548 . PMC 6660211 . PMID 31360763 .
- ^ Mishra, Shantanu; Xu, Kun; Eimre, Kristjan; Komber, Hartmut; Ma, Ji; Pignedoli, Carlo; Fasel, romano; Feng, Xinliang; Ruffieux, Pascal (2021-01-07). "Síntese e caracterização de [7] triangulene" . Nanoscale . Manuscrito aceito (3): 1624–1628. doi : 10.1039 / D0NR08181G . PMID 33443270 .
- ^ Kolc, Jaroslav; Michl, Josef (1973). "Hidrocarbonetos π, π-Biradicaloid. Família Pleiadene. I. Preparação fotoquímica de precursores de ciclobuteno". Journal of the American Chemical Society . 95 (22): 7391–7401. doi : 10.1021 / ja00803a030 .
- ^ William, W. Porter III; Vaid, Thomas P .; Rheingold, Arnold L. (2005). "Síntese e caracterização de um" viologen estendido "neutro altamente redutor e do hidrocarboneto isoestrutural 4,4 '' '' - di-n-octil-p-quaterfenil". Journal of the American Chemical Society . 127 (47): 16559–16566. doi : 10.1021 / ja053084q . PMID 16305245 .
- ^ Casado, J .; Patchkovskii, S .; Zgierski, M .; Hermosilla, L .; Sieiro, C .; Oliva, M. Moreno; Navarrete, J. López (2008). "Detecção Raman de biradicais conjugados" ambíguos: Cruzamento intersistema de singleto a tripleto térmico rápido em um viologen estendido ". Angewandte Chemie International Edition . 47 (8): 1443–1446. doi : 10.1002 / anie.200704398 . PMID 18200638 .
- ^ Ueda, A .; Nishida, S .; Fukui, K .; Eu coloco.; Shiomi, D .; Sato, K .; Takui, T .; Nakasuji, K .; Morita, Y. (2010). "Interação tridimensional de troca intramolecular em um sistema π-conjugado curvo e não alternativo: Coranuleno com dois radicais fenoxila". Angewandte Chemie International Edition . 49 (9): 1678–1682. doi : 10.1002 / anie.200906666 . PMID 20108294 .
- ^ Ziessel Christophe Stroh, Raymond; Heise, Henrike; Köhler, Frank H .; Turek, Philippe; Claiser, Nicolas; Souhassou, Mohamed; Lecomte, Claude (2004). "Fortes interações de troca entre dois radicais ligados a espaçadores não aromáticos deduzidos de medições magnéticas, EPR, NMR e de densidade eletrônica". Geléia. Chem. Soc . 126 (39): 12604–12613. doi : 10.1021 / ja0305959 . PMID 15453793 .
- ^ Kubo, Takashi; Shimizu, Akihiro; Uruichi, Mikio; Yakushi, Kyuya; Nakano, Masayoshi; Shiomi, Daisuke; Sato, Kazunobu; Takui, Takeji; Morita, Yasushi; Nakasuji, Kazuhiro (2007). "Singlet biradical character of fenalenyl-based kekulé hydrocarbon with naphthoquinoid structure". Org. Lett . 9 (1): 81–84. doi : 10.1021 / ol062604z . PMID 17192090 .
- ^ Konishi, Akihito; Hirao, Yasukazu; Nakano, Masayoshi; Shimizu, Akihiro; Botek, Edith; Champagne, Benot; Shiomi, Daisuke; Sato, Kazunobu; Takui, Takeji; Matsumoto, Kouzou; Kurata, Hiroyuki; Kubo, Takashi (2010). "Síntese e caracterização de teranteno: Um hidrocarboneto aromático policíclico biradical singleto com estruturas de Kekulé". Journal of the American Chemical Society . 132 (32): 11021-11023. doi : 10.1021 / ja1049737 . PMID 20698663 .
- ^ Lamberto, C (2011). "Em direção a hidrocarbonetos aromáticos policíclicos com um estado fundamental de concha aberta singleto". Angewandte Chemie International Edition . 50 (8): 1756–1758. doi : 10.1002 / anie.201006705 . PMID 21284072 .
- ^ Ichino, Takatoshi; Villano, Stephanie M .; Gianola, Adam J .; Goebbert, Daniel J .; Velarde, Luis; Sanov, Andrei; Blanksby, Stephen J .; Zhou, Xin; Hrovat, David A .; Thatcher Borden, Weston; Lineberger, W. Carl (2009). "Os estados singleto e tripleto mais baixos do diradical oxialil" (PDF) . Angewandte Chemie International Edition . 48 (45): 8509–8511. doi : 10.1002 / anie.200904417 . PMID 19739188 .



