Vemurafenib - Vemurafenib
 | |
 | |
| Dados clínicos | |
|---|---|
| Pronúncia | / ˌ v ɛ m ə r ul f ə n ɪ b / VEM -ə- RAF -ə-nib |
| Nomes comerciais | Zelboraf |
| Outros nomes | PLX4032, RG7204, RO5185426 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a612009 |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Por via oral ( comprimidos ) |
| Código ATC | |
| Status legal | |
| Status legal | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Ligante PDB | |
| Painel CompTox ( EPA ) | |
| Dados químicos e físicos | |
| Fórmula | C 23 H 18 Cl F 2 N 3 O 3 S |
| Massa molar | 489,92 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| (verificar) | |
| vemurafenib | |
|---|---|
| Mecanismo de drogas | |
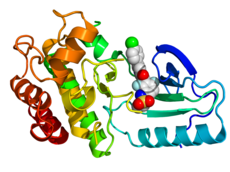
Estrutura cristalográfica de B-Raf (colorido do arco-íris, terminal N = azul, terminal C = vermelho) complexado com vemurafenib (esferas, carbono = branco, oxigênio = vermelho, nitrogênio = azul, cloro = verde, flúor = ciano, enxofre = amarelo).
| |
| Uso Terapêutico | melanoma |
| Alvo biológico | BRAF |
| Mecanismo de ação | inibidor de proteína quinase |
| links externos | |
| Código ATC | L01 XE15 |
| ID de ligante PDB | 032: PDBe , RCSB PDB |
| LIGPLOT | 3og7 |
O Vemurafenibe ( INN , comercializado como Zelboraf ) é um inibidor da enzima B-Raf desenvolvida pela Plexxikon (agora parte da Daiichi-Sankyo) e pela Genentech para o tratamento do melanoma em estágio avançado . O nome "vemurafenib" vem de V 600 E mu tated B RAF em h ib ition.
Aprovações
O Vemurafenibe recebeu a aprovação da FDA para o tratamento do melanoma em estágio avançado em 17 de agosto de 2011, tornando-se o primeiro medicamento desenvolvido usando a descoberta de chumbo baseada em fragmentos para obter aprovação regulatória.
Posteriormente, o Vemurafenibe recebeu a aprovação da Health Canada em 15 de fevereiro de 2012.
Em 20 de fevereiro de 2012, a Comissão Europeia aprovou vemurafenib como uma monoterapia para o tratamento de pacientes adultos com mutação BRAF V600E positiva irressecável ou melanoma metastático , a forma mais agressiva de câncer de pele.
Em 6 de novembro de 2017, o FDA aprovou o Vemurafenibe para o tratamento de alguns pacientes com doença de Erdheim-Chester (ECD), um tipo raro de neoplasia histiocítica.
Mecanismo de ação
O Vemurafenib causa morte celular programada em linhas celulares de melanoma . Vemurafenibe interrompe o passo B-Raf / MEK na via de B-Raf / MEK / ERK - se a B-Raf tem a mutao V600E comum.
Vemurafenibe só funciona em pacientes com melanoma cujo câncer tem uma mutação V600E BRAF (ou seja, na posição do aminoácido 600 na proteína B-Raf, a valina normal é substituída por ácido glutâmico ). Cerca de 60% dos melanomas apresentam essa mutação. Também tem eficácia contra a mutação BRAF V600K, mais rara. As células de melanoma sem essas mutações não são inibidas por vemurafenib; a droga, paradoxalmente, estimula o BRAF normal e pode promover o crescimento do tumor em tais casos.
Resistência
Três mecanismos de resistência ao vemurafenib (cobrindo 40% dos casos) foram descobertos:
- As células cancerosas começam a superexpressar a proteína PDGFRB da superfície celular , criando uma via alternativa de sobrevivência.
- Um segundo oncogene chamado NRAS sofre mutação, reativando a via de sobrevivência normal do BRAF.
- Secreção de células estromais de fator de crescimento de hepatócitos (HGF).
Testes clínicos
Em um estudo clínico de fase I , vemurafenib (então conhecido como PLX4032) foi capaz de reduzir o número de células cancerosas em mais da metade de um grupo de 16 pacientes com melanoma avançado. O grupo tratado teve um aumento médio do tempo de sobrevida de 6 meses em relação ao grupo controle.
Um segundo estudo de fase I, em pacientes com uma mutação V600E em B-Raf, ~ 80% mostrou regressão parcial a completa. A regressão durou de 2 a 18 meses.
No início de 2010, um estudo de Fase I para tumores sólidos (incluindo câncer colorretal ) e um estudo de fase II (para melanoma metastático) estavam em andamento.
Um ensaio clínico de fase III (vs dacarbazina ) em pacientes com melanoma metastático não tratado previamente mostrou uma melhora nas taxas de sobrevida geral e livre de progressão.
Em junho de 2011, foram relatados resultados positivos do estudo de melanoma com mutação BRIM3 BRAF de fase III. O ensaio BRIM3 relatou bons resultados atualizados em 2012.
Outros ensaios estão planejados, incluindo um ensaio de vemurafenibe coadministrado com GDC-0973 ( cobimetinibe ), um inibidor de MEK . Após bons resultados em 2014, a combinação foi submetida à CE e FDA para aprovação de comercialização.
Em janeiro de 2015, os resultados do ensaio compararam o vemurafenib com a combinação de dabrafenib e trametinib para o melanoma metastático.
Efeitos colaterais
Na dose máxima tolerada (MTD) de 960 mg duas vezes ao dia, 31% dos pacientes apresentam lesões cutâneas que podem necessitar de remoção cirúrgica. O estudo BRIM-2 investigou 132 pacientes; os eventos adversos mais comuns foram artralgia em 58% dos pacientes, erupção cutânea em 52% e fotossensibilidade em 52%. A fim de controlar melhor os efeitos colaterais, alguma forma de modificação da dose foi necessária em 45% dos pacientes. A dose média diária foi de 1750 mg, 91% da MTD.
Um ensaio que combinava vemurafenib e ipilimumab foi interrompido em abril de 2013 devido a sinais de toxicidade hepática .
Referências
Leitura adicional
- Dean L (2017). "Terapia com Vemurafenibe e Genótipo BRAF e NRAS" . Em Pratt VM, McLeod HL, Rubinstein WS, et al. (eds.). Resumos de genética médica . Centro Nacional de Informações sobre Biotecnologia (NCBI). PMID 28809522 . ID da estante: NBK447416.
links externos
- "Vemurafenib" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
