Complexos de aminoácidos de metal de transição - Transition metal amino acid complexes
Os complexos de aminoácidos de metais de transição são uma grande família de complexos de coordenação contendo as bases conjugadas dos aminoácidos , os 2-aminocarboxilatos. Os aminoácidos são predominantes na natureza e todos eles funcionam como ligantes para os metais de transição. Não estão incluídos neste artigo complexos de amidas (incluindo peptídeo) e derivados de éster de aminoácidos. Também excluídos estão os poliaminoácidos, incluindo os agentes quelantes EDTA e NTA .
Modos de ligação
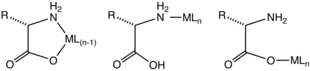
Mais comumente, os aminoácidos se coordenam aos íons metálicos como ligantes bidentados N, O, utilizando o grupo amino e o carboxilato. Eles são ligantes "LX". Um anel quelato de cinco membros é formado. O anel de quelato é apenas ligeiramente enrugada em sua sp 3 centros de carbono e azoto com hibridação.
Para aqueles aminoácidos contendo substituintes de coordenação, os complexos resultantes são estruturalmente mais diversos, uma vez que esses substituintes podem coordenar. Histidina , ácido aspártico , metionina e cisteína às vezes formam complexos tridentados N, N, O, N, O, O, S, N, O e S, N, O, respectivamente.
Usando íons de metal cineticamente inertes, complexos contendo aminoácidos monodentados foram caracterizados. Esses complexos existem nos isômeros de ligação N ou O. Pode-se presumir que tais complexos monodentados existem transitoriamente para muitos íons metálicos cineticamente lábeis (por exemplo, Zn 2+ ).
Estequiometria e estrutura
Complexos homolépticos (apenas ligantes de aminoácidos)
A mistura de sais de metal simples com soluções de aminoácidos perto de pH neutro ou elevado geralmente resulta em complexos bis- ou tris. Para íons metálicos que preferem coordenação octaédrica, esses complexos costumam adotar a estequiometria M (aa) 3 (aa = amino carboxilato, como glicinato, H 2 NCH 2 CO 2 - ).
Os complexos da estequiometria 3: 1 têm a fórmula é [M (O 2 CC (R) HNH 2 ) 3 ] z . Esses complexos adotam geometria de coordenação octaédrica . Esses complexos podem existir em isômeros faciais e meridionais, ambos quirais. As possibilidades estereoquímicas aumentam quando os ligantes de aminoácidos não são homoquirais .
Complexos com a estequiometria 2: 1 são ilustrados por glicinato de cobre (II) [Cu (O 2 CC (R) HNH 2 ) 2 ], que existe tanto na geometria anidra quanto na pentacoordenada. Quando o metal é quadrado plano, esses complexos podem existir como isômeros cis e trans. As possibilidades estereoquímicas aumentam quando os ligantes de aminoácidos não são homoquirais .
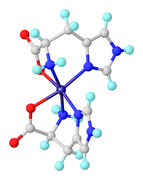
Os complexos homolépticos também são conhecidos onde o amino carboxilato são aminoácidos tridentados. Um desses complexos é o Ni (κ 3 -histidinato) 2 .
Complexos heterolépticos (aminoácidos mais outros ligantes)
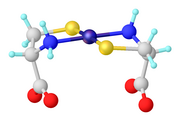
Os complexos de ligantes mistos são comuns para os aminoácidos. Exemplos bem conhecidos incluem [Co (en) 2 (glicinato)] 2+ , onde en ( etilenodiamina ) é um ligante de espectador. Na área de complexos organometálicos, um exemplo de Cp * Ir (κ 3 -metionina).
Síntese e reações
Comumente os complexos de aminoácidos são preparados por reações de deslocamento de ligante de complexos aquosos metálicos e as bases conjugadas de aminoácidos:
- [PtCl 4 ] 2- + 2 H 2 NCH (R) CO 2 - → [Pt (H 2 NCH (R) CO 2 ) 2 ] + 4 Cl -
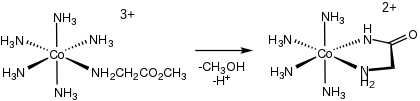
Relevantes para a química bioinorgânica , os complexos de aminoácidos podem ser gerados pela hidrólise de ésteres de aminoácidos e amidas (en = etilenodiamina ):
- [(en) 2 CoOH (κ 1N -H 2 NCH (R) CO 2 Et)] 2+ → [(en) 2 CoOH (κ 2NO -H 2 NCH (R) CO 2 )] 2+ + EtOH
Como seu anel quelato MNC 2 O de 5 membros é bastante estável, os complexos de aminoácidos representam grupos de proteção para aminoácidos, permitindo diversas reações das cadeias laterais.
Referências
- ^ Severin, K .; Bergs, R .; Beck, W. (1998). "Bioorganometallic Chemistry-Transition Metal Complexes with α-Amino Acids and Peptides". Angew. Chem. Int. Ed . 37 : 1635–1654. doi : 10.1002 / (SICI) 1521-3773 (19980703) 37:12 <1634 :: AID-ANIE1634> 3.0.CO; 2-C .CS1 maint: usa o parâmetro de autores ( link )
- ^ K.-Q. Gu, Y.-X. Sun, R. Zhang, N.-W. Zhang, H.-W. Che (2007). "Tris (glicinato-κ 2 N, O) cobalto (III)". Acta Crystallogr . E63 : m740 – m742. doi : 10.1107 / S1600536807005636 .CS1 maint: usa o parâmetro de autores ( link )
- ^ A. Abbasi, B. Safarkoopayeh, N. Khosravi, A. Shayesteh (217). "Estudos Estruturais de Bis (histidinato) níquel (II): Estudos Experimentais e Computacionais Combinados" . Comptes Rendus Chimie . 20 : 467. doi : 10.1016 / j.crci.2016.12.006 .CS1 maint: vários nomes: lista de autores ( link )
- ^ M. Scharwitz, T. van Almsick, WS Sheldrick (2007). "(S-Metilcisteinato) (η 5 -pentametilciclopentadienil) irídio (III) Trifluorometanossulfonato hemi-hidratado". Acta Crystallogr . E63 : m230-m232. doi : 10.1107 / S1600536806053360 .CS1 maint: vários nomes: lista de autores ( link )
- ^ Baidya, N .; Ndreu, D .; Olmstead, MM; Mascharak, PK (1991). "Síntese, estrutura e propriedades de bis (L-cisteinato-N, S) níquelato (II) sesqui-hidratado de potássio". Química Inorgânica . 30 : 2448–2451. doi : 10.1021 / ic00010a043 .CS1 maint: vários nomes: lista de autores ( link )
- ^ Iakovidis, A .; Hadjiliadis, N. (1994). "Compostos complexos de platina (II) e (IV) com aminoácidos, peptídeos e seus derivados". Revisões de Química de Coordenação . 135–136: 17–63. doi : 10.1016 / 0010-8545 (94) 80064-2 .
- ^ Wolfgang Beck (2009). "Íons metálicos e complexos metálicos como grupos protetores de aminoácidos e peptídeos - reações em aminoácidos coordenados". Z. Naturforsch . 64b : 1221–1245. doi : 10.1515 / znb-2009-11-1202 .