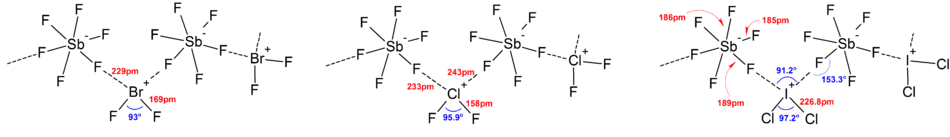Íons polihalogênio - Polyhalogen ions
Os íons polihalogênicos são um grupo de cátions poliatômicos e ânions contendo apenas halogênios . Os íons podem ser classificados em duas classes, íons isopolihalogênio que contêm apenas um tipo de halogênio e íons heteropolihalogênio com mais de um tipo de halogênio.
Introdução
Numerosos íons poli-halogênio foram encontrados, com seus sais isolados no estado sólido e estruturalmente caracterizados. As tabelas a seguir resumem as espécies encontradas até agora.
Cátions isopolialogênio Espécies diatômicas * [Cl 2 ] + , [Br 2 ] + , [I 2 ] + Espécie triatômica [Cl 3 ] + , [Br 3 ] + , [I 3 ] + Espécies tetraatômicas [Cl 4 ] + , [I 4 ] 2+ Espécies pentaatômicas [Br 5 ] + , [I 5 ] + Espécies Heptaatômicas † [I 7 ] + Espécies superiores [I 15 ] 3+
- * [Cl 2 ] + só pode existir como [Cl 2 O 2 ] 2+ em baixas temperaturas, um complexo de transferência de carga de O 2 para [Cl 2 ] + . O [Cl 2 ] + livre é conhecido apenas por seu espectro de banda eletrônica obtido em um tubo de descarga de baixa pressão.
- † A existência de [I 7 ] + é possível, mas ainda incerta.
Cátions heteropolialogênio Espécie triatômica [ClF 2 ] + , [Cl 2 F] + , [BrF 2 ] + , [IF 2 ] + , [ICl 2 ] + , [IBrCl] + , [IBr 2 ] + , [I 2 Cl] + , [ I 2 Br] + Espécies pentaatômicas [ClF 4 ] + , [BrF 4 ] + , [IF 4 ] + , [I 3 Cl 2 ] + Espécies Heptaatômicas [ClF 6 ] + , [BrF 6 ] + , [IF 6 ] +
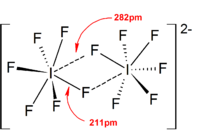
Ânions isopolialogênio Espécie triatômica [Cl 3 ] - , [Br 3 ] - , [I 3 ] - Espécies tetraatômicas [Br 4 ] 2− , [I 4 ] 2− Espécies pentaatômicas [I 5 ] - Espécies Heptaatômicas [I 7 ] - Espécies octaatômicas [Br 8 ] 2− , [I 8 ] 2− Espécies superiores [I 9 ] - , [I 10 ] 2− , [I 10 ] 4− , [I 11 ] - , [I 12 ] 2− , [I 13 ] 3− , [I 16 ] 2− , [I 22 ] 4− , [I 26 ] 3− , [I 26 ] 4− , [I 28 ] 4− , [I 29 ] 3−
Ânions de heteropolihalogênio Espécie triatômica [ClF 2 ] - , [BrF 2 ] - , [BrCl 2 ] - , [IF 2 ] - , [ICl 2 ] - , [IBrF] - , [IBrCl] - , [IBr 2 ] - , [I 2 Cl ] - , [I 2 Br] - , [AtBrCl] - , [AtBr 2 ] - , [AtICl] - , [AtIBr] - , [AtI 2 ] - Espécies pentaatômicas [ClF 4 ] - , [BrF 4 ] - , [IF 4 ] - , [ICl 3 F] - , [ICl 4 ] - , [IBrCl 3 ] - , [I 2 Cl 3 ] - , [I 2 BrCl 2 ] - , [I 2 Br 2 Cl] - , [I 2 Br 3 ] - , [I 4 Cl] - , [I 4 Br] - Espécies hexaatômicas [IF 5 ] 2− Espécies Heptaatômicas [ClF 6 ] - , [BrF 6 ] - , [IF 6 ] - , [I 3 Br 4 ] - Espécies não atômicas [IF 8 ] -
Estrutura
A maioria das estruturas dos íons foi determinada por espectroscopia de IV , espectroscopia Raman e cristalografia de raios-X . Os íons poli-halogênio sempre têm o halogênio mais pesado e menos eletronegativo presente no íon como o átomo central, tornando o íon assimétrico em alguns casos. Por exemplo, [Cl 2 F] + tem uma estrutura de [Cl – Cl – F] - mas não [Cl – F – Cl] - .
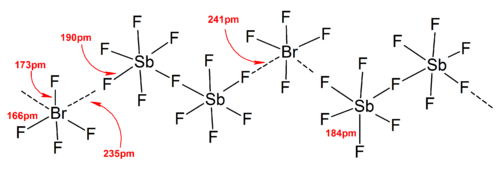
Em geral, as estruturas da maioria dos íons heteropolihalogênio e dos íons isopolihalogênicos inferiores estavam de acordo com o modelo VSEPR . No entanto, houve casos excepcionais. Por exemplo, quando o átomo central é pesado e tem sete pares solitários , como [BrF 6 ] - e [IF 6 ] - , eles têm um arranjo octaédrico regular de ligantes de fluoreto em vez de um distorcido devido à presença de um estereoquimicamente par solitário inerte . Mais desvios do modelo VSEPR ideal foram encontrados nas estruturas de estado sólido devido a fortes interações cátion-ânion, o que também complica a interpretação dos dados espectroscópicos vibracionais . Em todas as estruturas conhecidas dos sais de ânions de poli - halogênio , os ânions fazem contato muito próximo, por meio de pontes de halogênio, com os contra-cátions. Por exemplo, no estado sólido, [IF 6 ] - não é regularmente octaédrico, já que a estrutura de estado sólido de [Me 4 N] + [IF 6 ] - revela [I 2 F 11 ] 2− dímeros fracamente ligados . Interações catiônicas-ânions significativas também foram encontradas em [BrF 2 ] + [SbF 6 ] - , [ClF 2 ] + [SbF 6 ] - , [BrF 4 ] + [Sb 6 F 11 ] - .
Estruturas gerais de íons heteropolihalogênio selecionados Linear (ou quase linear) [ClF 2 ] - , [BrF 2 ] - , [BrCl 2 ] - , [IF 2 ] - , [ICl 2 ] - , [IBr 2 ] - , [I 2 Cl] - , [I 2 Br] - Dobrado [ClF 2 ] + , [Cl 2 F] + , [BrF 2 ] + , [IF 2 ] + , [ICl 2 ] + , [I 2 Cl] + , [IBr 2 ] + , [I 2 Br] + , [IBrCl] + Planar quadrado [ClF 4 ] - , [BrF 4 ] - , [IF 4 ] - , [ICl 4 ] - Disphenoidal (ou gangorra) [ClF 4 ] + , [BrF 4 ] + , [IF 4 ] + Planar pentagonal ‡ [IF 5 ] 2− Octaédrico [ClF 6 ] + , [BrF 6 ] + , [IF 6 ] + , § [ClF 6 ] - , [BrF 6 ] - , [IF 6 ] - Antiprismático quadrado [IF 8 ] -
- ‡ [IF 5 ] 2− é uma das duas espécies do tipo XY n conhecidas por terem a geometria pentagonal planar rara, sendo a outra [XeF 5 ] - . § [ClF 6 ] - é octaédrico distorcido, pois o efeito do par inerte estereoquímico não é significativo no átomo de cloro.
Os íons [I 3 Cl 2 ] + e [I 3 Br 2 ] + têm uma estrutura do tipo trans - Z , análoga à de [I 5 ] + .
Poliiodetos superiores
Os íons poliiodeto têm estruturas muito mais complicadas. Os poliiodetos discretos geralmente têm uma sequência linear de átomos de iodo e íons de iodeto e são descritos em termos de associação entre I 2 , I - e I-
3unidades, que reflete a origem do poliiodeto. Nos estados sólidos, os poliiodetos podem interagir uns com os outros para formar cadeias, anéis ou mesmo complicadas redes bidimensionais e tridimensionais.
União
A ligação em íons de polihalogênio principalmente invoca o uso predominante de orbitais p. A participação significativa do orbital d na ligação é improvável, já que muita energia promocional será necessária, enquanto a participação do orbital s escassa é esperada em espécies contendo iodo devido ao efeito do par inerte , sugerido pelos dados da espectroscopia Mössbauer . No entanto, nenhum modelo de ligação foi capaz de reproduzir tal ampla gama de comprimentos de ligação e ângulos observados até agora.
Como esperado do fato de que um elétron é removido do orbital anti- ligação quando X 2 é ionizado para [X 2 ] + , a ordem da ligação, bem como a força da ligação em [X 2 ] + fica maior, conseqüentemente as distâncias interatômicas no íon molecular é menor do que aqueles em X 2 .
Poli-halogenetos triatômicos lineares ou quase lineares têm ligações mais fracas e mais longas em comparação com aquelas no interhalogênio diatômico ou halogênio correspondente, consistente com a repulsão adicional entre átomos quando o íon haleto é adicionado à molécula neutra. Existe outro modelo envolvendo o uso da teoria da ressonância , por exemplo, [ICl 2 ] - pode ser visto como o híbrido de ressonância das seguintes formas canônicas :
A evidência que apóia esta teoria vem dos comprimentos de ligação (255 pm em [ICl 2 ] - e 232 pm em ICl (g) ) e números de onda de alongamento de ligação (267 e 222 cm −1 para alongamento simétrico e assimétrico em [ICl 2 ] - comparado com 384 cm −1 em ICl ), o que sugere uma ordem de ligação de cerca de1/2para cada ligação I – Cl em [ICl 2 ] - , consistente com a interpretação usando a teoria da ressonância. Outras espécies triatômicas [XY 2 ] - podem ser interpretadas de forma semelhante.
Síntese
A formação de íons poli - halogênio pode ser vista como a autodissociação de seus interhalogênios ou halogênios parentes :
- 2 XY n ⇌ [XY n −1 ] + + [XY n +1 ] -
- 3 X 2 ⇌ [X 3 ] + + [X 3 ] -
- 4 X 2 ⇌ [X 5 ] + + [X 3 ] -
- 5 X 2 ⇌ 2 [X 2 ] + + 2 [X 3 ] -
Cátions polihalogênicos
Existem duas estratégias gerais para a preparação de cátions polihalogênicos:
- Ao reagir o interhalogênio apropriado com um ácido de Lewis (como os halogenetos de B , Al , P , As , Sb ) em um solvente inerte ou oxidante (como HF anidro ) ou sem um, para dar um cátion heteropolihalogênio.
- XY n + MY m → [XY n −1 ] + + [MY m +1 ] -
- Por um processo oxidativo, no qual o halogênio ou interhalogênio é reagido com um oxidante e um ácido de Lewis para dar o cátion:
- Cl 2 + ClF + AsF 5 → [Cl 3 ] + [AsF 6 ] -
- Em alguns casos, o próprio ácido de Lewis (o aceitador de flúor ) atua como um oxidante:
- 3 I 2 + 3 SbF 5 → 2 [I 3 ] + [SbF 6 ] - + SbF 3
Normalmente, o primeiro método é empregado para a preparação de cátions heteropolialogênicos, e o segundo é aplicável a ambos. O processo oxidativo é útil na preparação dos cátions [IBr 2 ] + , [ClF 6 ] + , [BrF 6 ] + , como seus interhalogênios parentes, IBr 3 , ClF 7 , BrF 7 respectivamente, nunca foi isolado:
- Br 2 + IOSO 2 F → [IBr 2 ] + [SO 3 F] -
- 2 ClF 5 + 2 PtF 6 → [ClF 6 ] + [PtF 6 ] - + [ClF 4 ] + [PtF 6 ] -
- BrF 5 + [KrF] + [AsF 6 ] - → [BrF 6 ] + [AsF 6 ] - + Kr
A preparação de algumas espécies individuais é resumida brevemente na tabela abaixo com as equações:
Síntese de alguns cátions polihalogênicos Espécies Equação química relevante Condições adicionais necessárias [Cl 2 ] + (como [Cl 2 O 2 ] + ) Cl 2 + [O 2 ] + [SbF 6 ] - → [Cl 2 O 2 ] + [SbF 6 ] - em HF anidro em baixas temperaturas [Br 2 ] + Br 2 (em BrSO 3 F) + 3 SbF 5 → [Br 2 ] + [Sb 3 F 16 ] - (não balanceado) à temperatura ambiente [I 2 ] + 2 I 2 + S 2 O 6 F 2 → 2 [I 2 ] + [SO 3 F] - em HSO 3 F [Cl 3 ] + Cl 2 + ClF + AsF 5 → [Cl 3 ] + [AsF 6 ] - a uma temperatura de 195K (-78 ° C) [Br 3 ] + 3 Br 2 + 2 [O 2 ] + [AsF 6 ] - → 2 [Br 3 ] + [AsF 6 ] - + 2 O 2 [I 3 ] + 3 I 2 + S 2 O 6 F 2 → 2 [I 3 ] + [SO 3 F] - [Cl 4 ] + 2 Cl 2 + IrF 6 → [Cl 4 ] + [IrF 6 ] - em HF anidro, a uma temperatura abaixo de 193 K (-80 ° C) [I 4 ] 2+ 2 I 2 + 3 AsF 5 → [I 4 ] 2+ [AsF 6 - ] 2 + AsF 3 em SO 2 líquido [Br 5 ] + 8 Br 2 + 3 [XeF] + [AsF 6 ] - → 3 [Br 5 ] + [AsF 6 ] - + 3 Xe + BrF 3 [I 5 ] + 2 I 2 + ICl + AlCl 3 → [I 5 ] + [AlCl 4 ] - [I 7 ] + 7 I 2 + S 2 O 6 F 2 → 2 I 7 SO 3 F [ClF 2 ] + ClF 3 + AsF 5 → [ClF 2 ] + [AsF 6 ] - [Cl 2 F] + 2 ClF + AsF 5 → [Cl 2 F] + [AsF 6 ] - a uma temperatura abaixo de 197 K [BrF 2 ] + 5 BrF 3 + 2 Au → 3 BrF + 2 [BrF 2 ] + [AuF 4 ] - com excesso de BrF 3 necessário [IF 2 ] + IF 3 + AsF 5 → [IF 2 ] + [AsF 6 ] - [ICl 2 ] + ICl 3 + SbCl 5 → [ICl 2 ] + [SbCl 6 ] - [IBr 2 ] + Br 2 + IOSO 2 F → [IBr 2 ] + [SO 3 F] - [ClF 4 ] + ClF 5 + SbF 5 → [ClF 4 ] + [SbF 6 ] - [BrF 4 ] + BrF 5 + AsF 5 → [BrF 4 ] + [AsF 6 ] - [IF 4 ] + IF 5 + 2 SbF 5 → [IF 4 ] + [Sb 2 F 11 ] - [ClF 6 ] + ‡ Cs 2 NiF 6 + 5 AsF 5 + ClF 5 → [ClF 6 ] + [AsF 6 ] - + Ni [AsF 6 ] 2 + 2 CsAsF 6 [BrF 6 ] + [KrF] + [AsF 6 ] - + BrF 5 → [BrF 6 ] + [AsF 6 ] - + Kr [IF 6 ] + IF 7 + BrF 3 → [IF 6 ] + [BrF 4 ] -
- ‡ Nesta reacção, as espécies oxidantes activos é [NiF 3 ] + , o qual é formado in situ no Cs 2 NiF 6 / ASF 5 sistema / HF. É um agente oxidante e fluorante ainda mais poderoso do que o PtF 6 .
Ânions polihalogênicos
Para ânions polihalogênicos, também existem duas estratégias gerais de preparação:
- Ao reagir um interhalogênio ou halogênio com uma base de Lewis , mais provavelmente um fluoreto:
- [Et 4 N] + Y - + XY n → [Et 4 N] + [XY n +1 ] -
- X 2 + X - → X-
3
- Por oxidação de haletos simples :
- KI + Cl 2 → K + [ICl 2 ] -
A preparação de algumas espécies individuais é resumida brevemente na tabela abaixo com as equações:
Síntese de alguns ânions polihalogênicos Espécies Equação química relevante Condições adicionais necessárias [Cl 3 ] - , [Br 3 ] - , [I 3 ] - X 2 + X - → [X 3 ] - (X = Cl, Br, I) [Br 3 ] - Br 2 + [ n Bu 4 N] + Br - → [ n Bu 4 N] + [Br 3 ] - em 1,2-dicloroetano ou dióxido de enxofre líquido . [Br 3 ] - não existe em solução e só se forma quando o sal se cristaliza. [Br 5 ] - 2 Br 2 + [ n Bu 4 N] + Br - → [ n Bu 4 N] + [Br 5 ] - em 1,2-dicloroetano ou dióxido de enxofre líquido, com excesso de Br 2 [ClF 2 ] - ClF + CsF → Cs + [ClF 2 ] - [BrCl 2 ] - Br 2 + Cl 2 + 2 CsCl → 2 Cs + [BrCl 2 ] - [ICl 2 ] - KI + Cl 2 → K + [ICl 2 ] - [IBr 2 ] - CsI + Br 2 → Cs + [IBr 2 ] - [AtBr 2 ] - , [AtICl] - , [AtIBr] - , [AtI 2 ] - Em Y + X - → [AtXY] - (X = I, Br, Cl; Y = I, Br) [ClF 4 ] - NOF + ClF 3 → [NO] + [ClF 4 ] - [BrF 4 ] - 6 KCl + 8 BrF 3 → 6 K + [BrF 4 ] - + 3 Cl 2 + Br 2 excesso de BrF 5 necessário [IF 4 ] - 2 XeF 2 + [Me 4 N] + I - → [Me 4 N] + [IF 4 ] - + 2 Xe os reagentes foram misturados a 242 K, depois aquecidos a 298 K para a reação prosseguir [ICl 4 ] - KI + ICl 3 → K + [ICl 4 ] - [IF 5 ] 2− IF 3 + 2 [Me 4 N] + F - → [Me 4 N + ] 2 [IF 5 ] 2− [IF 6 ] - IF 5 + CsF → Cs + [IF 6 ] - [I 3 Br 4 ] - [PPh 4 ] + Br - + 3 IBr → [PPh 4 ] + [I 3 Br 4 ] - [IF 8 ] - IF 7 + [Me 4 N] + F - → [Me 4 N] + [IF 8 ] - em acetonitrila
Os poliiodetos superiores foram formados por cristalização de soluções contendo várias concentrações de I - e I 2 . Por exemplo, o monohidrato de KI 3 cristaliza quando uma solução saturada contendo quantidades apropriadas de I 2 e KI é resfriada.
Propriedades
Estabilidade
Em geral, um grande contra-cátion ou ânion (como Cs + , [SbF 6 ] - ) pode ajudar a estabilizar os íons poli-halogênio formados no estado sólido a partir de considerações de energia da rede , conforme a eficiência de empacotamento foi aumentada.
Os cátions polihalogênicos são fortes agentes oxidantes, conforme indicado pelo fato de só poderem ser preparados em líquidos oxidantes como solvente, como o oleum . Os mais oxidantes e, portanto, os mais instáveis são as espécies [X 2 ] + e [XF 6 ] + (X = Cl, Br), seguidos por [X 3 ] + e [IF 6 ] + .
A estabilidade dos sais [X 2 ] + (X = Br, I) é termodinamicamente bastante estável. No entanto, sua estabilidade em solução depende do solvente superácido . Por exemplo, [I 2 ] + é estável em ácido fluoroantimônico (HF com 0,2 N SbF 5 , H 0 = −20,65), mas desproporcional a [I 3 ] + , [I 5 ] + e I 2 quando aceitadores de fluoreto mais fracos, como NBF 5 , TaF 5 ou NaF , são adicionados ao invés de SbF 5 .
- 14 [I 2 ] + + 5 F - → 9 [I 3 ] + + IF 5
Para ânions polihalogênicos com o mesmo cátion, os mais estáveis são aqueles com um halogênio mais pesado no centro, os íons simétricos também são mais estáveis do que os assimétricos. portanto, a estabilidade dos ânions diminui na ordem:
- [I 3 ] - > [IBr 2 ] - > [ICl 2 ] - > [I 2 Br] - > [Br 3 ] - > [BrCl 2 ] - > [Br 2 Cl] -
Íons heteropolialogênio com um número de coordenação maior ou igual a quatro só podem existir com ligantes de flúor.
Cor
A maioria dos íons de polihalogênio é intensamente colorida, com cor mais profunda à medida que o peso atômico do elemento constituinte aumenta. O conhecido complexo amido- iodo tem uma cor azul profunda devido aos íons lineares [I 5 ] - presentes na hélice da amilose . Algumas cores das espécies comuns foram listadas abaixo:
- fluorocações tendem a ser incolores ou amarelo pálido, outros íons heteropolihalogênio são laranja, vermelho ou roxo profundo
- compostos de [ICl 2 ] + são de vermelho vinho a laranja brilhante; enquanto o de [I 2 Cl] + é marrom escuro a preto purpúreo
- [Cl 3 ] + é amarelo
- [Cl 4 ] + é azul
- [Br 2 ] + é vermelho cereja
- [Br 3 ] + é marrom
- [Br 5 ] + é marrom escuro
- [I 2 ] + é azul brilhante
- [I 3 ] + é marrom escuro a preto
- [I 4 ] 2+ é vermelho a marrom
- [I 5 ] + é verde ou preto, o sal [I 5 ] + [AlCl 4 ] - existe como agulhas preto-esverdeadas, mas aparece vermelho-marrom em seções finas
- [I 7 ] + é preto, se sua existência no composto I 7 SO 3 F foi firmemente estabelecida
- [I 15 ] 3+ é preto
- [ICl 2 ] - é vermelho escarlate
- [ICl 4 ] - é amarelo dourado
- poliiodetos têm cores muito escuras, seja marrom escuro ou azul escuro
Propriedades quimicas
Os cátions heteropolihalogênicos são oxidantes explosivamente reativos, e os cátions freqüentemente têm maior reatividade do que seus interhalogênios pais e se decompõem por vias redutivas. Como esperado do estado de oxidação mais alto de +7 em [ClF 6 ] + , [BrF 6 ] + e [IF 6 ] + , essas espécies são agentes oxidantes extremamente fortes, demonstrado pelas reações mostradas abaixo:
- 2 O 2 + 2 [BrF 6 ] + [AsF 6 ] - → 2 [O 2 ] + [AsF 6 ] - + 2 BrF 5 + F 2
- Rn + [IF 6 ] + [SbF 6 ] - → [RnF] + [SbF 6 ] - + IF 5
Os cátions polihalogênicos com estados de oxidação mais baixos tendem a ser desproporcionais . Por exemplo, [Cl 2 F] + é instável em solução e desproporcional completamente em HF / SbF 5, mesmo em 197K:
- 2 [Cl 2 F] + → [ClF 2 ] + + [Cl 3 ] +
[I 2 ] + se dimeriza reversivelmente a 193 K e é observado quando a cor azul de paramagnético [I 2 ] + muda drasticamente para a cor vermelho-marrom de diamagnético [I 2 ] + , junto com uma queda na suscetibilidade paramagnética e elétrica condutividade quando a solução é resfriada abaixo de 193 K:
- 2 [I 2 ] + ⇌ [I 4 ] 2+
A dimerização pode ser atribuída à sobreposição dos orbitais π * parcialmente preenchidos em dois [I 2 ] + .
[Cl 4 ] + em [Cl 4 ] + [IrF 6 ] - é estruturalmente análogo a [I 4 ] 2+ , mas se decompõe em 195 K para dar sais de [Cl 3 ] + em vez de [Cl 2 ] + e Cl 2 .
As tentativas de preparar ClF 7 e BrF 7 por fluoração [ClF 6 ] + e [BrF 6 ] + usando NOF falharam ; em vez disso, ocorreram as seguintes reações:
- [ClF 6 ] + [PtF 6 ] - + NOF → [NO] + [PtF 6 ] - + ClF 5 + F 2
- [BrF 6 ] + [AsF 6 ] - + 2 NOF → [NO] + [AsF 6 ] - + [NO] + [BrF 6 ] - + F 2
Os ânions são menos reativos em comparação com os cátions e geralmente são oxidantes mais fracos do que seus interhalogênios de origem. Eles são menos reativos para compostos orgânicos, e alguns sais são de estabilidade térmica bastante elevada. Sais contendo ânions de poli-halogênio do tipo M + [X m Y n Z p ] - (onde m + n + p = 3, 5, 7, 9 ... ) tendem a se dissociar em sais de monohaleto simples entre M + e a maioria halogênio eletronegativo , de modo que o monohaleto tem a energia de rede mais alta. Um interhalogênio geralmente é formado como o outro produto. O sal [Me 4 N] + [ClF 4 ] - decompõe-se a cerca de 100 ° C, e os sais de [ClF 6 ] - são termicamente instáveis e podem explodir mesmo a -31 ° C.