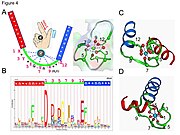
Mão EF - EF hand
| Mão EF | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estrutura do Paramecium tetraurelia calmodulin recombinante .
| |||||||||
| Identificadores | |||||||||
| Símbolo | efhand | ||||||||
| Pfam | PF00036 | ||||||||
| InterPro | IPR002048 | ||||||||
| PRÓSITO | PDOC00018 | ||||||||
| SCOP2 | 1osa / SCOPe / SUPFAM | ||||||||
| CDD | cd00051 | ||||||||
| |||||||||
A mão EF é um domínio ou motivo estrutural hélice-alça-hélice encontrado em uma grande família de proteínas de ligação ao cálcio .
O motivo da mão EF contém uma topologia hélice-alça-hélice, muito parecida com o polegar e o indicador da mão humana, em que os íons Ca 2+ são coordenados por ligantes dentro da alça. O nome do motivo vem da nomenclatura tradicional usada para descrever a proteína parvalbumina , que contém três desses motivos e provavelmente está envolvida no relaxamento muscular por meio de sua atividade de ligação de cálcio.
A mão EF consiste em duas hélices alfa ligadas por uma região de loop curto (geralmente cerca de 12 aminoácidos ) que geralmente liga os íons de cálcio . As mãos EF também aparecem em cada domínio estrutural da proteína sinalizadora calmodulina e na proteína muscular troponina-C .
Local de ligação do íon cálcio
- O íon cálcio é coordenado em uma configuração bipiramidal pentagonal. Os seis resíduos envolvidos na ligação estão nas posições 1, 3, 5, 7, 9 e 12; estes resíduos são denotados por X, Y, Z, -Y, -X e -Z. O invariante Glu ou Asp na posição 12 fornece dois oxigênios para ligar o Ca (ligante bidentado).
- O íon cálcio é ligado por ambos os átomos da estrutura protéica e pelas cadeias laterais de aminoácidos , especificamente aquelas dos resíduos de aminoácidos ácidos aspartato e glutamato . Esses resíduos são carregados negativamente e farão uma interação de carga com o íon de cálcio carregado positivamente. O motivo da mão EF estava entre os primeiros motivos estruturais cujos requisitos de sequência foram analisados em detalhes. Cinco dos resíduos da alça ligam-se ao cálcio e, portanto, têm uma forte preferência por cadeias laterais contendo oxigênio , especialmente aspartato e glutamato. O sexto resíduo no loop é necessariamente glicina devido aos requisitos conformacionais do backbone. Os resíduos restantes são tipicamente hidrofóbicos e formam um núcleo hidrofóbico que se liga e estabiliza as duas hélices.
- Após a ligação ao Ca 2+ , este motivo pode sofrer alterações conformacionais que permitem funções reguladas por Ca 2+ , conforme observado em efetores de Ca 2+ , como calmodulina (CaM) e troponina C (TnC) e tampões de Ca 2+ , como calreticulina e calbindina D9k. Enquanto a maioria das proteínas de ligação ao cálcio EF-hand (CaBPs) conhecidas contêm motivos EF-hand emparelhados, CaBP's com mãos EF únicas também foram descobertas em bactérias e eucariotos. Além disso, "motivos semelhantes à mão de EF" foram encontrados em várias bactérias. Embora as propriedades de coordenação permaneçam semelhantes com o motivo de mão EF de hélice-loop-hélice de 29 resíduos canônicos, os motivos EF-hand-like diferem de EF-hands por conterem desvios na estrutura secundária das sequências de flanqueamento e / ou variação no comprimento da alça de coordenação de Ca 2+ .
- As mãos EF têm uma seletividade muito alta para o cálcio. Por exemplo, a constante de dissociação de alfa parvalbumina para Ca 2+ é ~ 1000 vezes menor do que para o íon semelhante Mg 2+ . Essa alta seletividade se deve à geometria de coordenação relativamente rígida, à presença de múltiplas cadeias laterais de aminoácidos carregados no local de ligação, bem como às propriedades de solvatação do íon.
Predição
- A pesquisa de padrão (assinatura do motivo) é uma das maneiras mais simples de prever locais contínuos de ligação de Ca 2+ à mão EF em proteínas. Com base nos resultados de alinhamento de sequência de motivos canônicos de EF-hand, especialmente as cadeias laterais conservadas diretamente envolvidas na ligação de Ca 2+ , um padrão PS50222 foi gerado para prever locais canônicos de EF-hand. Os servidores de previsão podem ser encontrados na seção de links externos.
Classificação
- Desde o delineamento do motivo EF-hand em 1973, a família das proteínas EF-hand se expandiu para incluir pelo menos 66 subfamílias até agora. Os motivos das mãos EF são divididos em dois grupos principais:
- Mãos canônicas EF como vistas na calmodulina (CaM) e na proteína procariótica semelhante a CaM, caleritrina. A alça de mão EF canônica de 12 resíduos se liga a Ca 2+ principalmente por meio de carboxilatos de cadeia lateral ou carbonilas (posições de seqüência de alça 1, 3, 5, 12). O resíduo no eixo –X coordena o íon Ca 2+ por meio de uma molécula de água em ponte. O EF-hand loop tem um ligante bidentado (Glu ou Asp) no eixo –Z.
- Pseudo-mãos EF encontradas exclusivamente nos terminais N das proteínas S100 e semelhantes a S100. A alça de mão pseudo EF de 14 resíduos quela Ca 2+ principalmente por meio de carbonilas de base (posições 1, 4, 6, 9).
Pontos adicionais:
- Proteínas semelhantes à mão de EF com elementos estruturais flanqueadores diversificados ao redor da alça de ligação de Ca 2+ foram relatadas em bactérias e vírus. Estas proteínas procarióticas EF-hand-like estão amplamente implicadas na sinalização de Ca 2+ e na homeostase em bactérias. Eles contêm comprimentos flexíveis de laços de ligação de Ca 2+ que diferem dos motivos da mão EF. No entanto, suas propriedades de coordenação lembram os motivos clássicos da mão EF.
- Por exemplo, o sítio de ligação de Ca 2+ semicontínuo na proteína de ligação de D-galactose (GBP) contém uma alça de nove resíduos. O íon Ca 2+ é coordenado por sete átomos de proteína de oxigênio, cinco dos quais são da alça que imita a alça EF canônica, enquanto os outros dois são do grupo carboxilato de um Glu distante.
- Outro exemplo é um novo domínio denominado Excalibur (região extracelular de ligação ao Ca 2+ ) isolado de Bacillus subtilis . Este domínio tem uma alça conservada de ligação de Ca 2+ de 10 resíduos notavelmente semelhante à alça de mão EF de 12 resíduos canônica.
- A diversidade da estrutura da região flanqueadora é ilustrada pela descoberta de domínios EF-hand-like em proteínas bacterianas. Por exemplo, uma hélice-alça-fita em vez da estrutura hélice-alça-hélice está na proteína de ligação à galactose periplasmática ( Salmonella typhimurium , PDB : 1gcg ) ou proteína de ligação ao alginato ( Sphingomonas sp ., 1kwh ); a hélice de entrada está faltando no antígeno protetor ( Bacillus anthracis , 1acc ) ou dockerin ( Clostridium thermocellum , 1daq ).
- Entre todas as estruturas relatadas até agora, a maioria dos motivos das mãos EF são emparelhados entre dois motivos canônicos ou um pseudo e um canônico. Para proteínas com números ímpares de mãos EF, como a penta-EF-calpaína de mão, os motivos de mão de EF foram acoplados por homodimerização ou heterodimerização. A mão EF recém-identificada contendo proteína sensora de Ca 2+ ER , molécula de interação estromal 1 e 2 (STIM1, STIM2), demonstrou conter um motivo de mão EF canônica de ligação de Ca 2+ que emparelha com um motivo imediato, a jusante mão EF atípica "oculta" não ligada a Ca 2+ . Motivos de uma única mão EF podem servir como módulos de encaixe de proteínas: por exemplo, a única mão EF nas proteínas NKD1 e NKD2 se liga às proteínas Disheveled (DVL1, DVL2, DVL3).
- Funcionalmente, as mãos EF podem ser divididas em duas classes: 1) proteínas de sinalização e 2) proteínas de tamponamento / transporte. O primeiro grupo é o maior e inclui os membros mais conhecidos da família, como calmodulina, troponina C e S100B. Essas proteínas normalmente sofrem uma mudança conformacional dependente de cálcio que abre um local de ligação alvo. Este último grupo é representado pela calbindina D9k e não sofre alterações conformacionais dependentes de cálcio.
Subfamílias
Exemplos
Aequorin
A equorina é uma proteína de ligação ao cálcio (CaBP) isolada do celenterado Aequorea victoria. Aequorina pertence à família EF-hand de CaBPs, com EF-hand loops que estão intimamente relacionados aos CaBPs em mamíferos. Além disso, a equorina tem sido usada há anos como um indicador de Ca2 + e tem se mostrado segura e bem tolerada pelas células. A equorina é composta por dois componentes - o componente de ligação de cálcio apoaequorin (AQ) e a molécula quimioluminescente coelenterazina. A porção AQ desta proteína contém os domínios de ligação de cálcio EF-hand.
Proteínas humanas
As proteínas humanas contendo este domínio incluem:
- ACTN1 ; ACTN2 ; ACTN3 ; ACTN4 ; APBA2BP ; AYTL1 ; AYTL2
- C14orf143 ; CABP1 ; CABP2 ; CABP3 ; CABP4 ; CABP5 ; CABP7 ; CALB1 ; CALB2 ; CALM2 ; CALM3 ; CALML3 ; CALML4 ; CALML5 ; CALML6 ; CALN1 ; CALU ; CAPN1 ; CAPN11 ; CAPN2 ; CAPN3 ; CAPN9 ; CAPNS1 ; CAPNS2 ; CAPS ; CAPS2 ; CAPSL ; CBARA1 ; CETN1 ; CETN2 ; CETN3 ; CHP ; CHP2 ; CIB1 ; CIB2 ; CIB3 ; CIB4 ; CRNN
- DGKA ; DGKB ; DGKG ; DST ; DUOX1 ; DUOX2
- EFCAB1 ; EFCAB2 ; EFCAB4A ; EFCAB4B ; EFCAB6 ; EFCBP1 ; EFCBP2 ; EFHA1 ; EFHA2 ; EFHB ; EFHC1 ; EFHD1 ; EFHD2 ; EPS15 ; EPS15L1
- FKBP10 ; FKBP14 ; FKBP7 ; FKBP9 ; FKBP9L ; FREQ ; FSTL1 ; FSTL5
- GCA ; GPD2 ; GUCA1A ; GUCA1B ; GUCA1C
- hipocalcina ; HPCAL1 ; HPCAL4 ; HZGJ
- IFPS ; ITSN1 ; ITSN2 ; KCNIP1 ; KCNIP2 ; KCNIP3 ; KCNIP4 ; KIAA1799
- LCP1
- MACF1 ; MRLC2 ; MRLC3 ; MST133 ; MYL1 ; MYL2 ; MYL5 ; MYL6B ; MYL7 ; MYL9 ; MYLC2PL ; MYLPF
- NCALD ; NIN ; NKD1 ; NKD2 ; PNL ; NOX5 ; NUCB1 ; NUCB2
- OCM
- PDCD6 ; PEF1 ; PKD2 ; PLCD1 ; PLCD4 ; PLCH1 ; PLCH2 ; PLS1 ; PLS3 ; PP1187 ; PPEF1 ; PPEF2 ; PPP3R1 ; PPP3R2 ; PRKCSH ; PVALB
- RAB11FIP3 ; RASEF ; RASGRP ; RASGRP1 ; RASGRP2 ; RASGRP3 ; RCN1 ; RCN2 ; RCN3 ; RCV1 ; RCVRN ; REPS1 ; RHBDL3 ; RHOT1 ; RHOT2 ; RPTN ; RYR2 ; RYR3
- S100A1 ; S100A11 ; S100A12 ; S100A6 ; S100A8 ; S100A9 ; S100B ; S100G ; S100Z ; SCAMC-2 ; SCGN ; SCN5A ; SDF4 ; SLC25A12 ; SLC25A13 ; SLC25A23 ; SLC25A24 ; SLC25A25 ; SPATA21 ; SPTA1 ; SPTAN1 ; SRI
- TBC1D9 ; TBC1D9B ; TCHH ; TESC ; TNNC1 ; TNNC2
- USP32
- VSNL1
- ZZEF1
Veja também
- Outro motivo distinto de ligação de cálcio composto por hélices alfa é o domínio dockerin .
Referências
Leitura adicional
- Branden C, Tooze J (1999). "Capítulo 2: Motivos da estrutura da proteína". Introdução à estrutura de proteínas . Nova York: Garland Pub. pp. 24-25. ISBN 0-8153-2305-0.
- Nakayama S, Kretsinger RH (1994). "Evolução da família de proteínas da mão EF". Annu Rev Biophys Biomol Struct . 23 : 473–507. doi : 10.1146 / annurev.bb.23.060194.002353 . PMID 7919790 .
- Zhou Y, Yang W, Kirberger M, Lee HW, Ayalasomayajula G, Yang JJ (novembro de 2006). "Predição de proteínas de ligação de cálcio EF-hand e análise de proteínas bacterianas EF-hand". Proteínas . 65 (3): 643–55. doi : 10.1002 / prot.21139 . PMID 16981205 . S2CID 8904181 .
- Zhou Y, Frey TK, Yang JJ (julho de 2009). "Calciômica viral: interação entre Ca2 + e vírus" . Cell Calcium . 46 (1): 1–17. doi : 10.1016 / j.ceca.2009.05.005 . PMC 3449087 . PMID 19535138 .
- Nakayama S, Moncrief ND, Kretsinger RH (maio de 1992). "Evolução das proteínas moduladas pelo cálcio da mão EF. II. Domínios de várias subfamílias têm diversas histórias evolutivas". J. Mol. Evol . 34 (5): 416–48. doi : 10.1007 / BF00162998 . PMID 1602495 . S2CID 34614223 .
- Hogue CW, MacManus JP, Banville D, Szabo AG (julho de 1992). "Comparação de aumento de luminescência de térbio (III) em mutantes de proteínas de ligação de cálcio de mão EF" . J. Biol. Chem . 267 (19): 13340–7. doi : 10.1016 / S0021-9258 (18) 42216-8 . PMID 1618836 .
- Bairoch A, Cox JA (setembro de 1990). "EF-hand motifs in inositol phospholipid-specific phospholipase C" . FEBS Lett . 269 (2): 454–6. doi : 10.1016 / 0014-5793 (90) 81214-9 . PMID 2401372 .
- Finn BE, Forsén S (janeiro de 1995). "O modelo em evolução da estrutura, função e ativação da calmodulina" . Estrutura . 3 (1): 7-11. doi : 10.1016 / S0969-2126 (01) 00130-7 . PMID 7743133 .
- Stathopulos PB, Zheng L, Li GY, Plevin MJ, Ikura M (outubro de 2008). "Insights estruturais e mecanísticos na iniciação mediada por STIM1 da entrada de cálcio operada em loja" . Cell . 135 (1): 110–22. doi : 10.1016 / j.cell.2008.08.006 . PMID 18854159 .
- Nelson MR, Thulin E, Fagan PA, Forsén S, Chazin WJ (fevereiro de 2002). "O domínio EF-hand: uma unidade estrutural globalmente cooperativa" . Protein Sci . 11 (2): 198–205. doi : 10.1110 / ps.33302 . PMC 2373453 . PMID 11790829 .
links externos
- Classe de motivo de recurso de Motivo Linear Eucariótico LIG_EH_1
- Classe de motivo de recurso de Motivo Linear Eucariótico LIG_IQ
- Classe de motivo de recurso de Motivo Linear Eucariótico DOC_PP2B_LxvP_1
- Classe de motivo de recurso de Motivo Linear Eucariótico LIG_IQ
- Nelson M, Chazin W. "EF-Hand Calcium-Binding Proteins Data Library" . Vanderbilt University . Página visitada em 29-08-2009 .
-
Haiech J. "EF-hand protein database (EF-handome)" . Sociedade Europeia do Cálcio e a Université Libre de Bruxelles . Página visitada em 29-08-2009 .
a pedido para haiech@pharma.u-strasbg.fr
-
Yang J. "Calciomics" . Georgia State University. Arquivado do original em 12/10/2009 . Página visitada em 29-08-2009 .
servidor de previsão para proteínas de ligação de cálcio EF-hand