Nitrato de amônio cérico - Ceric ammonium nitrate

|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Nitrato de diamônio cério (IV)
|
|
| Outros nomes
Nitrato de amônio cérico (CAN)
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.037.100 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| H 8 N 8 CeO 18 | |
| Massa molar | 548,218 g · mol −1 |
| Aparência | cristais laranja-vermelho |
| Ponto de fusão | 107 a 108 ° C (225 a 226 ° F; 380 a 381 K) |
| 141 g / 100 mL (25 ° C) 227 g / 100 mL (80 ° C) |
|
| Estrutura | |
| Monoclínico | |
| Icosaédrico | |
| Perigos | |
| Pictogramas GHS |
 
|
| Palavra-sinal GHS | Perigo |
| H272 , H302 , H315 , H319 , H335 | |
| P220 , P261 , P305 + 351 + 338 | |
| Compostos relacionados | |
|
Compostos relacionados
|
Nitrato de amônio óxido de cério (IV) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
Nitrato de amônio cérico (CAN) é o composto inorgânico com a fórmula ( NH 4 ) 2 Ce (NO 3 ) 6 . Este sal de cério vermelho alaranjado e solúvel em água é um agente oxidante especializado em síntese orgânica e um oxidante padrão em análises quantitativas .
Preparação, propriedades e estrutura
O ânion [Ce (NO
3)
6]2−
é gerado dissolvendo Ce
2O
3em HNO 3 concentrado quente .
O sal consiste no ânion [Ce (NO
3)
6]2−
e um par de contra-íons NH 4 + . Os íons de amônio não estão envolvidos nas reações de oxidação desse sal. No ânion, cada grupo de nitrato quela o átomo de cério de maneira bidentada , conforme mostrado abaixo:
O ânion [Ce (NO
3)
6]2−
tem simetria molecular T h (O h idealizada ) . O núcleo CeO 12 define um icosaedro .
Ce 4+ é um forte agente oxidante de um elétron . Em termos de seu potencial redox (E ° ~ 1,61 V vs. NHE), é um agente oxidante ainda mais forte do que Cl 2 (E ° ~ 1,36 V). Poucos reagentes estáveis em armazenamento são oxidantes mais fortes. No processo redox, Ce (IV) é convertido em Ce (III), uma mudança de um elétron, sinalizada pelo desbotamento da cor da solução de laranja para amarelo pálido (desde que o substrato e o produto não sejam fortemente coloridos).
Aplicações em química orgânica
Em síntese orgânica, CAN é útil como um oxidante para muitos grupos funcionais ( álcoois , fenóis e éteres ), bem como ligações C – H, especialmente aquelas que são benzílicas. Os alcenos sofrem dinitroxilação, embora o resultado seja dependente do solvente. As quinonas são produzidas a partir de catecóis e hidroquinonas e até mesmo os nitroalcanos são oxidados.
CAN fornece uma alternativa para a reação Nef ; por exemplo, para a síntese de cetomacrolídeo em que reações colaterais complicadoras geralmente encontradas usando outros reagentes. A halogenação oxidativa pode ser promovida pelo CAN como um oxidante in situ para a bromação benzílica e a iodação de cetonas e derivados de uracila .
Para a síntese de heterociclos
Quantidades catalíticas de CAN aquoso permitem a síntese eficiente de derivados de quinoxalina . As quinoxalinas são conhecidas por suas aplicações como corantes, semicondutores orgânicos e agentes de clivagem de DNA. Esses derivados também são componentes de antibióticos como a equinomicina e a actinomicina . A reação de três componentes catalisada por CAN entre anilinas e éteres alquilvinílicos fornece uma entrada eficiente em 2-metil-1,2,3,4-tetra-hidroquinolinas e nas quinolinas correspondentes obtidas por sua aromatização .
Como um reagente de desprotecção
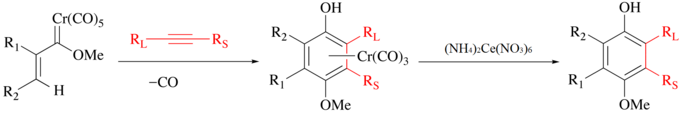
CAN é tradicionalmente usado para liberar ligantes orgânicos de carbonilas metálicas . No processo, o metal é oxidado, o CO é desenvolvido e o ligante orgânico é liberado para manipulação posterior. Por exemplo, com a reação de Wulff-Dötz, um alcino, monóxido de carbono e um carbeno de cromo são combinados para formar um complexo de meio-sanduíche de cromo e o ligante de fenol pode ser isolado por oxidação CAN moderada.
CAN é usado para clivar para- metoxibenzil éteres e 3,4-dimetoxibenzil éteres, que são grupos de proteção para álcoois. Dois equivalentes de CAN são necessários para cada equivalente de éter para- metoxibenzílico. O álcool é liberado e o para- metoxibenzil éter se converte em para- metoxibenzaldeído. A equação balanceada é a seguinte:
- 2 (NH 4 ) 2 Ce (NO 3 ) 6 + H 3 COC 6 H 4 CH 2 OR + H 2 O → 4 NH 4 + + 2 Ce 3+ + 12 NO 3 - + 2 H + + H 3 COC 6 H 4 CHO + HOR
Outras aplicações
O CAN também é um componente do ácido acústico de cromo , um material utilizado na produção de fotomáscaras e telas de cristal líquido .