Camptotecina - Camptothecin
 | |
| Dados clínicos | |
|---|---|
| Código ATC | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.113.172 |
| Dados químicos e físicos | |
| Fórmula | C 20 H 16 N 2 O 4 |
| Massa molar | 348,358 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| Ponto de fusão | 275 a 277 ° C (527 a 531 ° F) |
| |
| |
| (verificar) | |
A camptotecina ( CPT ) é um inibidor da topoisomerase . Foi descoberto em 1966 por ME Wall e MC Wani no rastreio sistemático de medicamentos anticancerígenos de produtos naturais . Foi isolado da casca e do caule da Camptotheca acuminata (Camptotheca, árvore feliz), uma árvore nativa da China usada na medicina tradicional chinesa . Tem sido usado clinicamente mais recentemente na China para o tratamento de tumores gastrointestinais. O CPT mostrou atividade anticâncer em estudos clínicos preliminares , especialmente contra cânceres de mama, ovário, cólon, pulmão e estômago. No entanto, apresenta baixa solubilidade e efeitos adversos têm sido relatados quando usado terapeuticamente, por isso químicos sintéticos e medicinais têm desenvolvido inúmeras sínteses de camptotecina e vários derivados para aumentar os benefícios do químico , com bons resultados. Quatro análogos do CPT foram aprovados e são usados na quimioterapia do câncer hoje, topotecan , irinotecan , belotecan e trastuzumab deruxtecan . A camptotecina também foi encontrada em outras plantas, incluindo Chonemorpha fragrans .
Estruturas
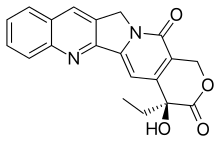
CPT tem uma estrutura de anel pentacíclico planar , que inclui uma fração pirrolo [3,4-β] -quinolina (anéis A, B e C), fração de piridona conjugada (anel D) e um centro quiral na posição 20 dentro do alfa- hidroxi anel lactona com configuração (S) (o anel E). Sua estrutura plana é considerada um dos fatores mais importantes na inibição da topoisomerase.
Obrigatório
O CPT liga-se à topoisomerase I e ao complexo de DNA (o complexo covalente), resultando em um complexo ternário e, assim, estabilizando-o. Isso evita a religação do DNA e, portanto, causa danos ao DNA que resultam em apoptose . O CPT se liga à enzima e ao DNA com ligações de hidrogênio . A parte mais importante da estrutura é o anel E, que interage a partir de três posições diferentes com a enzima. O grupo hidroxila na posição 20 forma uma ligação de hidrogênio à cadeia lateral do ácido aspártico número 533 (Asp533) na enzima. É crítico que a configuração do carbono quiral seja (S) porque (R) é inativo. A lactona está ligada com duas ligações de hidrogênio aos grupos amino na arginina 364 (Arg364). O anel D interage com a citosina +1 na fita não clivada e estabiliza o complexo covalente topoisomerase I-DNA formando uma ligação de hidrogênio. Esta ligação de hidrogênio está entre o grupo carbonila na posição 17 no anel D e o grupo amino no anel pirimidina de citosina +1. O CPT é seletivamente citotóxico para as células que replicam o DNA durante a fase S e sua toxicidade é principalmente o resultado da conversão de quebras de fita simples em quebras de fita dupla quando a forquilha de replicação colide com os complexos de clivagem formados por DNA e CPT.
Química
O anel de lactona no CPT é altamente suscetível à hidrólise . A forma de anel aberto é inativa e, portanto, deve ser fechada para inibir a topoisomerase I. A forma fechada é favorecida em condições ácidas, como é no microambiente de muitas células cancerosas . O CPT é transportado para a célula por difusão passiva . A captação celular é favorecida pela lipofilicidade , que aumenta o acúmulo intracelular . A lipofilicidade torna os compostos mais estáveis por causa da melhor partição da lactona nos glóbulos vermelhos e, conseqüentemente, menos hidrólise da lactona. CPT tem afinidade para albumina de soro humano (HSA), especialmente a forma carboxilato de CPT. Por causa disso, o equilíbrio entre o anel de lactona e a forma carboxilato é direcionado para o carboxilato. A redução das interações droga-HSA pode resultar em melhora da atividade.
Relação estrutura-atividade
Estudos demonstraram que a substituição nas posições 7, 9, 10 e 11 pode ter um efeito positivo na atividade do CPT e nas propriedades físicas , por exemplo, potência e estabilidade metabólica. Aumento do anel de lactona em um CH
2unidade também aumenta suas habilidades, como na homocamptotecina. A substituição na posição 12 e 14 leva à derivada inativa.
Modificação do anel A e B
Substituição Alquil
Alquilo substituição na posição 7 mostrou aumento da citotoxicidade, tal como acetato de (C 2 H 5 ) ou clorometilo (CH 2 Cl). Esses grupos são capazes de reagir com o DNA na presença de topoisomerase I, o que leva a mais atividade tumoral . Também foi demonstrado que o aumento do comprimento da cadeia de carbono (na posição 7) leva ao aumento da lipofilicidade e, consequentemente, maior potência e estabilidade no plasma humano . Outros análogos do CPT modificado com 7 são silatecanos e carenitecinas. Eles são inibidores potentes da topoisomerase I e ambos têm grupos alquilsilil na posição 7, o que os torna lipofílicos e mais estáveis. Os silatecanos ou 7-sililcamptotecinas mostraram redução das interações fármaco-HSA, o que contribui para a estabilidade do sangue e também podem atravessar a barreira hematoencefálica . DB-67 é um derivado 10-hidroxi e está entre os silatecanos mais ativos. O BNP1350, que pertence à série das carenitecinas, exibe atividade citotóxica e capacidade de superar a resistência aos medicamentos . Ainda outra via para tornar o CPT lipofílico é introduzir substituintes lipofílicos, tais como porções iminometil ou oxiiminometil. Um dos compostos mais potentes é o derivado oxiiminometil ST1481 que tem a vantagem de superar a resistência aos medicamentos causada pelos sistemas de transporte. O nitrogênio básico em uma cadeia de carbono na posição 7 torna o composto mais hidrofílico e, portanto, mais solúvel em água. Por exemplo, é um derivado chamado CKD-602, que é um potente inibidor da topoisomerase I e supera com sucesso a baixa solubilidade em água e toxicidade observada com CPT.
Uma atividade consideravelmente maior pode ser alcançada colocando grupos de retirada de elétrons como amino, nitro , bromo ou cloro na posição 9 e 10 e grupo hidroxila na posição 10 ou 11. Mas esses compostos são relativamente insolúveis em soluções aquosas, o que causa dificuldade nas administrações. O grupo metoxi em ambas as posições 10 e 11 leva simultaneamente à inatividade.
Análogos hexacíclicos de CPT
Os análogos hexacíclicos do CPT mostraram grande potência. Por exemplo, o grupo metilenodioxi ou etilenodioxi conectado entre 10 e 11 forma um anel de 5 ou 6 membros que leva a mais derivados solúveis em água e potência aumentada. Pesquisas mostraram que os análogos do etilenodioxi são menos potentes do que o metilenodioxi. A razão são as interações estéricas desfavoráveis dos análogos do etilenodioxi com a enzima.
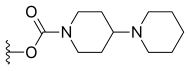
A adição de grupo amino ou cloro na 9ª posição ou grupo clorometil na 7ª posição a estes análogos 10, 11-metilenodioxi ou etilenodioxi resulta em compostos com citotoxicidade ainda maior, mas solubilidade mais fraca em água. Para produzir análogos de 10, 11-metilenodioxi ou etilenodioxi com boa solubilidade em água, uma boa maneira é introduzir um substituinte solubilizante em água na posição 7. O lurtotecano cumpre esses requisitos; é um análogo 10,11-etilenodioxi com um 4-metilpiperazino-metileno na posição 7 e tem mostrado grande potência em pesquisas clínicas.
Um anel também pode ser formado entre as posições 7 e 9, como as posições 10 e 11. Isso dá novas oportunidades para fazer derivados solúveis em água [5]. Este CPT hexacíclico se torna mais ativo quando grupos de retirada de elétrons são colocados na posição 11 e grupos metil ou amino em 10. Exatecan é um exemplo de CPT hexacíclico que tem um anel de 6 membros sobre a posição 7 e 9, e é 10-metil, 11 -fluoro substituído [4]. É solúvel em água e mais potente do que o topotecano.
Modificação do anel C e D
Os anéis C e D têm um papel essencial na atividade antitumoral. A substituição em qualquer posição resulta em um composto muito menos potente do que o composto original em outro ensaio de citotoxicidade.
Modificações de anel E
O anel E não permite muitas mudanças estruturais sem perder a atividade do CPT porque é necessário para se ligar ao sítio ativo do TOP I. Uma possível substituição é mudar o grupo hidroxila para Cl, F ou Br porque sua polarizabilidade é suficiente para estabilizar o complexo enzimático.
Outra modificação possível é inserir um metileno entre hidroxil e lactona no anel E produzindo um grupo β-hidroxilactona de sete membros, denominado homocamptotecina (hCPT). A hidroxila do hCPT tem menos efeito indutivo no grupo carboxila, o que torna a lactona muito reativa. Isso aumenta a interação do grupo hidroxila livre de forma otimizada com a topoisomerase I e o complexo covalente que se forma em sua presença é mais estável. O anel E do hCPT abre mais lentamente e a abertura é irreversível . Os hCPTs exibem estabilidade aumentada no plasma humano devido à diminuição da ligação às proteínas e mais afinidade para os glóbulos vermelhos do que o CPT.
Análogos de CPT
Desde a descoberta do CPT, muitos análogos foram sintetizados. Abaixo está uma visão esquemática dos análogos do CPT que foram mencionados no texto acima.
 |
||||
| Análogo | R 1 | R 2 | R 3 | R 4 |
| Topotecano | —H |

|
-OH | —H |
| Irinotecano (CPT-11) |
|
—H |
|
—H |
| Silatecan (DB-67, AR-67) |
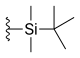
|
—H | -OH | —H |
| Cositecan (BNP-1350) |

|
—H | —H | —H |
| Exatecan |

|
—CH 3 | —F | |
| Lurtotecan |

|
—H |

|
|
| Gimatecan (ST1481) |

|
—H | —H | —H |
| Belotecan (CKD-602) |

|
—H | —H | —H |
| Rubitecano | —H |
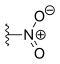
|
—H | —H |
O CPT está ligado a um polímero à base de ciclodextrina para formar o medicamento anticancerígeno experimental CRLX101 .
Biossíntese
Como todos os outros alcalóides indólicos monoterpenóides, a biossíntese da camptotecina requer a produção da estritosidina. A estrictosidina é sintetizada por meio da reação de condensação entre a tripamina da via do chiquimato e a secologanina da via do mevalonato (MVA) ou via não-mevalonato (MEP). A estrictosidina então sofre ciclização intermolecular para produzir estrito-amida, que é convertida em camptotecina por meio de uma série de reações de oxidação por enzimas que ainda precisam ser resolvidas.
A via do shiquimato que leva à biossíntese da triptamina é mais conhecida. Primeiro, o corismato é convertido em antranilato pela subunidade alfa da antranilato sintase (ASA). O antranilato reage com o pirrofosfato de 5-fosforibose para produzir o 5-fosforibosilantranilato. Em seguida, esse intermediário é convertido em fosfato de glicerol indol, que interage com a subunidade alfa do triptofano (TSA) sintase para produzir indol. A subunidade beta da triptofano sintase (TSB) catalisa a condensação do indol com serina, levando ao triptofano. Na próxima etapa, a triptoamina é produzida como resultado da descarboxilação pela triptofano descarboxilase (TDC).
A síntese de secologanina começa com a reação de condensação entre piruvato e D-Gliceraldeído-3-fosfato catalisado por 1-desoxi-D-xilulose-5-fosfato sintase (DXS) para produzir 1-desoxi-D-xilulose-5-fosfato (DXP). A conversão de DXP em difosfato de isopentenil (IPP), que é o precursor da biossíntese de terpenóide comum envolve 1-desoxi-D-xilulose-5-fosfato redutoisomerase (DXR) e 1-hidroxi-2-metil-2 (E) -butenil- 4-difosfato redutase (HDR). A formação de IPP pode ser alcançada pelas vias MVA e MEP. A condensação de IPP e difosfato de dimetilalil (DMAPP) produz difosfato de geranil (GPP). A geraniol sintase (GS) então converte GPP em geraniol. A conversão do geraniol em secologanina ocorre por meio de várias reações enzimáticas. Com base em estudos com marcação radioativa e inibidores específicos da via, a via MEP é a fonte primária de secologanina.
A triptamina da via do shiquimato e a secologanina da via do MVA ou MEP são convertidas em estritosidina por meio de uma reação de condensação catalisada pela estritoidina sintase. Embora não esteja totalmente resolvido, foi postulado que a camptotecina é produzida a partir de estritosidina via estritosamida, 3 (S) -pumilosídeo e 3 (S) -desoxipumilosídeo.






