Formato de amônio - Ammonium formate

|
|

|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Formato de amônio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100,007,959 |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C H 5 N O 2 | |
| Massa molar | 63,056 g · mol −1 |
| Aparência | Cristais monoclínicos brancos, deliquescentes |
| Odor | Ligeiramente amoníaco |
| Densidade | 1,26 g / cm 3 |
| Ponto de fusão | 116 ° C (241 ° F; 389 K) |
| Ponto de ebulição | 180 ° C (356 ° F; 453 K) se decompõe |
| (gramas por 100g de água) 102g (0 ° C) 142,7 g (20 ° C) 202,4 g (40 ° C) 516 g (80 ° C) |
|
| Solubilidade em outros solventes | Solúvel em amônia líquida , álcool , éter dietílico |
| Termoquímica | |
| -556,18 kJ / mol | |
| Perigos | |
| Ficha de dados de segurança | JT Baker MSDS |
| Pictogramas GHS |

|
| Palavra-sinal GHS | Aviso |
| H315 , H319 , H335 | |
| P261 , P305 + 351 + 338 | |
| NFPA 704 (diamante de fogo) | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
410 mg / kg (camundongos, intravenoso) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O formato de amônio , NH 4 HCO 2 , é o sal de amônio do ácido fórmico . É um sólido cristalino , higroscópico e incolor .
Aminação redutiva
A acetona pode ser transformada em isopropilamina da seguinte forma:
- CH 3 C (O) CH 3 + 2 HCO 2 - + NH 4 → (CH 3 ) 2 CHNHCHO + 2 H 2 O + NH 3 + CO 2
- (CH 3 ) 2 CHNHCHO + H 2 O → (CH 3 ) 2 CHNH 2 + HCO 2 H
Usos
O formato de amônio puro se decompõe em formamida e água quando aquecido, e este é seu principal uso na indústria. O ácido fórmico também pode ser obtido pela reação do formato de amônio com um ácido diluído e, uma vez que o formato de amônio também é produzido a partir do ácido fórmico, pode servir como uma forma de armazenar o ácido fórmico.
O formato de amônio também pode ser usado na redução de grupos funcionais de paládio sobre carbono (Pd / C). Na presença de Pd / C, o formato de amônio se decompõe em hidrogênio , dióxido de carbono e amônia . Este gás hidrogênio é adsorvido na superfície do metal paládio , onde pode reagir com vários grupos funcionais. Por exemplo, alcenos podem ser reduzidos a alcanos , formaldeído a metanol e compostos nitro a aminas . Ligações simples ativadas a heteroátomos também podem ser substituídas por hidrogênios ( hidrogenólise ).
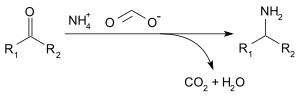
O formato de amônio pode ser usado para aminação redutiva de aldeídos e cetonas ( reação de Leuckart ), pela seguinte reação:
O formato de amônio pode ser usado como tampão em cromatografia líquida de alto desempenho (HPLC) e é adequado para uso com cromatografia líquida-espectrometria de massa (LC / MS). Os valores de p K a do ácido fórmico e do íon amônio são 3,8 e 9,2, respectivamente.
Reações
Quando aquecido, o formato de amônio elimina a água, formando a formamida . Após aquecimento adicional, ele forma cianeto de hidrogênio (HCN) e água. Uma reação colateral disso é a decomposição da formamida em monóxido de carbono (CO) e amônia.
Referências
links externos
![]() Mídia relacionada ao formato de amônio no Wikimedia Commons
Mídia relacionada ao formato de amônio no Wikimedia Commons