Estabilização sináptica - Synaptic stabilization
A estabilização sináptica é crucial nos sistemas nervoso em desenvolvimento e adulto e é considerada um resultado da fase tardia da potenciação de longo prazo (LTP). O mecanismo envolve o fortalecimento e a manutenção de sinapses ativas por meio do aumento da expressão de elementos da matriz citoesquelética e extracelular e proteínas-esqueleto pós-sinápticas , enquanto poda as menos ativas. Por exemplo, as moléculas de adesão celular (CAMs) desempenham um grande papel na manutenção e estabilização sináptica. Gerald Edelman descobriu as CAMs e estudou sua função durante o desenvolvimento, o que mostrou que as CAMs são necessárias para a migração celular e a formação de todo o sistema nervoso. No sistema nervoso adulto, as CAMs desempenham um papel integral na plasticidade sináptica relacionada ao aprendizado e à memória .
Tipos de CAMs
SynCAMs
As moléculas de adesão de células sinápticas (CAMs) desempenham um papel crucial na localização dos axônios e no estabelecimento sináptico entre os neurônios durante o neurodesenvolvimento e são membros integrantes de muitos processos sinápticos, incluindo o alinhamento correto das vias de transdução de sinal pré e pós-sináptica , reciclagem vesicular em relação à endocitose e exocitose , integração de receptores pós-sinápticos e ancoragem ao citoesqueleto para garantir a estabilidade dos componentes sinápticos
SynCAM (também conhecido como Cadm ou moléculas semelhantes à nectina) são um tipo específico de CAM sináptico encontrado em vertebrados que promove o crescimento e a estabilização de sinapses excitatórias (não inibitórias). As SynCAMs estão localizadas principalmente no cérebro em locais pré e pós-sinápticos e suas estruturas consistem em domínios de ligação FERM e PDZ intracelulares, um único domínio transmembranar e três domínios extracelulares de Ig . Durante o neurodesenvolvimento, os SynCAMs como o SynCAM1 agem como "sensores de contato" dos cones de crescimento axonal que se acumulam rapidamente quando as conexões axodendríticas são feitas e ajudam a formar um complexo de adesão estável .
synCAM1 juntamente com a neuroligina são as duas CAMs conhecidas por serem suficientes para iniciar a formação de terminais pré-sinápticos, uma vez que a adição de synCAM1 ao meio de células neuronais e não neuronais co-cultivadas leva ao estabelecimento de terminais pré-sinápticos. A ligação homofílica de duas moléculas synCAM1 nos filópodes do cone de crescimento axonal e da coluna dendrítica permite que o contato inicial entre as células pré e pós-sinápticas seja feito.
synCAMs pertencem à superfamília de proteínas Ig . Os domínios PDZ citosólicos de synCAMs embutidos na membrana pós-sináptica interagem com a proteína - esqueleto pós-sináptica PSD-95 que ajuda a ancorar o complexo ao citoesqueleto subjacente.
Caderina-catenina
As caderinas são moléculas de adesão celular homofílicas, dependentes de cálcio, que formam complexos com parceiros citosólicos conhecidos como cateninas . Os componentes desse complexo se ligam a várias proteínas de arcabouço, fosfotases, quinases e receptores diferentes. As caderinas clássicas têm cinco estruturas repetitivas extracelulares que se ligam ao cálcio, um único domínio transmembranar e uma cauda intracelular com um domínio citosólico distal que se liga a um parceiro catenina. Trabalhos recentes implicaram o complexo caderina-catenina em vários processos diferentes do sistema nervoso central, como estabilização sináptica e plasticidade .
Muitas caderinas no sistema nervoso central exibem padrões de expressão espacial e temporal distintos. Por exemplo, a N-caderina é amplamente expressa na sinapse em desenvolvimento e mais tarde permanece perto da zona ativa madura, implicando que este complexo pode ser bem adequado para fornecer uma ligação entre mudanças estruturais e estabilidade sináptica. Na verdade, as alterações da atividade sináptica local impactam a expressão dos complexos caderina-catenina . Um aumento na atividade em uma coluna específica leva à dimerização da N-caderina, que é então clivada levando à repressão da transcrição CBP / CREB . Essa repressão tem muitas implicações relacionadas ao desenvolvimento e à plasticidade.
No caso da formação e poda de espinha dendrítica , uma hipótese de competição foi proposta e corroborada. Essa hipótese sugere que os níveis relativos de complexos caderina-catenina, que são distribuídos entre as espinhas em uma área local de maneira dependente da atividade, determinam o destino de espinhas individuais. Ou seja, a competição entre espinhas por β-catenina determina se uma espinha será amadurecida (aumento do número de complexos) ou podada (diminuição do número de complexos). Este é um mecanismo crítico durante o refinamento do circuito cortical que ocorre ao longo do desenvolvimento.
Nectina
As nectinas são uma família distinta de moléculas de adesão celular . Esses CAMs estão envolvidos no contato inicial de processos neuronais pré - sinápticos e pós-sinápticos durante a formação de sinapses. Existem apenas quatro nectinas bem caracterizadas na sinapse , elas são Nectina-1, 2, 3 e 4. Todas as nectinas ligadas à membrana possuem uma região extracelular com três alças semelhantes a imunoglobulinas. O loop mais distante da membrana é chamado de loop do tipo V e os dois loops mais internos são do tipo C2. Várias nectinas em uma membrana celular se ligam na alça do tipo V para formar um agrupamento de proteínas de nectina, um processo chamado cis-agrupamento . Quando duas células que possuem grupos cis individuais entram em contato, elas formam um forte complexo denominado trans-interação que fornece adesão e, em alguns casos, sinalização entre as duas células.
O conhecimento mais robusto do papel da nectina na estabilização sináptica vem das sinapses feitas entre terminais de fibra musgosa e dendritos de células piramidais na região CA3 do hipocampo . As nectinas envolvidas na formação e estabilização desta sinapse são Nectina-1 e Nectina-3 que se projetam da membrana plasmática da célula pós-sináptica e da célula pré-sináptica, respectivamente, formando contatos extracelulares heterofílicos . O domínio intracelular de todas as nectinas liga-se diretamente a uma proteína chamada L- Afadina . A L-Afadina é uma proteína de ligação à actina que se liga à F-actina do citoesqueleto de actina . Desta forma, as nectinas formam conexões estriadas da arquitetura de actina das células, permitindo que a sinapse se desenvolva em um ambiente controlado e estável.
À medida que as sinapses amadurecem na região CA3, as nectinas e as caderinas, que se afiliam intimamente umas às outras na estabilização sináptica, são deslocadas para a periferia da zona ativa e formam a junção puncta aderens (PAJ). O PAJ funciona de forma muito semelhante às junções aderentes nos tecidos epiteliais . O deslocamento desses CAMs e a formação dessa junção fornecem às membranas sinápticas nascentes espaço para interagir e amadurecer enquanto se separam da membrana circundante e fornecem a fixação citoesquelética.
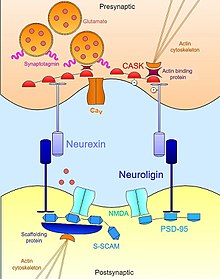
Neurexin-neuroligin
As interações Neurexin - Neuroligin ajudam a estabelecer a assimetria funcional trans-sináptica essencial para a estabilização e manutenção da transmissão sináptica adequada . A neurexina pré-sináptica e sua parceira de ligação pós-sináptica, a neuroligina, complexam-se no início do desenvolvimento neural e são ambos indutores potentes da sinaptogênese . As células não neuronais que expressam neurexina artificialmente são suficientes para mobilizar especializações pós-sinápticas em neurônios co-cultivados; células que expressam neuroligina são igualmente capazes de induzir marcadores de diferenciação pré-sináptica em neurônios vizinhos. No entanto, embora ambas desempenhem um papel importante na sinaptogênese, essas moléculas de adesão celular não são necessárias para a formação de conexões neuronais durante o desenvolvimento. Um mutante de camundongo nocaute triplo de neurexinas ou neuroliginas exibe um número normal de sinapses, mas expressa um fenótipo letal embrionário devido ao comprometimento da transmissão sináptica normal. Portanto, eles não são necessários para a formação de sinapses per se, mas são essenciais para a maturação e integração de sinapses nos circuitos funcionais necessários para a sobrevivência.
Além do contato extracelular entre si, as neurexinas e neuroliginas também se ligam intracelularmente a uma vasta rede de proteínas adaptadoras e estruturas de suporte, que em conjunto com o citoesqueleto de actina , ajudam a localizar os componentes necessários da transmissão sináptica. Por exemplo, a primeira neuroligina ( NLGN1 ) descoberta foi identificada por seu domínio PDZ que se liga a PSD95 , uma proteína-esqueleto bem conhecida nas sinapses glutamatérgicas que liga funcionalmente os receptores NMDA ao local pós-sináptico adequado. Da mesma forma, outra isoforma de neuroligina ( NLGN2 ) interage com a gefirina , uma proteína de arcabouço específica para as sinapses GABAérgicas , e é responsável pela ativação da proteína adaptadora sináptica colibistina . No caso das neurexinas, suas interações de ligação intracelular são igualmente importantes no recrutamento da maquinaria essencial para a transmissão sináptica na zona ativa. Como as neuroliginas, as neurexinas possuem um domínio PDZ que se associa com CASK ( proteína quinase dependente de cálcio-calmodulina ). Além de fosforilar a si mesma e a neurexina, o CASK promove interações entre as neurexinas e as proteínas de ligação à actina, proporcionando assim uma ligação direta pela qual a neurexina pode modular a dinâmica do citoesqueleto, essencial para a estabilidade e plasticidade sináptica. Neurexin também pode ligar a sinaptotagmina , uma proteína embutida na membrana das vesículas sinápticas, e também pode promover associações com o canal de cálcio controlado por voltagem que medeia o fluxo de íons necessário para a exocitose do neurotransmissor após a estimulação sináptica. Desta forma, a neurexina e a neuroligina coordenam os aspectos morfológicos e funcionais da sinapse que, por sua vez, permite que contatos nascentes e imaturos se estabilizem em plataformas funcionais completas para a neurotransmissão.
Sinalização Efrina-Eph
Moléculas de adesão não tradicionais, como as efrinas , também ajudam a estabilizar os contatos sinápticos. Os receptores Eph e seus ligantes ligados à membrana, as efrinas, estão envolvidos em uma variedade de processos celulares durante o desenvolvimento e a maturação, incluindo a orientação do axônio , a migração neuronal , a sinaptogênese e a poda do axônio . No hipocampo , a morfologia da coluna dendrítica pode ser regulada por astrócitos via sinalização bidirecional efrina / EphA. Astrócitos e seus processos expressam efrina A3 , enquanto o receptor EphA4 é enriquecido em neurônios do hipocampo. Essa interação, mediada pela sinalização de efrina A3 / EphA4, induz o recrutamento e ativação da quinase 5 dependente de ciclina (Cdk5), que então fosforila o fator de troca de guanina (GEF), a ephexina1. A ephexina1 fosforilada pode então ativar a pequena GTPase , RhoA , levando à ativação subsequente de seu efetor, Rho-quinase (ROCK), que resulta no rearranjo dos filamentos de actina. Por meio desse mecanismo, os processos astrocíticos são capazes de estabilizar as protrusões dendríticas individuais, bem como sua maturação em espinhas por meio da sinalização efrina / EphA. A sinalização direta envolvendo a ativação de EphA4 resulta na estabilização de proteínas sinápticas na junção neuromuscular . Como na interação neurônio-glia mediada por EphA4 / efrinaA3, esse processo regula a dinâmica do citoesqueleto de actina ativando ROCK por meio de efexina.
A sinalização Efrina B / EphB também está envolvida na estabilização sináptica por meio de diferentes mecanismos. Essas moléculas contêm caudas citoplasmáticas que interagem com as proteínas de arcabouço por meio de seus domínios PDZ para estabilizar as sinapses do SNC recém-formadas. Por exemplo, Ephrin B3 interage com a proteína adaptadora glutamato-receptor-proteína 1 interagindo (GRIP-1) para regular o desenvolvimento de sinapses dendríticas eixo excitatórias. Este processo, que foi identificado em culturas de neurônios do hipocampo, revelou que a sinalização reversa de Eph / efrina B3 recruta GRIP1 para a membrana do eixo pós-sináptico. Uma vez na haste da membrana, GRIP1 ajuda a ancorar os receptores de glutamato abaixo do terminal pré-sináptico. Esse processo também envolve a fosforilação de um resíduo de serina próximo ao terminal carboxila efrina-B (proximal ao motivo de ligação ao PDZ) que leva à estabilização dos receptores AMPA nas sinapses.
Outro mecanismo, encontrado em neurônios do hipocampo, revelou que a sinalização de EphB poderia promover a maturação da coluna por meio da modulação da atividade de Rho GTPase, conforme observado com EphAs. Ao contrário dos EphAs, no entanto, o receptor EphB2 demonstrou interagir com os receptores pós - sinápticos N-metil-D-aspartato (NMDARs) para recrutar o GEF Tiam1 para o complexo após a ligação do efrinaB. A fosforilação de Tiam1 ocorre em resposta à atividade NMDAR, que permite o influxo de cálcio que ativa Tiam1. Esse mecanismo também resulta na modulação do citoesqueleto de actina. Como resultado dessa estabilização, a sinalização direta de EphB2 e a sinalização reversa de efrina-B3 foram encontradas para induzir LTP via NMDARs.