Extração de fluido supercrítico - Supercritical fluid extraction
Extração com fluido supercrítico (SFE) é o processo de separação de um componente (o extrator) de outro (a matriz) usando fluidos supercríticos como solvente de extração . A extração é geralmente de uma matriz sólida , mas também pode ser de líquidos . O SFE pode ser usado como uma etapa de preparação de amostra para fins analíticos ou em uma escala maior para retirar material indesejado de um produto (por exemplo, descafeinação ) ou coletar um produto desejado (por exemplo, óleos essenciais ). Esses óleos essenciais podem incluir limoneno e outros solventes simples. O dióxido de carbono (CO 2 ) é o fluido supercrítico mais usado, às vezes modificado por co-solventes como etanol ou metanol . As condições de extração do dióxido de carbono supercrítico estão acima da temperatura crítica de 31 ° C e da pressão crítica de 74 bar . A adição de modificadores pode alterar isso ligeiramente. A discussão abaixo se referirá principalmente à extração com CO 2 , exceto onde especificado.
Vantagens
Seletividade
As propriedades do fluido supercrítico podem ser alteradas variando a pressão e a temperatura, permitindo a extração seletiva. Por exemplo, óleos voláteis podem ser extraídos de uma planta com baixas pressões (100 bar), enquanto a extração líquida também removeria os lipídios. Os lípidos podem ser removidos utilizando puro CO 2 a pressões mais elevadas, e, em seguida, fosfolípidos pode ser removido pela adição de etanol ao solvente. O mesmo princípio pode ser usado para extrair polifenóis e ácidos graxos insaturados separadamente dos resíduos do vinho.
Velocidade
A extração é um processo baseado na difusão , no qual o solvente é necessário para se difundir na matriz e o material extraído para se difundir da matriz para o solvente. As difusividades são muito mais rápidas em fluidos supercríticos do que em líquidos e, portanto, a extração pode ocorrer mais rapidamente. Além disso, devido à falta de tensão superficial e viscosidades desprezíveis em comparação com os líquidos, o solvente pode penetrar mais na matriz inacessível aos líquidos. Uma extração com um líquido orgânico pode levar várias horas, enquanto a extração com fluido supercrítico pode ser concluída em 10 a 60 minutos.
Limitações
A exigência de altas pressões aumenta o custo em comparação com a extração de líquido convencional, de modo que o SFE só será usado onde houver vantagens significativas. O dióxido de carbono em si é apolar e tem um poder de dissolução um tanto limitado, então nem sempre pode ser usado como solvente por conta própria, particularmente para solutos polares. O uso de modificadores aumenta a gama de materiais que podem ser extraídos. Modificadores de grau alimentício, como o etanol, podem frequentemente ser usados e também podem ajudar na coleta do material extraído, mas reduzem alguns dos benefícios do uso de um solvente gasoso à temperatura ambiente.
Procedimento
O sistema deve conter uma bomba para o CO 2 , uma célula de pressão para conter a amostra, um meio de manter a pressão no sistema e um recipiente coletor. O líquido é bombeado para uma zona de aquecimento, onde é aquecido em condições supercríticas. Em seguida, ele passa para o recipiente de extração, onde rapidamente se difunde na matriz sólida e dissolve o material a ser extraído. O material dissolvido é varrido da célula de extração para um separador a uma pressão mais baixa e o material extraído se deposita. O CO 2 pode então ser resfriado, comprimido novamente e reciclado, ou descarregado na atmosfera.
Bombas
Dióxido de carbono ( CO
2 ) é normalmente bombeado como um líquido, geralmente abaixo de 5 ° C (41 ° F) e a uma pressão de cerca de 50 bar. O solvente é bombeado como um líquido, pois é quase incompressível; se fosse bombeado como um fluido supercrítico, grande parte do curso da bomba seria "usado" para comprimir o fluido, em vez de bombeá-lo. Para extrações em pequena escala (até alguns gramas / minuto), CO recíproco
2 bombas ou bombas de seringa são freqüentemente usadas. Para extrações em grande escala, as bombas de diafragma são as mais comuns. As cabeças da bomba geralmente requerem resfriamento, e o CO 2 também será resfriado antes de entrar na bomba.
Vasos de pressão
Os vasos de pressão podem variar de tubos simples a vasos mais sofisticados construídos para esse fim com conexões de liberação rápida. O requisito de pressão é de pelo menos 74 bar, e a maioria das extrações são conduzidas abaixo de 350 bar. No entanto, às vezes serão necessárias pressões mais altas, como a extração de óleos vegetais, onde às vezes são necessárias pressões de 800 bar para a completa miscibilidade das duas fases .
A embarcação deve estar equipada com um meio de aquecimento. Ele pode ser colocado dentro de um forno para recipientes pequenos, ou uma camisa de óleo ou eletricamente aquecido para recipientes maiores. Deve-se ter cuidado se selos de borracha forem usados no vaso, pois o dióxido de carbono supercrítico pode se dissolver na borracha, causando inchaço, e a borracha se romperá na despressurização.
Manutenção de pressão
A pressão no sistema deve ser mantida desde a bomba até o vaso de pressão. Em sistemas menores (até cerca de 10 mL / min), um restritor simples pode ser usado. Pode ser um tubo capilar cortado no comprimento certo ou uma válvula de agulha que pode ser ajustada para manter a pressão em diferentes taxas de fluxo. Em sistemas maiores, será usado um regulador de contrapressão , que mantém a pressão a montante do regulador por meio de uma mola, ar comprimido ou válvula acionada eletronicamente. Qualquer que seja o utilizado, deve-se fornecer aquecimento, pois a expansão adiabática do CO 2 resulta em um resfriamento significativo. Isso é problemático se água ou outro material extraído estiver presente na amostra, pois isso pode congelar no restritor ou válvula e causar bloqueios.
Coleção
O solvente supercrítico é passado para um vaso a uma pressão mais baixa do que o vaso de extração. A densidade e, portanto, o poder de dissolução dos fluidos supercríticos varia nitidamente com a pressão e, portanto, a solubilidade no CO 2 de densidade mais baixa é muito mais baixa e o material precipita para a coleta. É possível fracionar o material dissolvido usando uma série de vasos com pressão reduzida. O CO 2 pode ser reciclado ou despressurizado à pressão atmosférica e ventilado. Para SFE analítico, a pressão geralmente cai para a atmosférica e o dióxido de carbono agora gasoso borbulha através de um solvente para aprisionar os componentes precipitados.
Aquecimento e refrigeração
Este é um aspecto importante. O fluido é resfriado antes do bombeamento para manter as condições do líquido e, em seguida, aquecido após a pressurização. À medida que o fluido é expandido para o separador, o calor deve ser fornecido para evitar o resfriamento excessivo. Para extrações em pequena escala, como para fins analíticos, geralmente é suficiente pré-aquecer o fluido em um tubo dentro do forno que contém a célula de extração. O restritor pode ser aquecido eletricamente, ou mesmo aquecido com um secador de cabelo. Para sistemas maiores, a energia necessária durante cada estágio do processo pode ser calculada usando as propriedades termodinâmicas do fluido supercrítico.
Modelo simples de SFE
Existem duas etapas essenciais para o SFE, o transporte (por difusão ou de outra forma) das partículas sólidas para a superfície e a dissolução no fluido supercrítico. Outros fatores, como a difusão na partícula pelo SF e a liberação reversível , como a dessorção de um sítio ativo, às vezes são significativos, mas não são tratados em detalhes aqui. A Figura 2 mostra as etapas durante a extração de uma partícula esférica, onde no início da extração o nível de extratante é igual em toda a esfera (Fig. 2a). Quando a extração começa, o material é inicialmente extraído da borda da esfera e a concentração no centro permanece inalterada (Fig. 2b). À medida que a extração progride, a concentração no centro da esfera diminui à medida que o extrator se difunde em direção à borda da esfera (Figura 2c).
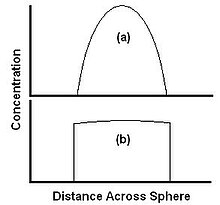
As taxas relativas de difusão e dissolução são ilustradas por dois casos extremos na Figura 3. A Figura 3a mostra um caso em que a dissolução é rápida em relação à difusão. O material é levado para longe da borda mais rápido do que pode se difundir do centro, de modo que a concentração na borda cai para zero. O material é levado tão rápido quanto chega à superfície, e a extração é totalmente limitada à difusão. Aqui, a taxa de extração pode ser aumentada aumentando a taxa de difusão, por exemplo, aumentando a temperatura, mas não aumentando a taxa de fluxo do solvente. A Figura 3b mostra um caso em que a solubilidade é baixa em relação à difusão. O extratante é capaz de se difundir para a borda mais rápido do que pode ser levado pelo solvente, e o perfil de concentração é plano. Neste caso, a taxa de extração pode ser aumentada aumentando a taxa de dissolução, por exemplo, aumentando a taxa de fluxo do solvente.
A curva de extração de% de recuperação em relação ao tempo pode ser usada para elucidar o tipo de extração que está ocorrendo. A Figura 4 (a) mostra uma curva de difusão controlada típica. A extração é inicialmente rápida, até que a concentração na superfície caia para zero, e a taxa então se torna muito mais lenta. A% extraída eventualmente se aproxima de 100%. A Figura 4 (b) mostra uma curva para uma extração de solubilidade limitada. A taxa de extração é quase constante e só se estabiliza no final da extração. A Figura 4 (c) mostra uma curva onde há efeitos de matriz significativos, onde há algum tipo de interação reversível com a matriz, como dessorção de um sítio ativo. A recuperação torna-se mais plana e, se o valor de 100% não for conhecido, é difícil dizer que a extração não está completa.
Otimização
O ótimo dependerá do propósito da extração. Para que uma extração analítica determine, digamos, o conteúdo antioxidante de um polímero , os fatores essenciais são a extração completa no menor tempo possível. No entanto, para a produção de um extrato de óleo essencial de uma planta, a quantidade de CO 2 usada será um custo significativo e a extração "completa" não será necessária, um rendimento de 70 a 80% talvez seja suficiente para fornecer retorno econômico. Em outro caso, a seletividade pode ser mais importante, e uma taxa de extração reduzida será preferível se ela fornecer maior discriminação. Portanto, poucos comentários podem ser feitos que sejam universalmente aplicáveis. No entanto, alguns princípios gerais são descritos abaixo.
Maximizando a difusão
Isso pode ser conseguido aumentando a temperatura, dilatando a matriz ou reduzindo o tamanho das partículas. O intumescimento da matriz às vezes pode ser aumentado aumentando a pressão do solvente e adicionando modificadores ao solvente. Alguns polímeros e elastômeros em particular são aumentados dramaticamente pelo CO 2 , com a difusão sendo aumentada em várias ordens de magnitude em alguns casos.
Maximizando a solubilidade
Geralmente, a pressão mais alta aumenta a solubilidade. O efeito da temperatura é menos certo, pois próximo do ponto crítico, o aumento da temperatura causa diminuições na densidade e, portanto, dissolvendo o poder. Em pressões bem acima da pressão crítica , é provável que a solubilidade aumente com a temperatura. A adição de baixos níveis de modificadores (às vezes chamados de entrainers), como metanol e etanol, também pode aumentar significativamente a solubilidade, particularmente de compostos mais polares.
Otimizando a taxa de fluxo
A taxa de fluxo de dióxido de carbono supercrítico deve ser medida em termos de fluxo de massa, e não por volume, porque a densidade do CO
2 muda de acordo com a temperatura antes de entrar nas cabeças da bomba e durante a compressão. Os medidores de fluxo Coriolis são mais bem usados para obter essa confirmação de fluxo. Para maximizar a taxa de extração, a taxa de fluxo deve ser alta o suficiente para que a extração seja completamente limitada pela difusão (mas isso representará um grande desperdício de solvente). No entanto, para minimizar a quantidade de solvente usado, a extração deve ser completamente limitada à solubilidade (o que levará muito tempo). A vazão deve, portanto, ser determinada dependendo dos fatores concorrentes de tempo e custos de solvente, e também dos custos de capital de bombas, aquecedores e trocadores de calor. A taxa de fluxo ideal provavelmente estará em algum lugar na região onde a solubilidade e a difusão são fatores significativos.
Veja também
Referências
Leitura adicional
- McHugh, Mark A .; Krukonis, Val J. (1994). Extração de Fluido Supercrítico - Princípios e Prática . Butterworth Heinemann series in chemical engineering (2ª ed.). Butterworth Heinemann. ISBN 978-0-7506-9244-1 .
- Taylor, Larry T. (1996). Extração de fluido supercrítico . Técnicas de química analítica. John Wiley and Sons, Inc. ISBN 978-0-471-11990-6 .