Reações de organoborates e boranos - Reactions of organoborates and boranes
As reacções de organoborates e boranos envolvem a transferência de um grupo nucleofílico ligado ao boro a um centro electrofílico quer inter- ou intramoleculares. α, boratos β-Usaturated, bem como boratos com um grupo que se despede na posição α, são altamente susceptíveis à intramolecular 1,2-migração de um grupo de boro para a posição α electrofílico. Oxidação ou protonólise das organoboranos resultantes podem gerar uma variedade de produtos orgânicos, incluindo álcoois, compostos de carbonilo, alcenos, e halogenetos.
Conteúdo
Introdução
Organoboranos (R 3 B) e boratos (R 4 B - , gerado através da adição de R - R 3 B) possuem ligações boro-carbono, que são polarizados para carbono. Assim, o carbono ligado ao boro é nucleofílico, e em boratos esta propriedade pode ser aproveitada para transferir um dos grupos R a um centro electrofílico quer inter- ou (mais frequentemente) intramolecularmente. Neste último caso, o grupo R nucleofílico é capaz de sofrer 1,2-migração para um carbono electrofílico ligado a boro. O borano reorganizado resultante pode então ser oxidado ou submetido a protonólise para produzir produtos biológicos. Exemplos abrangidos neste artigo são mostrados abaixo.
(1)

Hidroborao de alcenos ou alcinos é um método eficiente para a produção de boranos; no entanto, a utilização de borano (BH 3 ) ou equivalentes de borano leva à conversão de apenas 33% da olefina de partida no produto após oxidação ou protonólise-olefina remanescente é incorporado em subprodutos contendo boro. A utilização de uma quantidade estequiométrica de 9-borabiciclo [3.3.1] nonano (9-BBN) como o reagente de hidroboração proporciona uma solução para este problema.
Mecanismo e estereoquímica
prevalecente mecanismos
Boranos sozinho geralmente não são nucleófilos suficiente para transferir um grupo alquilo a um centro electrofílico. No entanto, depois de ataque nucleofílico, o borato resultante é altamente nucleofílica. Se o nucleófilo contém funcionalidade insaturada ou um grupo de saída na posição α, um dos grupos R ligados aos boro é capaz de migrar para o carbono electrofílico α (ver equação (2) abaixo). A propensão de um grupo orgânico para migrar depende da sua capacidade para estabilizar a carga negativa: alcinilo> arilo ≈ alcenilo> alquilo primário> alquilo secundário> alquilo terciário. A migração ocorre com retenção de configuração no átomo de carbono a migração e inversão de configuração no terminal migração (desde que seja sp 3 hibridada). Bis (norbornilo) borano e 9-BBN são muitas vezes usados como "falsos" reagentes hidroborao para esta única razão pela qual o grupo R-derivado da olefina hidroborado é susceptível de migrar após activação nucleofílico.
(2)

enolatos a-halo são comumente usados como nucleófilos neste contexto. Depois de ataque nucleofílico em boro, o ketoboronate resultante rearranja para um enolborane neutro. Após a protonólise, um funcionalizado resultados composto de carbonilo. Os enolboranes intermédios também podem ser extinta com electrilos.
(3)

Alkynylboronates são intermediários versáteis que podem ser convertidos em cetonas ou qualquer olefinas após a migração simultânea e ataque do alcino em um electrófilo separado. O grupo electrófilo e migrar acabar trans na alkenylborane resultante. Protonólise deste intermediário gera olefinas, enquanto a oxidação conduz a cetonas após tautomerização.
(4)

Escopo e limitações
O âmbito de organoboranos e boratos como reagentes para a síntese orgânica é extremamente ampla. As reacções de compostos de organoboro pode produzir álcoois, compostos de carbonilo, halogenetos, peróxidos, aminas, e outra funcionalidade, dependendo dos outros materiais de partida empregues e das condições de reacção. Esta secção abrange um pequeno subconjunto destes métodos, concentrando-se sobre a síntese de álcoois, compostos de carbonilo, e halogenetos.
síntese do álcool de organoboranos e boratos depende de qualquer transferência grupo nucleofílico de um grupo carbonilo ou oxidação de um intermediário de organoborano. álcoois primários homologados resultar do tratamento de organoboranos com monóxido de carbono e um hidreto.
(5)

álcoois terciários com dois grupos idênticos ligados ao carbono do álcool pode ser sintetizado através de uma reacção de duplo migração alkynylborates na presença de ácido. A utilização de um único equivalente de ácido e oxidação ou protonólise conduz a cetonas ou olefinas, respectivamente (ver secção Mecanismo e Estereoquímica acima).
(6)

A acilação de boratos é possível na presença de um halogeneto de acilo. Aqui, o borato foi gerado a partir de tri (ciclopentil) borano e fenil-lítio; os três grupos ciclopentilo estão servindo como grupos "dummy" e não migrar para uma quantidade significativa.
(7)
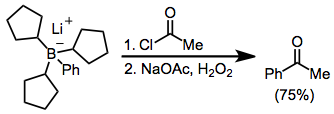
Tratamento de trialquilboranos com enolatos α-halo-cetonas leva a funcionalizado. Uma vez que a migração é estereoespecífica (retentivos com respeito ao grupo migratório e invertive no carbono α), este método proporciona um meio para a síntese de enantiopura α-alquilo ou cetonas -arilo.
(8)
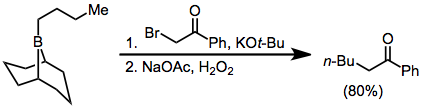
α-halo enolatos de ésteres também adicionar a boranos, eventualmente, produtos proporcionam ct-funcionalizados; no entanto, os rendimentos são ligeiramente mais baixos. Diazoestéres e diazocetonas também pode ser utilizado neste contexto, sem o requisito de base externa. α, enolatos α'-Dialo reagir com boranos para formar compostos de carbonilo α-halogéneo que podem ser adicionalmente funcionalizadas na posição α.
(9)

Halogenetos podem ser sintetizados a partir de organoboranos através da activação com hidróxido ou alcóxido e tratamento com X 2 . Dois dos três grupos de alquilo ligados ao complexo borano pode ser convertido em haleto, na presença de excesso de base, mas a utilização de disiamilborano como o reagente de hidroboração permite a halogenação selectiva de apenas a olefina hidroborado.
(10)
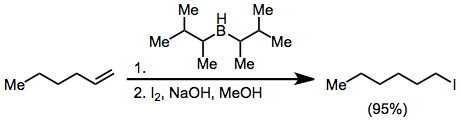
O tratamento de uma alkenylborane com iodo ou bromo leva a migração de um dos grupos orgânicos ligados ao boro. Os grupos alcinilo migrar selectivamente, formando enynes após o tratamento com acetato de sódio e peróxido de hidrogénio.
(11)

Condições e procedimento experimental
As condições típicas
A maioria dos organoboranos são instáveis ao ar, e organoboranos voláteis são espontaneamente inflamável na atmosfera. Assim, estes reagentes devem ser manuseados sob uma atmosfera inerte. Como organoboranos não pode ser eficazmente desactivada com água, eles devem ser destruídos por oxidação com peróxido de hidrogénio. Hidretos de boro deve ser temperada com água ou, se as condições mais vigorosas são necessárias ácido, aquoso, antes da introdução do peróxido de hidrogénio . Boranos são mais vulgarmente preparado por hidroborao de alcenos ou alcinos.
A escolha do reagente contendo boro é frequentemente crítico para o sucesso nessas reacções. A porção 9-BBN pode servir como um grupo não participante "fictício" em vários tipos de reacção; Além disso, a sua utilização como um reagente de hidroboração permite a conversão completa de uma olefina para produtos de transferência de grupo. THF é de longe o solvente mais comum para as reacções de organoboranos e boratos; no entanto, chloroboranes formar complexos fortes com THF. éter dietílico e outros solventes menos polares podem ser usados com estes reagentes.
exemplo procedimento
(12)

Um balão de 50 mL seco equipado com uma barra de agitação magnética e septo de entrada foi inundado com azoto. O balão foi então arrefecido a -25 ° C e carregada com 1,89 g (10 mmol) de p -chlorophenyldichloroborane em 10 mL de tetra-hidrofurano . A esta solução foi adicionado gota a gota 1,25 g (11 mmol) de diazoacetato de etilo em 10 mL de tetra-hidrofurano a uma velocidade tal (1 mL / 3-5 minutos), esse azoto foi evoluiu suavemente (cerca de 1,5 horas). A esta temperatura, foram adicionados 5 mL de água e 5 mL de metanol. Finalmente, o banho de arrefecimento foi removido. A mistura foi vertida em carbonato de sódio aquoso saturado (75 mL) e extraiu-se com três porções de 50 ml de éter. A destilação do secou-se (MgSO 4 resíduo), concentrado deu 1,80 g (91%) de acetato de p-clorofenilacetato; pb 106-107 ° (3,5 mm); p.f. 31-32 °. 1 H RMN: δ 1,34, 3,59, 4,12, 7,21, 7,29.
