Canais mecanossensíveis - Mechanosensitive channels
Canais mecanossensíveis , canais iônicos mecanossensíveis ou canais iônicos esticados (não devem ser confundidos com mecanorreceptores ). Eles estão presentes nas membranas de organismos dos três domínios da vida: bactérias, arquéias e eucariontes. Eles são os sensores para vários sistemas, incluindo os sentidos do tato, audição e equilíbrio, bem como participam da regulação cardiovascular e da homeostase osmótica (por exemplo, sede). Os canais variam em seletividade para os íons permeadores de não seletivos entre ânions e cátions em bactérias , a catiônicos seletivos, permitindo a passagem de Ca 2+ , K + e Na + em eucariotos, e canais de K + altamente seletivos em bactérias e eucariotos .
Todos os organismos, e aparentemente todos os tipos de células, sentem e respondem a estímulos mecânicos. MSCs funcionam como mecanotransdutores capazes de gerar sinais elétricos e de fluxo iônico em resposta a estímulos externos ou internos. Sob turgor extremo em bactérias, MSCs não seletivos, como MSCL e MSCS, servem como válvulas de segurança para prevenir a lise. Em células especializadas dos organismos superiores, outros tipos de MSCs são provavelmente a base dos sentidos da audição e do tato e sentem o estresse necessário para a coordenação muscular. No entanto, nenhum desses canais foi clonado. Os MSCs também permitem que as plantas distingam o alto do baixo ao sentir a força da gravidade. As CTMs não são sensíveis à pressão, mas ao estresse local, provavelmente à tensão na bicamada lipídica circundante.
História
Canais mecanossensíveis foram descobertos em 1983 no músculo esquelético do pintinho por Falguni Guharay e Frederick Sachs. Eles também foram observados (pub. 1986) em oócitos de Xenopus e freqüentemente estudados desde então. Desde então, os canais de MS foram encontrados em células de bactérias a humanos: eles agora são conhecidos por estarem presentes em todos os três domínios da vida (Archaea, Bacteria e Eukarya, incluindo plantas e fungos). Nas décadas desde a descoberta da MS, a compreensão de sua estrutura e função aumentou muito, e várias foram clonadas. Especificamente, os canais mecanossensíveis eucarióticos clonados incluem os canais de domínio 2P seletivos para K + e a família PIEZO seletiva para cátions recentemente clonados.
Classificação
MS pode ser classificado com base no tipo de íon ao qual são permeáveis.
MSCs seletivas de cátions : como o nome sugere, elas exibem uma permeabilidade seletiva para íons positivos, sendo os canais mais seletivos aqueles para K + . As MSCs eucarióticas mais comuns são catiônicas seletivas passando Na + , K + e Ca 2+, mas não Mg 2+ . Eles têm uma faixa de condutância de canal único (25-35 pS) e são bloqueados pelo íon trivalente Gadolínio. As MSCs K + seletivas, como TREK-1, não são bloqueadas por Gd 3+ .
Canais de ânions: exibem uma permeabilidade significativa para íons negativos e não são predominantes como cátions MS. Eles têm uma grande faixa de condutância (> 300pS).
Canais iônicos não seletivos: como o nome indica, eles não diferenciam entre canais positivos e negativos aqueles que são mais comuns para Archaea e Bacteria, mas raramente encontrados em Eucarya .
Em termos gerais, a maioria dos MS pode ser classificada como canais controlados por lipídios
Funções
Para uma proteína ser considerada mecanossensível, ela deve responder a uma deformação mecânica da membrana. As deformações mecânicas podem incluir mudanças na tensão, espessura ou curvatura da membrana. Os canais mecanossensíveis respondem à tensão da membrana alterando sua conformação entre um estado aberto e um estado fechado. Um tipo de canal iônico mecanicamente sensível ativa células sensoriais especializadas, como células ciliadas cocleares e alguns neurônios sensoriais de toque , em resposta a forças aplicadas a proteínas.
Os canais iônicos ativados por estiramento são úteis na formação inicial de um potencial de ação a partir de um estímulo mecânico, por exemplo, pelos mecanorreceptores nas vibrissas (bigodes) de um animal .
As fibras nervosas aferentes responsáveis pela detecção e feedback do estímulo sensorial são especialmente sensíveis à estimulação. Isso resulta das células mecanorreceptoras especializadas que são sobrepostas às fibras nervosas aferentes. Os canais iônicos ativados por estiramento estão localizados nessas células mecanorreceptoras e servem para diminuir o limiar do potencial de ação, tornando os nervos aferentes mais sensíveis à estimulação. As terminações nervosas aferentes sem células mecanorreceptoras são chamadas de terminações nervosas livres. São menos sensíveis que as fibras aferentes encapsuladas e geralmente funcionam na percepção da dor.
Os canais iônicos ativados por estiramento são responsáveis por muitas funções corporais em mamíferos. Na pele, eles são responsáveis por sentir vibração, sensação de pressão, estiramento, toque e toque leve. Eles são expressos em modalidades sensoriais, incluindo paladar, audição, olfato, sensação de calor, controle de volume e visão. Eles também podem regular as funções internas do nosso corpo, incluindo, mas não se limitando a, pressão osmótica nas células, pressão sanguínea nas veias e artérias, micção e eletrofisiologia e contratilidade do coração . Além dessas funcionalidades, os canais iônicos ativados por estiramento também estão envolvidos com o equilíbrio e a sensação proprioceptiva .
Canais que tradicionalmente são conhecidos apenas como “voltagem-“ ou “ligand-gated” também foram considerados mecanicamente sensíveis. Os canais exibem sensibilidade mecânica como uma propriedade geral. No entanto, o estresse mecânico afeta vários tipos de canais de maneiras diferentes. Os canais controlados por voltagem e ligante podem ser ligeiramente modificados por estimulação mecânica, o que pode alterar ligeiramente sua capacidade de resposta ou permeabilidade , mas ainda respondem principalmente à voltagem ou ligantes, respectivamente.
Exemplos
As diferentes famílias de canais iônicos ativados por estiramento são responsáveis por diferentes funções no corpo. A família DEG / ENaC consiste em dois subgrupos: a subfamília ENaC regula a reabsorção de Na + nos epitélios renais e pulmonares; a subfamília ASIC está envolvida no condicionamento do medo , na formação da memória e na sensação de dor . A superfamília de canais TRP é encontrada em células receptoras sensoriais que estão envolvidas na sensação de calor, paladar, olfato, tato e regulação osmótica e de volume. Os canais MscM, MscS e MscL (canais mecanossensíveis de condutância mini, pequena e grande) regulam a pressão osmótica nas células, liberando fluido intracelular quando elas se tornam muito alongadas. No corpo, um possível papel no desenvolvimento de mioblastos foi descrito. Além disso, canais iônicos mecanicamente controlados também são encontrados nos estereocílios do ouvido interno. As ondas sonoras são capazes de dobrar os estereocílios e abrir canais iônicos que levam à criação de impulsos nervosos. Esses canais também desempenham um papel na detecção de vibração e pressão por meio da ativação dos corpúsculos de Paciniano na pele.
Mecanismos de transdução
Existem dois tipos diferentes de canais ativados por estiramento entre os quais é importante distinguir: canais mecanicamente fechados, que são diretamente influenciados por deformações mecânicas da membrana, e canais mecanicamente sensíveis, que são abertos por segundos mensageiros liberados do verdadeiro portão mecanicamente canal.
Dois mecanismos diferentes foram encontrados para abrir canais iônicos ativados por estiramento: Deformações mecânicas na membrana celular podem aumentar a probabilidade de abertura dos canais. As proteínas da matriz extracelular e do citoesqueleto são amarradas a domínios extra e intracitoplasmáticos, respectivamente, dos canais iônicos ativados por estiramento. A tensão nessas proteínas mecanossensoriais faz com que essas proteínas atuem como um intermediário de sinalização, resultando na abertura do canal iônico. Todos os canais iônicos ativados por estiramento conhecidos em células procarióticas foram encontrados para serem abertos por deformação direta da membrana de bicamada lipídica . Os canais que mostraram usar exclusivamente esse mecanismo de gating são os canais TREK-1 e TRAAK . Em estudos com células ciliadas de mamíferos , o mecanismo que puxa as proteínas amarradas do domínio intra e extra-citoplasmático do canal ao citoesqueleto e à matriz extracelular, respectivamente, é o modelo mais provável para a abertura do canal iônico.
A deformação mecânica da membrana celular pode ser alcançada por uma série de intervenções experimentais, incluindo a atuação magnética de nanopartículas. Um exemplo disso é o controle do influxo de cálcio dos axônios e botões nas redes neurais. Observe que isso não é uma indicação de 'estimulação magnética' de canais mecanossensíveis.
Mecanismo de portão
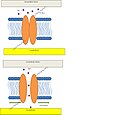
Embora a MS varie em muitos aspectos, estruturas e funções, todas as MS estudadas até agora compartilham uma característica importante: em um processo denominado gating , todas se abrem como poros quando os canais de proteínas são ativados por um estímulo mecânico. Atualmente, existem dois modelos do processo de passagem que explicam como os canais iônicos ativados por membrana se abrem.
Bicamada lipídica Modelo de tensão ou alongamento : Neste modelo, a tensão na bicamada lipídica desencadeia mudanças conformacionais, levando à abertura dos canais. A tensão percebida pela proteína vem dos lipídios. Foi demonstrado que o perfil de tensão / alongamento na bicamada lipídica é originado pela curvatura da membrana e pela incompatibilidade hidrofóbica da bicamada-proteína.
Primaveril modelo tirante : Neste modelo de uma mola do tipo tirante está ligado directamente ao canal de MS e pode estar presente quer no citoesqueleto ou a matriz extracelular que liga estes elementos juntos. Quando estímulos externos desviam a corda, o deslocamento abre o canal. Este mecanismo específico foi demonstrado ser o responsável pelo bloqueio das células ciliadas que são responsáveis pela audição em vertebrados.
MS bacteriana
Os canais bacterianos de MS foram descobertos por experimentos de patch-clamp em E. coli. Eles foram classificados com base em sua condutância em mini (MscM), pequeno (MscS) e grande ( MscL ). Esses canais funcionam no modo tandem e são responsáveis pela regulação do turgor nas bactérias; quando ativado por mudanças na pressão osmótica. MscM é ativado primeiro em pressões realmente baixas, seguido por MscS e, finalmente, MscL sendo a última chance de sobrevivência durante o choque osmótico. Sua tarefa foi demonstrada quando as bactérias sem MscS e MscL foram lisadas após a exposição a choques osmóticos.
MscS : Canal de pequena condutância mecanossensível .
A condutância principal é 1nS em solução tampão. As proteínas do canal foram encontradas em bactérias gram positivas e gram negativas, arquéias e plantas. O canal MscS foi encontrado após estudos em esferoplastos de E. coli . A identificação da família de genes necessária para MS de pequena condutância foi como dois canais diferentes. YggB que codifica MscS e KefA que codifica MscK em E. coli confirma ainda mais seu papel na regulação osmótica. Estudos de mutagênese mostraram que quando ambos os genes YggB e KefA foram excluídos, o MscS perdeu sua função, mas manteve o MscL e o MscM, mas os mutantes deficientes de YggB e MscL mostraram que a função desses canais é abrir em resposta à faixa de pressão logo antes da ruptura celular.
A estrutura 3D desse canal no estado fechado foi elucidada após o estudo de cristalografia de Bass et al. que mostrou que na resolução de 3,9 Å esta proteína de 31 kDa é um homoheptâmero formando um canal com 80 Å de diâmetro e 120 Å de comprimento, cada subunidade contém três domínios transmembrana (TM1, TM2 e TM3) com o terminal N voltado para o periplasma e o C-terminal embutido no citoplasma . O TM3 é altamente conservado na família MscS e acredita-se que desempenhe um papel importante no bloqueio procariótico de MS. MscS é uma pequena proteína composta por 286 resíduos de aminoácidos ativados por tensão na bicamada lipídica e voltagem; em 2002, Vasquez et al. detalhou esse processo e mostrou que durante a mudança do estado fechado para o estado aberto, o TM1 inclina e gira, fazendo com que o TM2 seja exposto à membrana e as hélices do TM3 se expandam, inclinem e girem. Durante o rearranjo, a parte confinada do poro foi medida como 11 Å, e as moléculas de água ficaram mais acessíveis ao TM3. Os dois domínios transmembranares estão em contato contínuo com a bicamada lipídica e são considerados o sensor de tensão na bicamada lipídica e também o sensor de voltagem por causa dos três resíduos de arginina presentes nesses domínios.
Embora o MscS seja ativado por tensão, foi demonstrado que a própria tensão é insuficiente para abrir o canal, funcionando assim de forma cooperativa com o canal. Quanto mais tensão positiva, maiores são as probabilidades de abrir o canal, desde que a pressão acima do limite ainda seja aplicada no sistema; o desempenho deste canal em alta tensão não foi completamente compreendido. MscS tem uma pequena afinidade para íons negativos, incluindo Cl- e glutamato.
MscL: Canal de grande condutância mecanossensível .
Em bactérias, o MscL foi o primeiro canal de MS clonado e sequenciado, e é de longe um dos canais mais estudados. O gene que codifica a proteína MscL é trkA e está localizado na membrana interna da E. coli . A proteína tem 17 KDa e consiste em 136 aminoácidos; principalmente resíduos hidrofóbicos resultando em dois segmentos hidrofóbicos; no entanto, o peso molecular do canal funcional é presumido como sendo 60-70 KDa de experimentos de filtração em gel, sugerindo oligomerização. Como característica comum, nenhum resíduo de cisteína está presente neste canal.
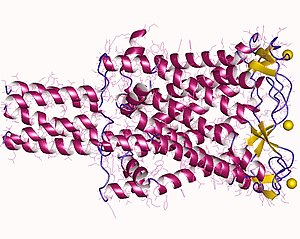
Em 1998, o homólogo MscL de Mycobacterium tuberculosis Tb-MscL foi elucidado em estado fechado por cristalografia de raios X com resolução de 3,5 Å. A proteína é um homopentâmero composto principalmente por regiões helicoidais transorientação das hélices em relação à bicamada, com dois domínios: o citoplasmático e o transmembrana. O canal tem 85 Å de comprimento, 35 Å e 50 Å para o domínio transmembranar citoplasmático, respectivamente, e 50 Å de diâmetro. As hélices cruzam a membrana duas vezes com o terminal C e o terminal N, tendo assim dois domínios transmembranares TM1 e TM2 sendo TM1 a região mais conservada entre as proteínas MscL, especialmente na região N-terminal. Ele está localizado no citoplasma e forma uma hélice α-hidrofóbica chamada S1; a região entre os domínios transmembrana forma uma alça que é dividida em duas regiões: S2 uma região rica em glicina-prolina e S3 uma seção helicoidal curta. A estrutura secundária da proteína é resistente à desnaturação térmica ainda na presença de SDS.
Durante a ativação do MscL procariótico por tensão na bicamada lipídica, foi determinado um estado intermediário. Os segmentos S1 formam um feixe quando a estrutura está no estado fechado e a reticulação dos segmentos S1 impede a abertura do canal. Quando a tensão é aplicada à membrana, a estrutura em forma de barril transmembrana se expande e se distende da região S1-TM1 permitindo que o canal se abra. O tamanho do poro no estado aberto é de aproximadamente 25Å. A transição do estado fechado para o intermediário é acompanhada por pequenos movimentos do TM1; outras transições para o declarado aberto são caracterizadas por grandes rearranjos tanto no TM1 quanto no TM2.
Papel da bicamada lipídica na EM
A bicamada lipídica é uma estrutura importante em todas as células vivas; possui diversas funções, como separação de compartimentos, sinalização, entre outras. No caso dos canais de proteínas procarióticas, MscS e MscL, ambos são bloqueados por tensão na bicamada lipídica, sugerindo assim um papel importante nessas estruturas complexas.
A tensão na bicamada da membrana foi amplamente estudada; as propriedades intrínsecas simples dos lipídios podem ser responsáveis pelas contribuições na energia livre do estado aberto, intermediário e fechado dos canais de MS. A bicamada possui diferentes características que permitem transduzir tensão e evitar deformações exaustivas, a primeira é "fluidez no plano da bicamada lipídica", o que significa que qualquer tensão no plano na bicamada lipídica é sentida homogeneamente na ausência de interações do citoesqueleto. As moléculas lipídicas possuem espaços específicos, impedindo a alteração da bicamada.
A contribuição da deformação da membrana na passagem dos canais MS pode ser dividida em dois tipos: a deformação do plano da bicamada e a deformação da espessura da bicamada. Também durante qualquer processo que envolva mudanças na estrutura, a energia livre do próprio processo também é um fator importante. Durante o gating, os principais processos responsáveis por esse evento são: incompatibilidade hidrofóbica e curvatura da membrana. Foi calculado que a energia livre da tensão na bicamada lipídica é semelhante à energia necessária para abrir os canais.
Outro estudo mostrou que o comprimento da cauda hidrofóbica afeta o seu funcionamento, além de suportar os diferentes estados, Fosfatidilcolina (PC) 18 estabiliza melhor o estado aberto do canal MscL, PC 14 estabiliza o estado intermediário e uma mistura de PC 18 e lisofosfatidilcolina (LPC) estabiliza o estado fechado, sugerindo que a espessura da bicamada (para comprimentos de cauda de carbono de 16, 18 e 20) afeta a função do canal. Em conclusão, a energia do ambiente da membrana desempenha um papel importante na energia total da entrada do canal.
Eucariotos
Em eucariotos, dois dos canais iônicos mecanossensíveis mais conhecidos são os canais de potássio TREK-1 e TRAAK , ambos encontrados em neurônios de mamíferos .
Recentemente, uma nova família de canais iônicos mecanossensíveis foi clonada, com dois membros mamíferos, PIEZO1 e PIEZO2 . Ambos os canais são expressos nos pulmões e na bexiga, órgãos com importantes funções mecanossensoriais. Piezo1 também é expresso na pele e nas células vermelhas do sangue, e suas mutações de ganho de função causam xerocitose hereditária. Piezo2 é expresso em neurônios sensoriais da raiz dorsal e gânglios trigêmeos, indicando que pode desempenhar um papel na sensação de toque. Mutações no piezo2 estão associadas a uma doença humana chamada Artrogripose Distal.
Papel fisiológico da EM
Os canais de MS são expressos de forma ubíqua na membrana de procariotos, sugerindo seu significado. Em Bacteria e Archaea a função desses canais é conservada e foi demonstrado que eles desempenham um papel na regulação do turgor. Em Eukarya, os canais de MS estão envolvidos em todos os cinco sentidos. A família principal é a TRP, e um bom exemplo são as células ciliadas envolvidas no processo auditivo. Quando uma onda de som desvia os estereocílios, o canal se abre. Esta é uma instância do mecanismo de bloqueio tipo Spring Tether. Estudos recentes revelaram um novo papel das vias mecanossensíveis, nas quais as células-tronco mesenquimais ingênuas estão comprometidas com uma linhagem particular com base na elasticidade de sua matriz circundante.
| Canal | Fonte | Mecanismo de portão | Papel fisiológico |
|---|---|---|---|
| MscL | Bactérias | Bicamada lipídica | Regulação de turgor e crescimento celular |
| MscS | Bactérias | Bicamada lipídica | Regulação de turgor e crescimento celular |
| MscMJ | Archaea | Bicamada lipídica | Regulamento de Turgor |
| MEC4 | C. elegans | Tether | Tocar |
| TRPY | Fungi | Bilayer | Regulamento de Turgor |
| TRECK-1 | Mamífero | Bilayer | Potencial de membrana em repouso |
MS também foi sugerido como um alvo potencial para antibióticos, o raciocínio por trás dessa ideia é que ambos McsS e MscL são altamente conservados entre procariontes, mas seus homólogos não foram encontrados em animais, tornando-os um potencial excepcional para estudos futuros.
Em neurônios de mamíferos, a abertura dos canais iônicos despolariza o neurônio aferente, produzindo um potencial de ação com despolarização suficiente. Os canais se abrem em resposta a dois mecanismos diferentes: o modelo procariótico e o modelo de células ciliadas de mamíferos. Foi demonstrado que os canais iônicos ativados por estiramento detectam vibração, pressão, estiramento, toque, sons, sabores, cheiro, calor, volume e visão. Os canais iônicos ativados por estiramento foram categorizados em três "superfamílias" distintas: a família ENaC / DEG, a família TRP e a família seletiva K1. Esses canais estão envolvidos com funções corporais, como regulação da pressão arterial . Eles estão associados a muitas doenças cardiovasculares. Canais ativados por estiramento foram observados pela primeira vez nos músculos esqueléticos de pintinhos por Falguni Guharay e Frederick Sachs em 1983 e os resultados foram publicados em 1984. Desde então, canais ativados por estiramento foram encontrados em células de bactérias a humanos, bem como em plantas.
A abertura desses canais é fundamental para a resposta do neurônio à pressão, geralmente pressão osmótica e pressão sanguínea, para regular o fluxo iônico em ambientes internos.
Técnicas usadas para estudar MS
Esta é uma pequena lista das técnicas mais frequentemente usadas para estudar as propriedades, funções, mecanismo e outros recursos desses canais:
- Patch-clamp: Gravação de célula única.
- EPR
- Simulação de dinâmica molecular: determinação da flutuação atômica do sistema.
- Microscopia de força atômica: forças mecânicas da membrana.
- Aspiração por micropipeta: Pressão para as células.
- Simulações 3D
- Mutagênese
Por meio de experimentos realizados no citoesqueleto e na matriz extra-citoplasmática de canais iônicos ativados por estiramento, essas estruturas demonstraram desempenhar papéis significativos na mecanotransdução. Em um experimento com células cardíacas adultas, gravações de células inteiras foram feitas em células sendo comprimidas com duas pipetas a 1 Hz / 1 um. Esta compressão não produziu corrente até cinco minutos, quando uma grande despolarização foi observada. A partir de então, a célula tornou-se extremamente responsiva a cada compressão e diminuiu gradualmente a sensibilidade ao longo dos minutos seguintes. Os pesquisadores levantaram a hipótese de que, inicialmente, o citoesqueleto estava protegendo a deformação mecânica da compressão do canal. A despolarização em cinco minutos foi o rompimento do citoesqueleto que, subsequentemente, fez com que o canal detectasse as deformações mecânicas e, assim, respondesse aos estímulos. Os pesquisadores acreditam que, ao longo dos poucos minutos em que o canal se reparou, o citoesqueleto deve estar se reparando e se adaptando novamente aos estímulos de compressão.
Estrutura
Superfamília ENaC / DEG
ASIC
Existem seis subunidades ASIC conhecidas, ASIC1a, ASIC1b, ASIC2a, ASIC2b, ASIC3 e ASIC4, que têm dois domínios transmembrana, alças extracelulares e intracelulares e terminais C e N. Essas subunidades ASIC provavelmente formam tetrâmeros com variadas cinéticas, sensibilidade ao pH, distribuição nos tecidos e propriedades farmacológicas.
Superfamília TRP
Existem sete subfamílias na superfamília TRP : TRPC (canônico), TRPV ( vaniloide ), TRPM (melastatina), TRPP ( policistina ), TRPML (mucolipina), TRPA (anquirina) e TRPN (semelhante a NOMPC). As proteínas TRP normalmente consistem em seis domínios transmembrana, S1, S2, S3, S4, S5 e S6, com um poro entre S5 e S6. Estes contêm terminais N e C intracelulares, que formam tetrâmeros e variam em comprimento e domínio. Dentro do canal existem anquirinas , que são proteínas estruturais que medeiam as interações proteína-proteína, e acredita-se que contribuam para o modelo de amarração da abertura do canal ativada por estiramento. O NOMPC, identificado na mecanotransdução de D. melanogaster e membro da subfamília TRPN, contém um número relativamente alto de anquirinas.
Superfamília seletiva de K1
Os canais K2P consistem em seis subfamílias e contêm quatro domínios transmembrana, que formam dois poros cada um entre os domínios 1–2 e 3–4. Os canais K2P também contêm um domínio de terminal N curto e um terminal C que varia em comprimento. Há também uma grande região de ligação extracelular entre o domínio 1 e o primeiro poro formado entre os domínios 1–2.
Exemplos
Os canais TRP são tipicamente não seletivos, embora alguns sejam seletivos para íons de cálcio ou magnésio hidratado e sejam compostos de proteínas integrais de membrana . Embora muitos canais TRP sejam ativados por mudança de voltagem, ligação de ligante ou mudança de temperatura, alguns canais TRP foram hipotetizados como envolvidos na mecanotransdução. Alguns exemplos são TRPV4 , que medeia a carga mecânica em uma variedade de tecidos, incluindo fígado, coração, pulmão, traqueia, testículo, baço, glândulas salivares, cóclea e células endoteliais vasculares, bem como TRPC1 e TRPC6 , que estão envolvidos em mecanosensação muscular. TRPC1 é expresso nos miócitos do coração, artérias e músculo esquelético. O TRPC1 é amplamente considerado um “canal iônico operado por armazenamento” (SOC) não seletivo envolvido no influxo de cálcio após a depleção de cálcio do retículo endoplasmático da célula. TRPC6 é um canal catiônico não seletivo permeável ao cálcio expresso no sistema cardiovascular. O TRPC6 é potencialmente um sensor de estiramento de membrana induzido mecanicamente e osmoticamente e é possivelmente bloqueado diretamente pela tensão da membrana. Outros exemplos incluem TREK-1 e TRAAK que são encontrados em neurônios de mamíferos e são classificados como canais de potássio na classe de domínio de poro em tandem e "MID-1" (também conhecido como "MCLC" ou CLCC1 .)
As seis subfamílias do canal K2P são reguladas por vários estimulantes físicos, celulares e farmacológicos, incluindo estiramento da membrana, calor, mudança de pH, fluxo de cálcio e proteínas quinases.
Relevância clinica
Os canais iônicos ativados por estiramento desempenham funções importantes em muitas áreas diferentes do nosso corpo. As artérias de resistência à constrição miogênica dependentes de pressão requerem esses canais para regulação no músculo liso das artérias. Eles são usados para detecção de volume em animais e regulação da pressão arterial . Foi demonstrado que as bactérias aliviam a pressão hidrostática através dos canais MscL e MscS.
Patologias associadas a canais iônicos ativados por estiramento
Os canais iônicos ativados por estiramento foram correlacionados com as principais patologias. Algumas dessas patologias incluem arritmia cardíaca (como fibrilação atrial ), hipertrofia cardíaca , distrofia muscular de Duchenne e outras doenças cardiovasculares .
Bloqueio de canais iônicos ativados por estiramento
Foi demonstrado que o gadolínio (Gd 3+ ) e outros lantanídeos bloqueiam a função do canal iônico ativado por estiramento. A toxina peptídica isolada da tarântula de rosa chilena (Grammostola spatulata), mecanotoxina 4 (GsMTx4), demonstrou inibir esses canais do lado extracelular, mas não inibe todos os canais iônicos ativados por estiramento e, particularmente, não tem efeito nos canais 2p .
Lista de doenças associadas a canais mecanossensíveis
- Doença renal policística.
- Fibrilação atrial
Anormalidades na função dos canais de MS podem causar:
- Doença neuronal
- Degeneração muscular.
- Arritmia cardíaca
- Hipertensão.
Veja também
- Mecanossensação
- Canal mecanossensível de grande condutância
- Canal mecanossensível de pequena condutância
- Canais iônicos dependentes de voltagem
- Canais de íons controlados por ligante
- Canais iônicos controlados por lipídios
- Os sites da NYU
Referências
O seguinte não é referenciado no artigo e / ou está em conflito com Engler, A. et al., 2006: