Canal de íons com detecção de ácido - Acid-sensing ion channel
| Canal de sódio com detecção de ácido | |||||||||
|---|---|---|---|---|---|---|---|---|---|
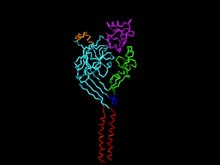
 Estrutura do canal de íons com detecção de ácido 1.
| |||||||||
| Identificadores | |||||||||
| Símbolo | ASC | ||||||||
| Pfam | PF00858 | ||||||||
| InterPro | IPR001873 | ||||||||
| PRÓSITO | PDOC00926 | ||||||||
| SCOP2 | 2qts / SCOPe / SUPFAM | ||||||||
| TCDB | 1.A.6 | ||||||||
| Superfamília OPM | 181 | ||||||||
| Proteína OPM | 4fz1 | ||||||||
| |||||||||
Os canais iônicos com detecção de ácido ( ASICs ) são canais de sódio neuronais insensíveis à voltagem, ativados por prótons extracelulares permeáveis ao Na + . ASIC1 também mostra baixa permeabilidade ao Ca 2+ . As proteínas ASIC são uma subfamília da superfamília ENaC / Deg de canais iônicos . Esses genes têm variantes de emenda que codificam várias isoformas marcadas por um sufixo. Em mamíferos, os canais iônicos com detecção de ácido (ASIC) são codificados por cinco genes que produzem subunidades de proteínas ASIC: ASIC1, ASIC2, ASIC3, ASIC4 e ASIC5 . Três dessas subunidades de proteína se reúnem para formar o ASIC, que pode se combinar em canais homotriméricos e heterotriméricos, tipicamente encontrados no sistema nervoso central e no sistema nervoso periférico . No entanto, os ASICs mais comuns são ASIC1a e ASIC1a / 2a e ASIC3. ASIC2b não é funcional por si só, mas modula a atividade do canal quando participa de heteromultímeros e ASIC4 não tem função conhecida. Em uma escala ampla, os ASICs são alvos potenciais de drogas devido ao seu envolvimento em estados patológicos, como danos à retina, convulsões e lesão cerebral isquêmica.
Estrutura
Cada canal de íon sensor de ácido é composto por uma sequência de 500-560 aminoácidos, que é construída em um segmento de seis transmembrana - dois por subunidade (TMD1 e TMD2), um terminal amino-carboxila citoplasmático e um grande domínio extracelular. Os domínios dos terminais amino-carboxila intracelulares são vitais para as interações e modulações protéicas intracelulares do canal, permeabilidade iônica e gating. No entanto, o gating e a mecânica de cada canal de íon de detecção de ácido são determinados pela combinação de subunidades ASIC que formam sua estrutura.
Poro
A mecânica da função dos poros é fundamental para a estrutura do canal. Entre as três subunidades ASIC1, um túnel se estende do topo dos domínios extracelulares até o citoplasma da célula. O túnel central passa diretamente entre a unidade trimérica, onde há grandes áreas restritas que mudam de tamanho e forma dependendo do estado do canal.
Os dois domínios transmembrana (TMD1 e TMD2) de cada uma das três subunidades ASIC são responsáveis pelo poro do canal. O TMD2 está principalmente envolvido com o revestimento do lúmen dentro do poro e a porta de inativação do canal, onde o TMD1 mantém a proteína dentro da bicamada lipídica da célula . O TMD1 está conectado às folhas β do domínio extracelular que se flexionam para alargar o domínio extracelular para permitir a passagem de íons através do canal. Entre os segmentos TMD2 reside um filtro de seletividade que forma a parte mais estreita do poro, que é responsável pela permissibilidade ASIC para principalmente Na + . Para ASIC1, nove resíduos de aminoácidos , três contribuídos por cada subunidade ASIC (Gly443, Ala444, Ser445), formam o filtro de seletividade. Apelidado de "cinturão de GÁS", todos os três oxigênios de carbonila revestem o poro, produzindo um potencial negativo que contribui para a condutância de cátions. O resíduo de aminoácido específico do aspartato no lúmen do lado extracelular de TMD2 em ASIC1 foi associado à baixa condutância de Ca 2+ do canal . Além disso, os resíduos n-terminais da região transmembranar também mostraram seletividade para Na + , uma vez que mutações nesta região alteraram a função e a condutância do Na + .
Região extracelular
ASICs têm uma grande região extracelular semelhante a um punho que consome a maior parte da estrutura das proteínas. Dentro de sua estrutura "semelhante a um punho", há um pulso, palma, dedo, nós da mão, polegar e domínios β-ball. A "palma" constitui a maior parte do domínio extracelular, formado por sete folhas β, onde o resto dos domínios estruturais secundários são compostos por segmentos α-helicoidais. Diferenciada por suas configurações específicas de aminoácidos, a região extracelular é fundamental para a indução de ativação / inativação juntamente com o gating de pH . A área específica do loop da folha β entre os domínios "palma" e "polegar" mostrou envolvimento na transdução de sinal do domínio extracelular para as regiões transmembrana, resultando em uma mudança conformacional do ASIC para seu estado aberto. No entanto, permanece bastante inconclusivo de quais resíduos particulares interagem com os prótons para ativar o canal. Em 2009, estudos podem ter estabelecido uma relação entre os resíduos aromáticos Tyr72, Pro287 e Trp288 e o gating de prótons do ASIC. Esses resíduos formam uma bolsa ácida que expressa potenciais eletrostáticos que são responsáveis pela dependência do pH na ativação e modulação do canal. Esta bolsa no domínio extracelular atua como uma reserva para que os cátions se concentrem para auxiliar no influxo de Na + . A glicosilação também é aparente na região extracelular, desempenhando um papel importante no tráfego do canal para a superfície da membrana, bem como no estabelecimento da sensibilidade do ASIC aos níveis de pH. Evidências experimentais adicionais indicaram que o Ca 2+ também pode desempenhar um papel fundamental na modulação da afinidade do próton do ASIC gating tanto dentro do poro quanto no domínio extracelular.
Função
O papel do ASIC é detectar níveis reduzidos de pH extracelular e resultar em uma resposta ou sinal do neurônio. O ligante que se liga ao local de ativação é considerado exclusivamente prótons; no entanto, estudos recentes mostraram que ASIC4 e ASIC1 podem ser ativados em níveis de pH normais, indicando outros tipos de ligantes. Sob condições ácidas aumentadas, um próton se liga ao canal na região extracelular, ativando o canal iônico para passar por uma mudança conformacional, abrindo assim o domínio transmembrana 2 (TMD2). Isso resulta no influxo de íons de sódio através do lúmen do TMD2. Todos os ASICs são especificamente permeáveis aos íons de sódio. A única variante é ASIC1a, que também tem uma baixa permeabilidade aos íons de cálcio. O influxo desses cátions resulta na despolarização da membrana. Os canais de Ca 2+ dependentes de voltagem são ativados, resultando em um influxo de cálcio na célula. Isso causa a despolarização do neurônio e uma resposta excitatória liberada. Em ASIC1a, o aumento de Ca 2+ dentro da célula é resultado do influxo de cálcio diretamente através do canal.
Uma vez ativado, o ASIC pode passar a desencadear uma infinidade de diferentes proteínas efetoras e moléculas de sinalização para resultar em diferentes reações da célula. Nomeadamente, a α-Actinina resulta em maior sensibilidade ao pH e recuperação de dessensibilização. Eles também podem aumentar a densidade do fluxo de corrente através do canal. Existem também muitas proteínas quinases que regulam a função ASIC por meio da fosforilação . Estes incluem a proteína quinase A (PKA) e a proteína quinase C (PKC). Acredita-se que haja muito mais reguladores, mas seus efeitos não foram concluídos experimentalmente.
Existem alguns outros fatores que podem desempenhar um papel na regulamentação dos ASICs. Diz-se que a presença de glicanos ligados a N maduros na superfície do canal permite que o canal trafegue preferencialmente para ASIC1a. Este é um resultado do aumento dos locais de N-glicosilação em ASIC1a e ASIC2a. Os altos níveis de glicerol (conhecido por acelerar a maturação da proteína) na superfície ASIC2 também ajudam na implicação de que a regulação da função desses canais depende da maturação da proteína. Também é hipotetizado que a oxidação desempenha um papel no tráfico.
Localização
A maioria dos ASIC são expressos no sistema nervoso. ASIC1, ASIC2, ASIC2b e ASIC4 são comumente expressos no sistema nervoso central e periférico, enquanto ASIC1b e ASIC3 geralmente estão localizados apenas no periférico.
No sistema nervoso periférico, os ASICs estão localizados dentro dos corpos celulares das membranas pós-sinápticas e terminais nervosos sensoriais. Além disso, os ASICs são normalmente encontrados nas fibras nervosas aferentes da pele, músculos, articulações e vísceras, onde se descobriu que estão associados à dor, paladar e funções gastrointestinais.
No sistema nervoso central, os ASICs são geralmente encontrados no corno dorsal da medula espinhal . ASIC1 está especificamente concentrado na amígdala , ilustrando seu papel no comportamento ansioso e ASIC3 foi encontrado no órgão de Corti e gânglio espiral ilustrando o papel deste canal específico na percepção auditiva e visual. As subunidades ASIC1a, ASIC2a e ASIC2b também foram encontradas no hipocampo.
Fisiologia
ASICs são potenciais alvos de drogas para o tratamento de uma ampla variedade de doenças ligadas ao SNC e ao SNP. De particular interesse para o campo da dor é o receptor do subtipo ASIC3, que é especificamente expresso em nociceptores . Este subtipo exibe uma corrente bifásica após a ativação do próton, onde a corrente inicial de Na + para dentro é logo seguida por uma corrente catiônica sustentada.
ASICs são importantes na função retinal e oferecem proteção em resposta à luz forte. A suscetibilidade ao dano retinal aumenta após a exclusão do gene ASIC2. O aumento da apoptose ocorreu em resposta à luz brilhante em um gene ASIC2 - / - em comparação com a retina do tipo selvagem.
Os canais ASIC1a também desempenham um papel na proteção contra a atividade convulsiva. As convulsões causam aumento da atividade neuronal descontrolada no cérebro, que libera grandes quantidades de vesículas ácidas. Os canais ASIC1a abrem em resposta e demonstraram proteger contra convulsões, reduzindo sua progressão. Estudos que pesquisam esse fenômeno descobriram que a exclusão do gene ASIC1a resultou em atividade convulsiva amplificada.
Os canais ASIC1a se abrem especificamente em resposta a pH 5,0-6,9 e contribuem para a patologia da lesão cerebral isquêmica porque sua ativação causa um pequeno aumento na permeabilidade ao Ca 2+ e um fluxo interno de Ca 2+ . Os canais ASIC1a também facilitam a ativação de canais de Ca2 + dependentes de voltagem e canais de receptores NMDA após a despolarização inicial, contribuindo para o grande aumento do cálcio intracelular que resulta em morte celular. Um possível mecanismo de morte celular mediada por canal ASIC1a é devido à ativação de outros canais, levando ao Ca 2+ elevado, que cria vias de sinalização para apoptose e necrose na célula. Os estudos de nocaute do gene, bem como os bloqueios de ASIC, mostraram reduzir o volume do infarto cerebral em até 60%, sugerindo que os canais ASIC desempenham um papel importante no desenvolvimento dos estados patológicos resultantes da acidose e lesão neuronal induzida por isquemia . Os efeitos dos bloqueios de ASIC e NMDA foram estudados para determinar os papéis de ambos os canais na toxicidade de Ca 2+ e avaliar suas respectivas contribuições. O uso de bloqueio para ambos os canais proporciona maior neuroproteção do que o uso de bloqueio para apenas um canal, e o bloqueio ASIC cria eficácia prolongada do bloqueio NMDA.
Farmacologia
Devido ao papel dos canais iônicos de detecção de ácido na percepção da dor e em vários processos fisiopatológicos, eles têm um significado farmacológico como um alvo de inibição de drogas. Canais iônicos de detecção de ácido são encontrados em neurônios centrais e periféricos. A modulação da atividade ASIC pode controlar adicionalmente os sintomas comportamentais e emocionais adversos da dor crônica, como ansiedade e depressão.
Canais de íons de detecção de ácido (ASIC) são observados para serem ativados em pH abaixo de ~ 6 com variabilidade dependendo do tipo de canal e sua localização. Uma diminuição no pH pode ser devido a uma variedade de razões, incluindo inflamação do tecido, acidente vascular cerebral isquêmico, um acúmulo de ácido láctico devido ao aumento do metabolismo celular. A ativação do canal causa aumento da permeabilidade dos íons de sódio, que despolariza a célula e induz o disparo de um potencial de ação . Os potenciais de ação resultantes podem ser modulados através de inibidores de pequenas moléculas.
A amilorida é um exemplo de inibidor de ASIC, embora não seja considerada altamente potente devido a um valor de IC50 na faixa micromolar, permitiu estudos sobre os efeitos da inibição de ASIC nas enxaquecas. Durante uma enxaqueca , é observada uma depressão alastrante cortical que causa desequilíbrios iônicos e a liberação de moléculas carregadas que podem ativar o ASIC. Testes de amilorida em roedores mostraram uma diminuição na depressão alastrante cortical durante uma enxaqueca. Estudos mostraram que a amilorida atua como um inibidor competitivo dos capítulos ASIC. O uso de amilorida também apresentou efeitos colaterais em roedores devido à inibição dos trocadores sódio / cálcio. A inibição desses trocadores perturba a homeostase celular do cálcio e causa altos níveis de cálcio na célula, o que explica a redução da eficácia neuroprotetora com o uso de amilorida. Os resultados obtidos devido à inibição do ASIC pela amilorida são promissores e apóiam o potencial terapêutico. No entanto, devido à falta de especificidade e potência da amilorida, será necessário realizar o desenvolvimento do fármaco em sua estrutura antes que um fármaco possa ser liberado.
Um inibidor de molécula pequena, A-317567, mostra mais potencial terapêutico do que amilorida com uma maior especificidade para canais ASIC e potência aumentada. Embora A-317567 mostre pouca seletividade para os diferentes tipos de canais ASIC, resultados in vivo mostraram que os efeitos colaterais observados com o uso de amilorida são evitados devido à especificidade do A-317567 para ASIC. Além disso, o A-317567 tem a capacidade de manter a inibição de correntes sustentadas que podem ser promissoras especificamente em condições crônicas mediadas por acidose.
O inibidor de ASICs mais eficaz e mais conhecido é o PcTX1. PcTX1 inibe especificamente ASICa e tem um valor IC50 na faixa nanomolar - uma IC50 menor do que todos os outros inibidores ASIC conhecidos que estiveram na faixa micromolar. Além disso, PcTX1 não inibe outros canais iônicos dependentes de voltagem ou canais dependentes de ligante . A estrutura deste inibidor é de 40 aminoácidos ligados por ligações dissulfeto . Foi identificada como uma toxina peptídica da tarântula sul-americana Psalmopoeus Cambridge . Quando o PcTX1 foi administrado na amígdala basolateral de ratos, os sintomas relacionados à emoção e ansiedade associados à dor diminuíram significativamente. Os mambalgins isolados do veneno da mamba negra também foram identificados como inibidores potentes de ASICs.
Os antiinflamatórios não esteróides ( AINEs ) comumente usados têm um papel importante na inibição de ASIC, o que contribui para a modulação da dor. O mecanismo bem conhecido para a função dos AINEs é a inibição da síntese de prostaglandinas, um importante composto inflamatório. No entanto, os resultados mostram que os AINEs ibuprofeno e aspirina inibem ASICs com valores de IC50 de 350 µM e 260 µM, respectivamente. Os AINEs provavelmente inibem a corrente ASIC durante a dor aguda, particularmente aquela causada pela inflamação do tecido e, portanto, inibem o sinal para os neurônios sensíveis à dor.
Ao aprofundar as pesquisas sobre o potencial farmacológico da inibição de ASIC, os pacientes que sofrem de dor crônica e várias patologias associadas à acidose podem ter mais opções de tratamento no futuro. Além disso, estudos de descoberta de drogas de ASICs fornecem maior conhecimento sobre a função dos próprios canais e seu significado fisiológico.