Luminol - Luminol
|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
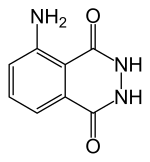
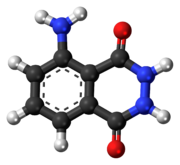
5-Amino-2,3-dihidroftalazina-1,4-diona |
|
| Outros nomes
5-Amino-2,3-dihidro-1,4-ftalazinediona
o- Aminoftaloil hidrazida o -Aminoftalil hidrazida 3-Aminoftalhidrazida 3-Aminoftaloil hidrazida |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100,007,556 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 8 H 7 N 3 O 2 | |
| Massa molar | 177,16 g / mol |
| Ponto de fusão | 319 ° C (606 ° F; 592 K) |
| Perigos | |
| Ficha de dados de segurança | MSDS para luminol |
| NFPA 704 (diamante de fogo) | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Luminol (C 8 H 7 N 3 O 2 ) é um produto químico que apresenta quimioluminescência , com brilho azulado, quando misturado com um agente oxidante apropriado . Luminol é um sólido cristalino branco a amarelo claro que é solúvel na maioria dos solventes orgânicos polares, mas insolúvel em água.
Os investigadores forenses usam o luminol para detectar vestígios de sangue nas cenas do crime , pois ele reage com o ferro da hemoglobina . Os biólogos usam em ensaios celulares para detectar cobre , ferro , cianetos , bem como proteínas específicas por meio de Western blotting .
Quando o luminol é pulverizado uniformemente em uma área, traços de um oxidante ativador fazem com que o luminol emita um brilho azul que pode ser visto em uma sala escura. O brilho dura apenas cerca de 30 segundos, mas pode ser documentado fotograficamente. O brilho é mais forte em áreas que recebem mais spray; a intensidade do brilho não indica a quantidade de sangue ou outro ativador presente.
Síntese
O Luminol é sintetizado em um processo de duas etapas, começando com o ácido 3-nitro ftálico . Primeiro, a hidrazina (N 2 H 4 ) é aquecida com o ácido 3-nitroftálico em um solvente de alto ponto de ebulição, como trietilenoglicol e glicerol . Uma substituição acilo reacção de condensação ocorre, com perda de água, formando-3 nitrophthalhydrazide. A redução do grupo nitro a um grupo amino com ditionito de sódio (Na 2 S 2 O 4 ), por meio de um intermediário de hidroxilamina transiente , produz luminol.
O composto foi sintetizado pela primeira vez na Alemanha em 1902, mas não foi chamado de "luminol" até 1934.
Quimioluminescência
Para exibir sua luminescência, o luminol deve ser ativado com um oxidante. Normalmente, uma solução contendo peróxido de hidrogênio (H 2 O 2 ) e íons hidróxido em água é o ativador. Na presença de um catalisador , como um composto de ferro ou periodato , o peróxido de hidrogênio se decompõe para formar oxigênio e água:
- 2 H 2 O 2 → O 2 + 2 H 2 O
- H 2 O 2 + KIO 4 → KIO 3 + O 2 + H 2 O
Os ambientes de laboratório costumam usar ferricianeto de potássio ou periodato de potássio como catalisador. Na detecção forense de sangue, o catalisador é o ferro presente na hemoglobina . As enzimas em uma variedade de sistemas biológicos também podem catalisar a decomposição do peróxido de hidrogênio.
O mecanismo exato da quimioluminescência do luminol é uma reação complexa de várias etapas, especialmente em condições aquosas. Uma investigação teórica recente foi capaz de elucidar a cascata de reação conforme mostrado abaixo. O Luminol é primeiro desprotonado em condições básicas, depois oxidado no radical aniônico. Que, por sua vez, tem dois caminhos disponíveis para fornecer o α-hidroxiperóxido principal intermediário. Após a ciclização ao endoperóxido, o mono-ânion sofrerá decomposição sem luminescência, se o pH for muito baixo (<8,2) para uma segunda desprotonação. O endoperóxido dianion, entretanto, pode dar o produto retro-Diels-Alder: 1,2-dioxano-3,6-diona dianion. E após a quimiexcitação por duas transferências de elétron único (SET) dá o dianião 3-aminoftalato em seu primeiro estado excitado singuleto (S1). Essa molécula altamente instável relaxa até o estado fundamental, emitindo luz com comprimento de onda de cerca de 425 nm (azul-púrpura), a chamada quimioluminescência .
Uso em investigação criminal
História
Em 1928, o químico alemão HO Albrecht descobriu que o sangue , entre outras substâncias, aumentava a luminescência do luminol em uma solução alcalina de peróxido de hidrogênio. Em 1936, Karl Gleu e Karl Pfannstiel confirmaram esse aumento na presença de hematina , um componente do sangue. Em 1937, o cientista forense alemão Walter Specht fez extensos estudos da aplicação do luminol para a detecção de sangue em cenas de crime. Em 1939, os patologistas de São Francisco Frederick Proescher e AM Moody fizeram três observações importantes sobre o luminol:
- embora o teste seja presuntivo, grandes áreas de material suspeito podem ser examinadas rapidamente;
- o sangue seco e decomposto produziu uma reação mais forte e duradoura do que o sangue fresco; e
- se a luminescência desaparecer, pode ser reproduzida pela aplicação de uma solução fresca de peróxido de luminol-hidrogênio; manchas de sangue secas podem, portanto, tornar-se luminescentes repetidamente.
Teoria
Os investigadores da cena do crime usam o luminol para encontrar vestígios de sangue, mesmo que alguém o tenha limpado ou removido. O investigador pulveriza uma solução de luminol e o oxidante. O ferro no sangue catalisa a luminescência. A quantidade de catalisador necessária para causar a reação é muito pequena em relação à quantidade de luminol, permitindo a detecção de até vestígios de sangue. O brilho azul dura cerca de 30 segundos por aplicação. Detectar o brilho requer uma sala bastante escura. Qualquer brilho detectado pode ser documentado por uma fotografia de longa exposição .
Inconvenientes
O uso do Luminol na investigação da cena do crime é um tanto dificultado pelo fato de que reage a compostos contendo ferro e cobre , alvejantes , raiz-forte , urina , matéria fecal ou resíduo de fumaça. A aplicação do luminol a uma peça de prova pode impedir que outros testes sejam realizados nela; no entanto, o DNA foi extraído com sucesso de amostras expostas ao luminol.
Moléculas relacionadas
- Luminol: 5-amino-2,3-di-hidro-1,4-ftalazinediona; 3-amino-ftal-hidrazida; 1,4-ftalazinediona, 5-amino-2,3-di-hidro; CAS: [521-31-3]
C 8 H 7 N 3 O 2 - MW: 177,16
λ abs (em NaOH 0,1 N) λ max 1: 347 nm & λ max 2: 300 nm; EC (em λ max 1): 7650 L / mol × cm
λ abs / λ em (MeOH): 355/413 nm - Luminol, sal de sódio: 3-amino-ftal-hidrazida de sódio; CAS: [20666-12-0]
C 8 H 6 N 3 O 2 Na - MW: 199,12 - Luminol hemi-hidratado: um hidrato de 3-amino-ftal-hidrazida de sódio; CAS: [206658-90-4]
C 8 H 6 N 3 O 2 Na • H 2 O - MW: 217,16 - Cloridrato de Luminol: cloridrato de 3-amino-ftal-hidrazida; CAS: [74165-64-3]
C 8 H 7 N 3 O 2 · HCl MW: 213,62 - Isoluminol: 4-aminoftal-hidrazida; CAS: [3682-14-1]
C 8 H 7 N 3 O 2 - MW: 117,16 (Xi) - Isoluminol mono-hidratado: 4-aminoftal-hidrazida mono-hidratado
C 8 H 7 N 3 O 2 • H 2 O - MW: 195,15 - Isoluminol ABEI: monohidrato de 4-aminoftal-hidrazida; CAS: [66612-29-1]




![Mecanismo de quimioluminescência do luminol (hidrazida cíclica) em solução aquosa básica. [8]](https://upload.wikimedia.org/wikipedia/commons/thumb/0/09/Chemoluminescence_mechanism_of_luminol_%28cyclic_hydrazide%29_in_basic%2C_aqueous_solution.svg/1211px-Chemoluminescence_mechanism_of_luminol_%28cyclic_hydrazide%29_in_basic%2C_aqueous_solution.svg.png)