Especiação de íons - Ion speciation
A especiação de íons se refere à variação da concentração de formas variadas de um íon conforme o pH da solução muda.
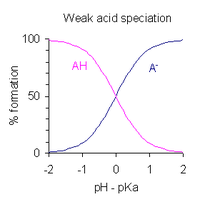
O pH de uma solução de um ácido fraco monoprótico pode ser expresso em termos da extensão da dissociação. Depois de reorganizar a expressão que define a constante de dissociação de ácido e colocar pH = −log 10 [H + ], obtém-se
- pH = p K a - log ([AH] / [A - ])
Esta é uma forma da equação de Henderson-Hasselbalch . Pode-se deduzir desta expressão que
- quando o ácido está 1% dissociado, ou seja, quando [AH] / [A - ] = 100, pH = p K a - 2
- quando o ácido está 50% dissociado, ou seja, quando [AH] / [A - ] = 1, pH = p K a
- quando o ácido está 99% dissociado, ou seja, quando [AH] / [A - ] = 0,01, pH = p K a + 2
Segue-se que a faixa de pH dentro da qual há dissociação parcial do ácido é de cerca de p K a ± 2. Isso é mostrado graficamente à direita.
Uma aplicação prática desses resultados é que a faixa de transição de pH de um indicador de pH é de aproximadamente p K a ± 1; a cor do indicador em sua forma ácida é diferente da cor da forma básica conjugada. Na faixa de transição, ambas as formas estão em equilíbrio, então a cor é intermediária. Fora da faixa de transição, a concentração de ácido ou base conjugada é inferior a 10% e a cor das principais espécies predomina.

Um ácido fraco pode ser definida como um ácido com p K uma maior do que cerca de -2. Um ácido com p K a = −2 seria 99% dissociado em pH 0, ou seja, em uma solução 1 M de HCl. Qualquer ácido com ap K a menor que cerca de -2 é considerado um ácido forte . Os ácidos fortes são considerados totalmente dissociados. Não existe um valor preciso de p K a que distinga entre ácidos fortes e fracos porque os ácidos fortes, como o ácido sulfúrico , estão associados em soluções muito concentradas.
Cálculo das concentrações de espécies de um ácido poliprótico é mais complicado, a menos que as p K valores são separados por quatro ou mais, porque três ou mais espécies podem coexistir a um dado pH. O exemplo do ácido cítrico é mostrado à direita. As regiões de pH em que as espécies existem se sobrepõem extensivamente, uma vez que a diferença entre os valores sucessivos de p K a é pequena. Um grande número de programas de computador para o cálculo das concentrações de equilíbrio de espécies foi publicado. A maioria deles pode lidar com equilíbrios muito mais complicados do que equilíbrios ácido-base em solução. Para obter detalhes sobre programas de uso geral, consulte os programas de computador para calcular as concentrações de espécies em equilíbrio químico .
Veja também
Referências
- ^ Mordomo, James N. (1998). Equilíbrio iônico . Nova York: Wiley. ISBN 0-471-58526-2.
