Embriogênese de Drosophila - Drosophila embryogenesis
Embriogênese de Drosophila , o processo pelo qual os embriões de Drosophila (mosca da fruta) se formam, é um sistema modelo favorito para genética e biologia do desenvolvimento . O estudo de sua embriogênese desvendou o enigma de um século de como o desenvolvimento era controlado, criando o campo da biologia evolutiva do desenvolvimento . O tamanho pequeno, o curto tempo de geração e o tamanho grande da ninhada o tornam ideal para estudos genéticos. Embriões transparentes facilitam os estudos de desenvolvimento. Drosophila melanogaster foi introduzida no campo de experimentos genéticos por Thomas Hunt Morgan em 1909.
Ciclo da vida
As drosófilas apresentam um método de desenvolvimento holometábolo , o que significa que têm três estágios distintos de seu ciclo de vida pós-embrionário, cada um com um plano corporal radicalmente diferente: larva, pupa e, finalmente, adulto. A maquinaria necessária para a função e transição suave entre essas três fases se desenvolve durante a embriogênese . Durante a embriogênese, a mosca em estágio larval se desenvolverá e eclodirá em um estágio de sua vida conhecido como primeiro instar larval. As células que produzirão estruturas adultas são colocadas de lado em discos imaginais . Durante o estágio de pupa, o corpo larval se decompõe à medida que os discos imaginários crescem e produzem o corpo adulto. Este processo é denominado metamorfose completa . Cerca de 24 horas após a fertilização, um ovo eclode e se transforma em larva, que passa por três mudas em cerca de 5,5 a 6 dias, após o que é chamada de pupa. A pupa se metamorfoseia em uma mosca adulta, o que leva cerca de 3,5 a 4,5 dias. Todo o processo de crescimento do ovo à mosca adulta leva cerca de 10 a 12 dias para ser concluído a 25 ° C.
A mosca-mãe produz oócitos que já possuem eixos ântero-posterior e dorsal-ventral definidos pelas atividades maternas.
A embriogênese em Drosophila é única entre os organismos modelo em que a clivagem ocorre em um sincício multinucleado (estritamente um coenócito ). No início, 256 núcleos migram para o perímetro do ovo, criando o blastoderma sincicial. A linha germinal segregada das células somáticas por meio da formação de células polares na extremidade posterior do embrião. Após treze divisões mitóticas e cerca de 4 horas após a fertilização, estima-se que 6.000 núcleos se acumulem no citoplasma não separado do oócito antes de migrarem para a superfície e serem englobados por membranas plasmáticas para formar células em torno do saco vitelino, produzindo um blastoderma celular.
Como outros metazoários triploblásticos , a gastrulação leva à formação de três camadas germinativas : a endoderme , a mesoderme e a ectoderme . O mesoderma invagina a partir do sulco ventral (VF), assim como o ectoderma que dará origem ao intestino médio. As células polares são internalizadas por uma rota diferente.
O alongamento das bandas germinativas envolve muitos rearranjos de células e o aparecimento de diferenças distintas nas células das três bandas germinativas e em várias regiões do embrião. A região posterior (incluindo o intestino posterior) se expande e se estende em direção ao pólo anterior ao longo do lado dorsal do embrião. Nesse momento, segmentos do embrião se tornam visíveis, criando um arranjo listrado ao longo do eixo ântero-posterior. Os primeiros sinais de segmentação aparecem durante esta fase com a formação de sulcos parassegmentais . É também aí que se formam as fossetas traqueais, primeiros sinais de estruturas para respirar.
A retração da banda germinativa retorna o intestino posterior para o lado dorsal do pólo posterior e coincide com a segmentação aberta . Os demais estágios envolvem a internalização do sistema nervoso (ectoderme) e a formação de órgãos internos (principalmente o mesoderma).
Padronização do eixo anterior-posterior em Drosophila
Um dos exemplos mais bem compreendidos de formação de padrões é a padronização ao longo do futuro eixo da cabeça à cauda (ântero-posterior) da mosca da fruta Drosophila melanogaster . Existem três tipos fundamentais de genes que dão lugar à estrutura de desenvolvimento da mosca: genes de efeito materno, genes de segmentação e genes homeóticos. O desenvolvimento da Drosophila é particularmente bem estudado e é representativo de uma grande classe de animais, os insetos ou insetos . Outros organismos multicelulares às vezes usam mecanismos semelhantes para a formação do eixo, embora a importância relativa da transferência de sinal entre as células mais antigas de muitos organismos em desenvolvimento seja maior do que no exemplo descrito aqui.
Genes de efeito materno
Os blocos de construção da padronização do eixo anterior-posterior em Drosophila são dispostos durante a formação do ovo ( oogênese ), bem antes de o ovo ser fertilizado e depositado. Os genes de efeito materno são responsáveis pela polaridade do ovo e do embrião. O ovo em desenvolvimento ( oócito ) é polarizado por moléculas de mRNA localizadas diferencialmente .
Os genes que codificam esses mRNAs, chamados genes de efeito materno , codificam proteínas que são traduzidas durante a fertilização para estabelecer gradientes de concentração que abrangem o ovo. Bicoide e Hunchback são os genes de efeito materno mais importantes para a padronização das partes anteriores (cabeça e tórax) do embrião de Drosophila . Nanos e Caudal são genes de efeito materno importantes na formação de segmentos abdominais posteriores do embrião de Drosophila .
Em embriões de mães mutantes bicoides , a cabeça e as estruturas torácicas são convertidas para o abdômen, tornando o embrião com estruturas posteriores em ambas as extremidades, um fenótipo letal.
Elementos do citoesqueleto , como microtúbulos, são polarizados dentro do oócito e podem ser usados para permitir a localização de moléculas de mRNA em partes específicas da célula. Os mRNAs bicoides sintetizados maternalmente se ligam aos microtúbulos e são concentrados nas extremidades anteriores dos ovos de Drosophila . Em ovos não fertilizados, os transcritos ainda estão estritamente localizados na ponta, mas imediatamente após a fertilização, um pequeno gradiente de mRNA é formado nos 20% anteriores dos ovos. Outro relatório documenta um gradiente de mRNA de até 40%. nanos mRNA também se liga ao citoesqueleto de um ovo de Drosophila , mas está concentrado na extremidade posterior do ovo. Os mRNAs corcunda e caudal carecem de sistemas especiais de controle de localização e estão espalhados de maneira bastante uniforme por todo o interior dos óvulos.
Foi demonstrado que a proteína de ligação a dsRNA STAUFEN ( STAU1 ) é responsável por guiar bicoid, nanos e outras proteínas, que desempenham um papel na formação do eixo ântero-posterior, para as regiões corretas do embrião para construir gradientes. Quando os mRNAs dos genes de efeito materno são traduzidos em proteínas, um gradiente de proteína Bicoide se forma na extremidade anterior do ovo. A proteína Nanos forma um gradiente na extremidade posterior. A proteína Bicoide bloqueia a tradução do mRNA caudal, de modo que a proteína caudal tem menor concentração na parte anterior do embrião e maior concentração na parte posterior do embrião. Esta é a direção oposta da proteína Bicoid. A proteína caudal então se ativa mais tarde para ligar os genes para formar as estruturas posteriores durante a fase de segmentação. A proteína Nanos cria uma inclinação posterior para anterior e é um morfogênio que ajuda na formação do abdômen. A proteína Nanos, em complexo com a proteína Pumilio, liga-se ao mRNA corcunda e bloqueia sua tradução na extremidade posterior dos embriões de Drosophila .
As proteínas Bicoid, Hunchback e Caudal são fatores de transcrição . A proteína Bicoid também é um morfogênio. A proteína Nanos é uma proteína repressora da tradução. O Bicoid tem um homeodomínio de ligação ao DNA que liga o DNA e o mRNA dos nanos . O Bicoid se liga a uma sequência específica de RNA na região 3 'não traduzida , chamada de elemento regulador Bicoid 3'-UTR , do mRNA caudal e bloqueia a tradução.
Os níveis de proteína corcunda no embrião inicial são significativamente aumentados pela nova transcrição do gene corcunda e tradução do mRNA produzido zigoticamente resultante . Durante a embriogênese inicial da Drosophila , há divisões nucleares sem divisão celular. Os muitos núcleos produzidos se distribuem ao redor da periferia do citoplasma da célula . A expressão gênica nesses núcleos é regulada pelas proteínas Bicoide, Hunchback e Caudal. Por exemplo, o Bicoid atua como um ativador transcricional da transcrição do gene corcunda . Para que o desenvolvimento continue, o corcunda é necessário em uma área que está diminuindo em quantidade de anterior para posterior. Isso é criado pela proteína Nanos, cuja existência está em uma inclinação decrescente das extremidades posterior para anterior.
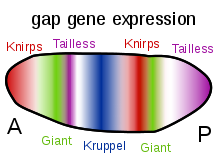
Genes Gap
A outra função importante dos gradientes das proteínas bicóide, corcunda e caudal é a regulação da transcrição de outras proteínas expressas no zigoto. Muitos deles são produtos proteicos derivados de membros da família "gap" de genes de controle do desenvolvimento. gigante , huckebein , corcunda , knirps , Krüppel e tailless são todos genes gap . Seus padrões de expressão no embrião inicial são determinados pelos produtos do gene de efeito materno e mostrados nos diagramas no lado direito desta página. Os genes gap fazem parte de uma família maior chamada genes de segmentação . Esses genes estabelecem o plano corporal segmentado do embrião ao longo do eixo ântero-posterior. Os genes de segmentação especificam 14 parassegmentos que estão intimamente relacionados aos segmentos anatômicos finais. Os genes gap são a primeira camada de uma cascata hierárquica de genes de controle de segmentação.
Genes de segmentação adicionais
Duas classes adicionais de genes de segmentação são expressas após os produtos do gene gap. Os genes de regra de par são expressos em padrões listrados de sete bandas perpendiculares ao eixo anterior-posterior. Esses padrões de expressão são estabelecidos no blastoderma sincicial. Após esses eventos iniciais de padronização, as membranas celulares se formam ao redor dos núcleos da blastoderme sincicial, convertendo-a em uma blastoderme celular.
Os padrões de expressão da classe final de genes de segmentação, os genes de polaridade de segmento , são então ajustados por interações entre as células de parassegmentos adjacentes com genes como o engrailed . A proteína Engrailed é um fator de transcrição expresso em uma fileira de células na borda de cada parassegmento. Este padrão de expressão é iniciado pelos genes de regras de pares (como pares saltados ) que codificam para fatores de transcrição que regulam a transcrição do gene gravado no blastoderma sincicial.
As células que fazem o Engrailed podem formar a proteína de sinalização célula a célula Hedgehog . O movimento de Hedgehog é limitado por sua modificação lipídica, e então Hedgehog ativa uma fina faixa de células anterior às células que expressam Engrailed. Apenas as células de um lado das células que expressam Engrailed são competentes para responder ao Hedgehog porque expressam a proteína receptora Patched . As células com receptor Patched ativado formam a proteína Wingless . Wingless é uma proteína secretada que atua nas fileiras adjacentes de células, ativando seu receptor de superfície celular, Frizzled .
Wingless atua nas células que expressam Engrailed para estabilizar a expressão Engrailed após a formação de blastoderme celular. A proteína cutícula nua é induzida por Wingless para limitar o número de fileiras de células que expressam Engrailed. A sinalização recíproca de curto alcance por Hedgehog e Wingless, mantida sob controle pelas proteínas Patched e Naked, estabiliza a fronteira entre cada segmento. A proteína sem asas é chamada de "sem asas" devido ao fenótipo de alguns mutantes sem asas . Wingless e Hedgehog também funcionam em vários tecidos posteriormente na embriogênese e também durante a metamorfose .
Os fatores de transcrição codificados pelos genes de segmentação regulam outra família de genes de controle do desenvolvimento, os genes seletores homeóticos . Esses genes existem em dois grupos ordenados no cromossomo 3 da Drosophila . A ordem dos genes no cromossomo reflete a ordem em que são expressos ao longo do eixo ântero-posterior do embrião em desenvolvimento. O grupo de genes seletores homeóticos Antennapedia inclui labial , antennapedia , sex combs reduzidos , deformados e proboscipedia . Proteínas labiais e deformadas são expressas em segmentos da cabeça, onde ativam os genes que definem as características da cabeça. Sex-combs -uced e Antennapedia especificam as propriedades dos segmentos torácicos. O grupo bitórax de genes seletores homeóticos controla as especializações do terceiro segmento torácico e os segmentos abdominais. Mutações em alguns genes homeóticos muitas vezes podem ser letais e o ciclo de vida termina na embriogênese.
Em 1995, o Prêmio Nobel de Fisiologia ou Medicina foi concedido por estudos relacionados ao controle genético do desenvolvimento embrionário inicial a Christiane Nüsslein-Volhard , Edward B. Lewis e Eric Wieschaus . Sua pesquisa sobre a triagem genética de mutantes de padronização de embriões revelou o papel desempenhado no desenvolvimento embriológico inicial por genes homeobox como o bicoid . Um exemplo de mutação homeótica é a chamada mutação Antennapedia. Em Drosophila , antenas e pernas são criadas pelo mesmo "programa" básico, elas diferem apenas em um único fator de transcrição. Se esse fator de transcrição for danificado, a mosca cria pernas na cabeça em vez de antenas. Veja imagens deste mutante "antennapedia" e outros, em FlyBase. Outro exemplo está no complexo de bitórax. Se ocorrerem mutações não letais neste complexo, isso pode fazer com que a mosca tenha dois conjuntos de asas, em vez de um par de asas e um par de halteres, que ajudam no equilíbrio durante o vôo.
Eixo dorsal-ventral
A formação do eixo dorsal-ventral depende da concentração nuclear ventral de um fator de transcrição sintetizado maternalmente denominado Dorsal. A determinação do lado dorsal do embrião ocorre durante a oogênese, quando o núcleo do oócito se move ao longo dos microtúbulos da margem posterior para a anterior dorsal do oócito. O núcleo expressa uma proteína chamada Gurken que é secretada localmente e, portanto, só ativa as células foliculares na região dorsal ao interagir com o receptor Torpedo. Isso inibe a produção da proteína Pipe e, portanto, as células foliculares que expressam Pipe estão no lado ventral. Pipe ativa uma cascata de protease extracelular no espaço perivitelino entre as células foliculares e o ovo, o que resulta na clivagem do Toll-ligand Spätzle e na ativação da cascata de sinalização de Toll no lado ventral. A proteína dorsal está presente em todo o citoplasma embrionário, mas ligada ao cacto, o que a impede de se translocar para o núcleo. A sinalização de pedágio resulta na degradação do cacto, o que permite que o Dorsal entre nos núcleos do lado ventral do blastoderma. No geral, uma diferença na localização do núcleo do oócito torna-se uma diferença no estado de sinalização das células foliculares circundantes, que então sinalizam para os núcleos de blastoderme resultantes.
Uma vez no núcleo, Dorsal ativa diferentes genes dependendo de sua concentração nuclear. Este processo configura um gradiente entre o lado ventral e dorsal do embrião de blastoderme com a repressão ou indução de genes alvo dorsais sendo regulados diferencialmente. Na extremidade ventral do embrião, os núcleos da blastoderme expostos a altas concentrações de proteína dorsal induzem a transcrição dos fatores de transcrição twist e caracol, enquanto reprimem o zerknüllt e o decapentaplégico . Isso resulta na formação do mesoderma. Nas regiões laterais do embrião, baixas concentrações nucleares de Dorsal levam à expressão de romboide que identifica o futuro neuroectoderma. Mais dorsalmente, a sinalização de Dpp ativa reprime o romboide , confinando-o aos núcleos da blastoderme lateral. No lado dorsal do embrião, os núcleos da blastoderme, onde há pouca ou nenhuma proteína nuclear dorsal, expressam zerknüllt , tollóide e decapentaplégico (Dpp). Isso leva à especificação de ectoderme não neural e, posteriormente, no estágio de blástula, à anmioserosa. A atividade ventral da proteína de sinalização da família TGF-β Dpp é mantida pela expressão do antagonista de Dpp secretado Sog (gastrulação curta) no neuroectoderma. Sog se liga ae impede que Dpp se espalhe para o lado ventral do embrião e através da clivagem de Sog por Tolloid também permite um aumento de gradiente de Dpp no lado dorsal. O eixo DV de Drosophila é devido à interação de dois gradientes - uma concentração ventral de atividade Dorsal nuclear e uma concentração dorsal de atividade Dpp.
Veja também
Referências
Origens
- Russell, PJ Genetics, a molecular approach. Terceiro. San Francisco, CA: Benjamin-Cummings Pub Co, 2009.
- Rivera-Pomar, R .; Jackle, H. (1996). "Dos gradientes às listras na embriogênese da drosofilia : Preenchendo as lacunas". Trends Genet . 12 (11): 478–483. doi : 10.1016 / 0168-9525 (96) 10044-5 . PMID 8973159 .