Reacções de substituição de carbonilo alfa-- Carbonyl alpha-substitution reactions
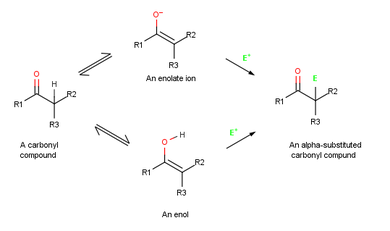
Reacções alfa-substituição ocorrer na posição ao lado do grupo carbonilo, o α-posição, e envolvem a substituição de um α hidrogénio átomo por um electrófilo , E, quer através de um enol ou ião enolato intermediário .
Conteúdo
mecanismo de reacção
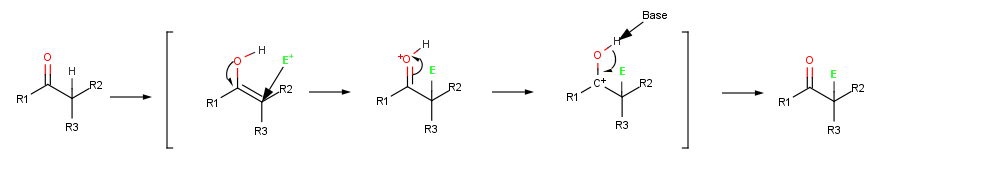
Porque suas duplas ligações são ricos em elétrons, enóis comportar como nucleófilos e reagem com eletrófilos em muito da mesma forma que alcenos fazer. Mas por causa da ressonância de elétrons doação de um lonepair de elétrons na vizinha oxigênio , enóis são mais elétron ricos e correspondentemente mais reativo do que alcenos. Repare no seguinte mapa de potencial electrostático de etenol (H 2 C = CHOH) como existe uma quantidade substancial de densidade de electrões no átomo de carbono α.
Quando um alceno reage com um electrófilo, tal como HCl , inicial adição de H + dá um intermediário catiónica e subsequente reacção com Cl - produz uma adição do produto . Quando um enol reage com um electrófilo, no entanto, apenas o passo de adição inicial é o mesmo. Em vez de reagir com CI - para dar um produto de adição, o catião intermediário perde o OH - de protões para dar um substituído-α composto de carbonilo .
Alfa-halogenação de aldeídos e cetonas
Uma reacção de substituição de α particularmente comum no laboratório é a halogenação de aldeídos e cetonas nas suas posições alfa por reacção Cl 2 , Br 2 ou I 2 em solução ácida. O bromo em ácido acético solvente é frequentemente utilizado.
Notavelmente, cetona de halogenação também ocorre em sistemas biológicos , particularmente em alga marinha, onde dibromoacetaldehyde, bromoacetona, 1, l, l -tribromoacetone, e outros compostos relacionados foram encontrados.
A halogenação é uma reacção típica α-substituição que procede catalisada por ácido formação de um intermediário de enol.
Acidez de átomos de hidrogénio-alfa: formação de iões enolato
Um átomo de hidrogénio na posição α de um composto de carbonilo é fracamente ácida e pode ser removido por uma forte base de para produzir um ião enolato. Em comparação acetona (pKa um = 19,3) com etano (pKa um = 60), por exemplo, a presença de um grupo carbonilo vizinho aumenta a acidez da cetona através da alcano por um factor de 10 40 .
A abstracção de um protão a partir de um composto de carbonilo ocorre quando a ligação de um grupo CH está orientada aproximadamente paralela para os p orbitais do grupo carbonilo. O átomo de carbono α do ião enolato é sp 2 com hibridação e tem um p orbital que se sobrepõe aos vizinhos carbonilo orbitais p. Assim, o negativo carga é compartilhada pelo electronegativo átomo de oxigénio, e o ião enolato é estabilizado por ressonância .
Os compostos de carbonilo são mais ácidos do que os alcanos, pela mesma razão que os ácidos carboxílicos são mais ácidos do que os álcoois. Em ambos os casos, os ânions são estabilizados por ressonância. Enolato iões diferem dos iões carboxilato, no entanto, em que as suas duas formas de ressonância não são de nível equivalente a forma com a carga negativa no oxigénio é inferior em energia do que a forma com a carga no carbono. No entanto, o princípio por trás de estabilização de ressonância é o mesmo em ambos os casos.
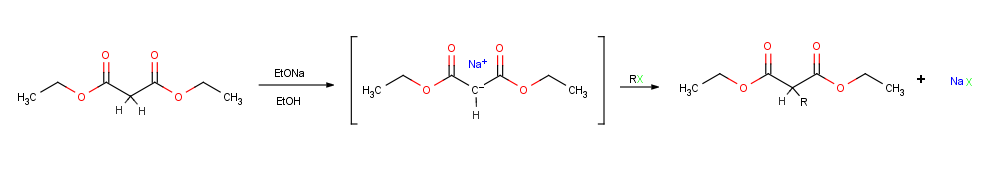
Porque os compostos de carbonilo são apenas fracamente ácido, uma base forte é necessário para a formação de iões enolato. Se um alcóxido tal como o etóxido de sódio é utilizado como base, a desprotonação ocorre apenas na medida de cerca de 0,1% porque acetona é um ácido mais fraco do que o etanol (pKa um = 16). Se, no entanto, uma base mais forte, tal como hidreto de sódio (NaH) ou di-isopropilameto de lítio ( LDA ), é utilizado um composto de carbonilo pode ser totalmente convertido no seu ião enolato. Diisopropilamida de lítio (LDA), o qual é facilmente preparado por reacção da base forte de butil-lítio com diisopropilamina , é amplamente utilizada no laboratório como uma base para a preparação de iões enolato a partir de compostos de carbonilo.
Muitos tipos de compostos de carbonilo, incluindo aldeídos , cetonas , ésteres , tioésteres , ácidos , e amidas , pode ser convertido em iões enolato por reacção com LDA. Note-se que os nitrilos , também, são acídicos e podem ser convertidas em aniões enolato semelhante (referidas como aniões de nitrilo ). Quando um átomo de hidrogénio é flanqueado por dois grupos carbonilo, a sua acidez é melhorada ainda mais. Esta acidez aumentada de compostos β-dicarbonilo é devido à estabilização dos iões enolato resultante por deslocalização da carga negativa sobre ambos os grupos carbonilo.
Reatividade de iões enolato
Íons enolato são mais úteis que enóis por duas razões. Em primeiro lugar, enóis puros não podem, normalmente, ser isolado, mas são em vez disso gerado apenas intermediários viveram como curtas em baixa concentração . Em contraste, as soluções estáveis de iões enolato puros são facilmente preparados a partir da maioria dos compostos de carbonilo por reacção com uma base forte. Em segundo lugar, os iões enolato são mais reactivos do que os enóis e passam por muitas reacções que enóis não fazer. Considerando enóis são neutros, os íons enolato- são carregados negativamente, tornando-os muito melhores nucleófilos. Como resultado, os iões enolato são mais comuns do que enóis em ambos laboratório e química biológica.
Porque eles são híbridos de ressonância de duas formas nonequivalent, iões enolato pode ser olhado quer como vinílicos alcóxidos (C = C-O - ) ou como a-ketocarbanions ( - CC = O). Assim, os iões enolato pode reagir com electrófilos quer no átomo de oxigénio ou de carbono. Reacção em oxigénio produz um derivado de enol, enquanto que a reacção em carbono origina um composto carbonil-substituo α. Ambos os tipos de reactividade são conhecidos, mas reacção sobre carbono é mais comum.
A alquilação de iões enolato
Talvez o mais importante única reacção de iões enolato é a sua alquilação por tratamento com um haleto de alquilo ou tosilato , formando assim uma nova ligação CC e juntar duas peças mais pequenas para uma maior molécula . A alquilação ocorre quando o ião enolato nucleofílico reage com o halogeneto de alquilo electrofílico num SN 2 de reacção e desloca o grupo de saída por ataque traseira.
Reações de alquilação estão sujeitos às mesmas restrições que afetam a todos SN 2 reações. Assim, o grupo abandonante X, em que o agente de alquilação RX pode ser cloreto , brometo , iodeto , ou tosilato . Telha alquilo grupo R deve ser primário ou metilo, e de preferência deve ser alilico ou benzílico . Halogenetos secundárias reagir mal, e haletos terciários não reagem em todos, porque um E2 competindo eliminação do HX ocorre em seu lugar. Halogenetos vinílicos e arilo também não são reactivos porque abordagem traseira está estericamente impedida.