Aryne - Aryne
Arinas ou benzinas são espécies altamente reativas derivadas de um anel aromático pela remoção de dois substituintes . As arinas mais comuns são orto, mas meta e para-arinas também são conhecidas. o -Arynes são exemplos de alcinos tensos .
Ligação em o -arynes
A representação alcina da benzina é a mais amplamente encontrada. o-Arynes, ou 1,2-didesidroarenos, são geralmente descritos como tendo uma ligação tripla tensionada.
Restrições geométricas na ligação tripla em orto- benzina resultam em sobreposição diminuída de orbitais p no plano e, portanto, ligação tripla mais fraca. A frequência vibracional da ligação tripla em benzina foi atribuída por Radziszewski como 1846 cm −1 , indicando uma ligação tripla mais fraca do que em alcino não tenso com frequência vibracional de aproximadamente 2150 cm −1 . No entanto, o orto- benzino é mais parecido com um alcino tenso do que com um biradical, como visto pela grande lacuna singleto-tripleto e reatividade semelhante ao alcino.
O LUMO de arino fica muito mais baixo do que o LUMO de alcinos não tensionados, o que o torna uma combinação de energia melhor para o HOMO de nucleófilos. Portanto, a benzina possui caráter eletrofílico e sofre reações com os nucleófilos. Uma análise detalhada de MO de benzina foi apresentada em 1968.
Geração de o -arynes
Devido à sua extrema reatividade, os arinos devem ser gerados in situ . Típico de outros intermediários reativos , a benzina deve ser capturada, caso contrário, ela se transforma em bifenileno .
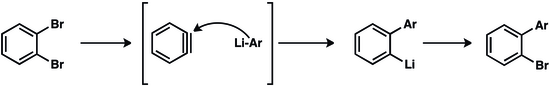
As primeiras rotas para a benzina envolveram a desidrohalogenação de haletos de arila :
Essas reações requerem base forte e altas temperaturas. Os arenos orto-dissubstituídos servem como precursores dos benzinos em condições mais suaves. Benzyne é gerado pela desalogenação do 2-bromofluorobenzeno pelo magnésio. O ácido antranílico pode ser convertido em 2-diazoniobenzeno-1-carboxilato por diazotização e neutralização. Embora explosiva, esta espécie zwitteriônica é um precursor conveniente e barato da benzina.
Outro método é baseado em triflatos de trimetilsililaril . O deslocamento de flúor do grupo trimetilsilil induz a eliminação de triflato e liberação de benzina:
Uma reação hexadeidro Diels-Alder (HDDA) envolve cicloadição de 1,3-diino e alcino.
N -amination de 1 H -benzotriazole com hidroxilamina- O -sulfónico gera um intermediário que pode ser oxidado para benzino, com um rendimento quase quantitativo com chumbo (IV) etilo .
Reações de o -arynes
Mesmo em baixas temperaturas, os arinos são extremamente reativos. Sua reatividade pode ser classificada em três classes principais: (1) adições nucleofílicas, (2) reações pericíclicas e (3) inserção de ligações.
Adições nucleofílicas a arinas
Após o tratamento com nucleófilos básicos, os halogenetos de arila desprotonam o alfa para o grupo de saída, resultando em desidrohalogenação . Estudos de troca de isótopos indicam que para os fluoretos de arila e, às vezes, os cloretos de arila, o evento de eliminação ocorre em duas etapas, desprotonação, seguida pela expulsão do nucleófilo. Assim, o processo é formalmente análogo ao mecanismo E1cb de compostos alifáticos. Os brometos e iodetos de arila, por outro lado, geralmente parecem sofrer eliminação por um mecanismo E2 sin-coplanar combinado. A benzina resultante forma produtos de adição, geralmente por adição nucleofílica e protonação. A geração do intermediário de benzina é a etapa lenta da reação.
As reações de "acoplamento de Aryne" permitem a geração de compostos bifenílicos que são valiosos na indústria farmacêutica, agricultura e como ligantes em muitas transformações catalisadas por metal.
O produto metal-areno também pode se somar a outro arino, levando à polimerização de crescimento em cadeia . O uso de cianeto de cobre (I) como iniciador para adicionar ao primeiro arino produziu polímeros contendo até cerca de 100 unidades de areno.
Quando o grupo de saída (LG) e o substituinte (Y) são mutuamente orto ou para, apenas um intermediário de benzina é possível. No entanto, quando LG é meta para Y, os resultados regioquímicos (A e B) são possíveis. Se Y é a retirada de elétrons, então H B é mais ácido do que H A resultando na geração do regioisômero B. Analogamente, se Y é doador de elétrons, o regioisômero A é gerado, pois agora H A é o próton mais ácido.
Existem dois regioisômeros possíveis de benzina com substituinte (Y): a ligação tripla pode ser posicionada entre C2 e C3 ou entre C3 e C4. Os substituintes orto do grupo de saída conduzirão à ligação tripla entre C2 e C3. Para Y e LG levarão a regioisômero com ligação tripla entre C3 e C4. O substituinte meta pode fornecer ambos os regioisômeros conforme descrito acima. No caso de ligação tripla localizada entre C2 e C3, substituintes retiradores de elétrons (EWG), por exemplo, CF3, irão direcionar a adição de nucleófilos para colocar o carbanião o mais próximo possível do EWG. No entanto, substituintes doadores de elétrons (EDG), por exemplo, CH3, fornecerão pouca seletividade entre os produtos. No regioisômero onde a ligação tripla está localizada entre C3 e C4, o efeito do substituinte na adição de nucleófilos é diminuído, e misturas de produtos para e meta são frequentemente obtidas.
Reações pericíclicas de arinas
Benzyne sofre uma rápida dimerização para formar bifenileno. Algumas rotas para a benzina levam a um rendimento especialmente rápido e alto dessa reação subsequente. A trimerização dá trifenileno .
As benzinas podem sofrer reações de [4 + 2] ciclização. Quando gerado na presença de antraceno , resulta em tripticeno . Neste método, o mecanismo combinado da reação de Diels-Alder entre a benzina e o furano é mostrado abaixo. Acredita-se que outras cicloadições de benzina [4 + 2] ocorram por meio de um mecanismo gradual.
Um exemplo clássico é a síntese de 1,2,3,4-tetrafenilnaftaleno . O tetrabromobenzeno pode reagir com butil - lítio e furano para formar um tetra- hidroantraceno
[4 + 2] cicloadições de arinas têm sido comumente aplicadas à síntese total de produtos naturais. A principal limitação de tal abordagem, entretanto, é a necessidade de usar dienos restritos, como furano e ciclopentadieno. Em 2009, Buszek e colaboradores sintetizaram o herbindol A usando aryne [4 + 2] -cycloaddition. 6,7-indolino sofre [4 + 2] cicloadição com ciclopentadieno para produzir o produto tetracíclico complexo.
As benzinas sofrem cicloadição [2 + 2] com uma ampla gama de alcenos. Devido à natureza eletrofílica da benzina, os alcenos com substituintes doadores de elétrons funcionam melhor para essa reação.
Devido à formação significativa de subprodutos, a química do arino [2 + 2] raramente é utilizada na síntese total de produtos naturais. No entanto, existem vários exemplos. Em 1982, Stevens e colegas de trabalho relataram uma síntese de taxodiona que utilizou [2 + 2] cicloadição entre um arino e um acetal de ceteno.
Mori e colaboradores realizaram uma [2 + 2 + 2] -cociclização catalisada por paládio de arino e diino em sua síntese total de taiwaninas C.
Reações de inserção de ligação de arines
O primeiro exemplo de reação de inserção da ligação σ de arina é a síntese de melleine em 1973.
Outros desidrobenzenos
Se a benzina for 1,2-didesidrobenzeno, dois outros isômeros são possíveis: 1,3-didesidrobenzeno e 1,4-didesidrobenzeno. Suas energias in silico são, respectivamente, 106, 122 e 138 kcal / mol (444, 510 e 577 kJ / mol). Os isômeros 1,2 e 1,3 têm estados fundamentais singletes, enquanto para 1,4-benzina a lacuna é menor.
A interconversão dos 1,2-, 1,3- e 1,4-didesidrobenzenos foi estudada. Postula-se que uma conversão de 1,2- a 1,3-didesidrobenzeno ocorre na pirólise (900 ° C) dos precursores arino substituídos com fenil, conforme mostrado abaixo. Temperaturas extremamente altas são necessárias para a interconversão de benzina.
1,4-didesidroarenos
Em experiências de 1,4-didehydrobenzene clássicos, aquecendo a 300 ° C, [1,6-D2] - Uma equilibra facilmente com [3,2-D2] - B , mas não se equilibrar com C ou D . A migração simultânea de átomos de deutério para a forma B e o fato de nenhum de C ou D ser formado só pode ser explicado pela presença de um intermediário cíclico e simétrico - 1,4-didesidrobenzeno.
Dois estados foram propostos para 1,4-didesidrobenzeno: singuleto e tripleto, com o estado singuleto mais baixo em energia. O estado tripleto representa dois centros radicais não interagentes e, portanto, deve abstrair os hidrogênios na mesma taxa do radical fenil. No entanto, o estado singlete é mais estabilizado do que o tripleto e, portanto, parte da energia de estabilização será perdida a fim de formar o estado de transição para a clivagem do hidrogênio, levando a uma abstração mais lenta do hidrogênio. Chen propôs o uso de análogos de 1,4-didesidrobenzeno que têm grandes lacunas de energia de singleto-tripleto para aumentar a seletividade de candidatos a drogas enedinas.
História
A primeira evidência de arynes veio do trabalho de Stoermer e Kahlert. Em 1902 eles observaram que após o tratamento de 3-bromobenzofurano com base em etanol, 2-etoxibenzofurano é formado. Com base nessa observação, eles postularam um intermediário arino.
Wittig et al. intermediário zwitteriônico invocado na reação de fluorobenzeno e fenilítio para dar bifenil. Essa hipótese foi posteriormente confirmada.
Em 1953, os experimentos de marcação com 14 C forneceram um forte suporte para a intermediação da benzina. John D. Roberts et al. mostrou que a reacção de clorobenzeno-1- 14 C e amida de potássio deu quantidades iguais de anilina com 14 C incorporação em C-1 e C-2.
Wittig e Pohmer descobriram que a benzina participa das reações de cicloadição [4 + 2].
Evidências adicionais para a existência de benzina vieram de estudos espectroscópicos. Benzyne foi observada em um "recipiente molecular".
Em 2015, uma única molécula de arino foi fotografada pela STM .
O m- benzino foi demonstrado pela primeira vez na década de 1990, quando foi gerado a partir de derivados de benzeno 1,3-dissubstituídos, como o peroxi éster 1,3-C 6 H 4 (O 2 C (O) CH 3 ) 2 .
Os avanços nas p- benzinas ocorreram na década de 1960, seguidos de estudos sobre a ciclização de Bergman . Esse tema tornou-se tópico com a descoberta dos "citostáticos" enediyne, como a caliqueamicina , que gera um 1,4-didesidrobenzeno.
Exemplos de benzinos em síntese total
Uma variedade de produtos naturais foi preparada usando arinas como intermediários. As adições nucleofílicas a arinas têm sido amplamente utilizadas na síntese total de produtos naturais. Na verdade, adições nucleofílicas de arinas são algumas das mais antigas aplicações conhecidas da química de arinas. A adição nucleofílica ao arino foi usada na tentativa de síntese de criptaustolina (1) e criptowolina (2).
A síntese do meroterpenóide tetracíclico (+) - lipágico envolveu um intermediário arino. Sua abordagem empregou uma ciclização arina para fechar o anel final do produto natural.
As reações multicomponentes de arinos são transformações poderosas que permitem a rápida formação de arenos 1,2-disubstituídos. Apesar de sua utilidade potencial, exemplos de reações arinas multicomponentes na síntese de produtos naturais são escassos. Uma reação de acoplamento de arino de quatro componentes foi empregada na síntese de desidroaltenueno B.
Veja também
- Mais exemplos de uso de química de arino: triciclobutabenzeno , in-metilciclofano , complexo de benzina de metal de transição
- O equivalente de piridina pyridyne
Referências
links externos
-
 Mídia relacionada a Arynes no Wikimedia Commons
Mídia relacionada a Arynes no Wikimedia Commons