Transportador de magnésio - Magnesium transporter
Transportadores de magnésio são proteínas que transportam magnésio através da membrana celular . Todas as formas de vida requerem magnésio , mas os mecanismos moleculares de captação de Mg 2+ do meio ambiente e a distribuição desse elemento vital dentro do organismo estão sendo elucidados lentamente.
A função ATPase do MgtA é altamente dependente da cardiolipina e demonstrou detectar magnésio livre na faixa de μM
Nas bactérias, o Mg 2+ é provavelmente fornecido principalmente pela proteína CorA e, onde a proteína CorA está ausente, pela proteína MgtE . Na levedura, a captação inicial é através das proteínas Alr1p e Alr2p, mas neste estágio a única proteína distribuidora interna de Mg 2+ identificada é a Mrs2p. Dentro dos protozoários, apenas um transportador de Mg 2+ (XntAp) foi identificado. Em metazoa, os homólogos Mrs2p e MgtE foram identificados, juntamente com dois novos sistemas de transporte de Mg 2+ , TRPM6 / TRPM7 e PCLN-1. Finalmente, em plantas, uma família de homólogos Mrs2p foi identificada junto com outra nova proteína, AtMHX.
Evolução
A evolução do transporte de Mg 2+ parece ter sido bastante complicada. Proteínas aparentemente baseadas em MgtE estão presentes em bactérias e metazoários, mas estão ausentes em fungos e plantas, enquanto proteínas aparentemente relacionadas ao CorA estão presentes em todos esses grupos. Os dois transportadores ativos presentes nas bactérias, MgtA e MgtB, não parecem ter qualquer homologia em organismos superiores. Existem também sistemas de transporte de Mg 2+ que são encontrados apenas nos organismos superiores.
Tipos
Há um grande número de proteínas ainda não identificadas que transportam Mg 2+ . Mesmo no eucarioto mais bem estudado, a levedura, Borrelly relatou um trocador Mg 2+ / H + sem uma proteína associada, que provavelmente está localizada no Golgi. Pelo menos um outro transportador principal de Mg 2+ na levedura ainda não foi contabilizado, o que afeta o transporte de Mg 2+ para dentro e para fora do vacúolo de levedura. Em organismos multicelulares superiores, parece que muitas proteínas transportadoras de Mg 2+ aguardam descoberta.
Os transportadores de Mg 2+ contendo o domínio CorA (CorA, semelhante a Alr e semelhante a Mrs2) têm um conjunto semelhante, mas não idêntico, de afinidades para cátions divalentes. Na verdade, esta observação pode ser estendida a todos os transportadores de Mg 2+ identificados até agora. Esta similaridade sugere que as propriedades básicas do Mg 2+ influenciam fortemente os possíveis mecanismos de reconhecimento e transporte. No entanto, esta observação também sugere que o uso de outros íons metálicos como traçadores para a absorção de Mg 2+ não produzirá necessariamente resultados comparáveis à capacidade do transportador de transportar Mg 2+ . Idealmente, o Mg 2+ deve ser medido diretamente.
Visto que 28 Mg 2+ é praticamente impossível de obter, muitos dos dados antigos precisarão ser reinterpretados com novas ferramentas para medir o transporte de Mg 2+ , se diferentes transportadores forem comparados diretamente. O trabalho pioneiro de Kolisek e Froschauer usando mag-fura 2 mostrou que o Mg 2+ livre pode ser medido de forma confiável in vivo em alguns sistemas. Ao retornar à análise de CorA com esta nova ferramenta, ganhamos uma importante linha de base para a análise de novos sistemas de transporte de Mg 2+ à medida que são descobertos. No entanto, é importante que a quantidade de transportador presente na membrana seja determinada com precisão, se forem feitas comparações da capacidade de transporte. Este sistema bacteriano também pode ser capaz de fornecer alguma utilidade para a análise de proteínas de transporte de Mg 2+ eucarióticas , mas as diferenças nos sistemas biológicos de procariotos e eucariotos terão que ser consideradas em qualquer experimento.
Função
Comparar as funções das proteínas de transporte de Mg 2+ caracterizadas é atualmente quase impossível, embora as proteínas tenham sido investigadas em diferentes sistemas biológicos usando diferentes metodologias e tecnologias. Encontrar um sistema onde todas as proteínas possam ser comparadas diretamente seria um grande avanço. Se as proteínas pudessem se mostrar funcionais em bactérias ( S. typhimurium ), então uma combinação das técnicas de mag-fura 2, quantificação da proteína na membrana do envelope e estrutura das proteínas (cristal de raio X ou crio- TEM) pode permitir a determinação dos mecanismos básicos envolvidos no reconhecimento e transporte do íon Mg 2+ . No entanto, talvez o melhor avanço seja o desenvolvimento de métodos que permitam medir a função da proteína no sistema patch-clamp por meio de membranas artificiais.
Bactérias
Pesquisa inicial
Em 1968, Lusk descreveu a limitação do crescimento bacteriano ( Escherichia coli ) em meio pobre em Mg 2+ , sugerindo que as bactérias necessitavam de Mg 2+ e provavelmente absorviam ativamente este íon do ambiente. No ano seguinte, o mesmo grupo e outro grupo, Silver, descreveram independentemente a captação e o efluxo de Mg 2+ em células de E. coli metabolicamente ativas usando 28 Mg 2+ . No final de 1971, dois artigos foram publicados descrevendo a interferência de Co 2+ , Ni 2+ e Mn 2+ no transporte de Mg 2+ em E. coli e em Aerobacter aerogenes e Bacillus megaterium. No último grande desenvolvimento antes da clonagem dos genes que codificam os transportadores, foi descoberto que havia um segundo sistema de captação de Mg 2+ que apresentava afinidade e cinética de transporte semelhantes ao primeiro sistema, mas tinha uma gama diferente de sensibilidades aos cátions interferentes . Este sistema também foi reprimível por altas concentrações extracelulares de Mg 2+ .
CorA
O gene CorA e sua proteína correspondente são o sistema de transporte de Mg 2+ mais exaustivamente estudado em qualquer organismo. A maior parte da literatura publicada sobre o gene CorA vem do laboratório de ME Maguire. Recentemente, o grupo de RJ Schweyen teve um impacto significativo na compreensão do transporte de Mg 2+ pelo CorA. O gene foi originalmente nomeado após o fenótipo resistente ao cobalto em E. coli que foi causado pela inativação do gene.
O gene foi geneticamente identificado em E. coli por Park et al. , mas não foi clonado até Hmiel et al. isolou o homólogo de Salmonella enterica serovar Typhimurium ( S. typhimurium ). Mais tarde, Smith e Maguire mostraram que o gene CorA estava presente em 17 bactérias gram-negativas. Com o grande número de sequências genômicas completas agora disponíveis para procariotos, CorA demonstrou ser virtualmente onipresente entre as Eubactérias, além de ser amplamente distribuído entre as Archaea. O locus CorA em E. coli contém um único quadro de leitura aberto de 948 nucleotídeos, produzindo uma proteína de 316 aminoácidos. Esta proteína é bem conservada entre as Eubactérias e Archaea. Entre E. coli e S. typhimurium , as proteínas são 98% idênticas, mas em espécies mais distantemente relacionadas, a semelhança cai para entre 15 e 20%. Nos genes mais distantemente relacionados, a similaridade é freqüentemente restrita à parte C-terminal da proteína, e um pequeno motivo de aminoácido GMN dentro desta região é altamente conservado. O domínio CorA, também conhecido como PF01544 no banco de dados de domínio de proteína conservada pFAM ( http://webarchive.loc.gov/all/20110506030957/http%3A//pfam.sanger.ac.uk/ ), está adicionalmente presente em um ampla gama de organismos superiores, e esses transportadores serão analisados a seguir.
O gene CorA é expresso constitutivamente em S. typhimurium sob uma ampla faixa de concentrações externas de Mg 2+ . No entanto, evidências recentes sugerem que a atividade da proteína pode ser regulada pelo sistema regulador de dois componentes PhoPQ . Este sensor responde a baixas concentrações externas de Mg 2+ durante o processo de infecção de S. typhimurium em humanos. Em condições externas baixas de Mg 2+ , foi relatado que o sistema PhoPQ suprime a função de CorA e foi anteriormente demonstrado que a transcrição dos transportadores alternativos de Mg 2+ , MgtA e MgtB, é ativada nessas condições. Chamnongpol e Groisman sugerem que isso permite que as bactérias escapem da toxicidade de íons metálicos causada pelo transporte de outros íons, particularmente Fe (II), por CorA na ausência de Mg 2+ . Papp e Maguire oferecem um relatório conflitante sobre a origem da toxicidade.
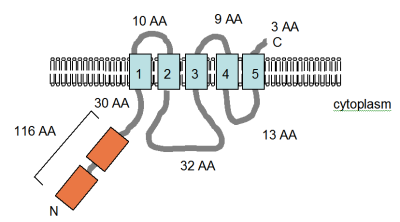
A figura (fora da escala) mostra a topologia do domínio transmembrana (TM) publicada originalmente da proteína CorA de S. typhimurium , que foi dito ter três regiões que abrangem a membrana na parte C-terminal da proteína (mostrada em azul), conforme determinado por Smith et al. . Evidências para CorA atuando como homotetrâmero foram publicadas por Warren et al. em 2004. Em dezembro de 2005, a estrutura cristalina do canal CorA foi postada no banco de dados de estrutura de proteínas RSCB. Os resultados mostraram que a proteína tem dois domínios TM e existe como um homopentâmero, em conflito direto com os relatórios anteriores. Siga este link para ver a estrutura em 3D . As partes intracelulares solúveis da proteína são altamente carregadas, contendo 31 resíduos carregados positivamente e 53 negativamente carregados. Por outro lado, os domínios TM contêm apenas um aminoácido carregado, que se mostrou não importante na atividade do transportador. A partir de experimentos de mutagênese, parece que a química do transporte de Mg 2+ depende dos grupos hidroxila que revestem o interior do poro de transporte; há também um requisito absoluto para o motivo GMN (mostrado em vermelho).
Antes que a atividade de CorA pudesse ser estudada in vivo , quaisquer outros sistemas de transporte de Mg 2+ no hospedeiro bacteriano tiveram que ser identificados e inativados ou deletados (ver abaixo). Uma cepa de S. typhimurium contendo um gene CorA funcional, mas sem MgtA e MgtB foi construída (também veja abaixo), e a cinética de absorção do transportador foi analisada. Esta cepa mostrou taxas de crescimento quase normais em meio padrão (50 μM Mg 2+ ), mas a remoção de todos os três genes criou uma cepa bacteriana que requer 100 mM de Mg 2+ externo para o crescimento normal.
O Mg 2+ é transportado para dentro de células contendo apenas o sistema de transporte CorA com cinética e sensibilidades catiônicas semelhantes à captação de Mg 2+ descrita nos artigos anteriores, e foi adicionalmente quantificado (ver tabela). A captação de Mg 2+ atingiu um platô como em estudos anteriores e, embora nenhum mecanismo real para a diminuição do transporte tenha sido determinado, então foi assumido que a proteína está inativada. Co 2+ e Ni 2+ são tóxicos para células de S. typhimurium contendo uma proteína CorA funcional e esta toxicidade decorre do bloqueio da captação de Mg 2+ (inibição competitiva) e do acúmulo desses íons dentro da célula. Foi demonstrado que o Co 2+ e o Ni 2+ são transportados por CorA usando análise de traçador radioativo, embora com afinidades (km) e velocidades (Vmax) mais baixas do que para o Mg 2+ (ver tabela). Os valores de km para Co 2+ e Ni 2+ estão significativamente acima dos esperados para serem encontrados pelas células em seu ambiente normal, portanto, é improvável que o sistema de transporte CorA medeie a absorção desses íons em condições naturais. Até o momento, a evidência de transporte de Mn 2+ por CorA é limitada a E. coli .
| Mg 2+ | Co 2+ | Ni 2+ | |
|---|---|---|---|
| km (μM) | 15 | 30 | 240 |
| Vmax (pmol / min / 10 8 células) | 250 | 500 | 360 |
| Ki (μM) - Mg | - | - | 10 |
| Ki (μM) - Co | 50 | - | 20 |
| Ki (μM) - Mn | 30 | - | - |
| Ki (μM) - Ni | 300 | - | 300 |
A tabela lista a cinética de transporte do sistema de transporte CorA Mg 2+ . Esta tabela foi compilada a partir das publicações de Snavely et al. (1989b), Gibson et al. (1991) e Smith et al. (1998a) e resume os dados cinéticos para a proteína de transporte CorA expressa a partir do promotor de tipo selvagem em bactérias sem MgtA e MgtB. km e Vmax foram determinados a 20 ° C, uma vez que a absorção de Mg 2+ a 37 ° C era muito rápida para medir com precisão.
Recentemente, a fluorescência dependente de Mg 2+ de mag-fura 2 foi usada para medir o conteúdo de Mg 2+ livre de células de S. typhimurium em resposta a Mg 2+ externo , o que mostrou que CorA é o principal sistema de absorção de Mg 2+ em bactérias. Os autores também mostraram pela primeira vez que as mudanças no potencial elétrico (ΔΨ) através da membrana plasmática da célula afetaram tanto a taxa de captação de Mg 2+ quanto o conteúdo de Mg 2+ livre da célula; a despolarização suprimiu o transporte, enquanto a hiperpolarização aumentou o transporte. A cinética de transporte foi definida apenas pela taxa de variação do Mg 2+ livre no interior das células (250 μM s −1 ). Porque nenhuma quantificação da quantidade de proteína CorA na membrana foi feita, este valor não pode ser comparado com outros experimentos em transportadores de Mg 2+ .
O efluxo de Mg 2+ das células bacterianas foi observado pela primeira vez por Lusk e Kennedy (1969) e é mediado pelo sistema de transporte CorA Mg 2+ na presença de altas concentrações extracelulares de Mg 2+ . O efluxo também pode ser desencadeado por Co 2+ , Mn 2+ e Ni 2+ , embora não no mesmo grau que o Mg 2+ . Nenhum efluxo de Co 2+ foi observado através do sistema de transporte CorA. O processo de efluxo de Mg 2+ requer adicionalmente um dos genes CorB, CorC ou CorD. A mutação de qualquer um desses genes leva a uma resistência ao Co 2+ um pouco menos da metade daquela fornecida por um mutante CorA. Este efeito pode ser devido à inibição da perda de Mg 2+ que, de outra forma, ocorreria na presença de níveis elevados de Co 2+ . Não se sabe se o Mg 2+ é mais tóxico quando os genes CorBCD são deletados.
Especula-se que o íon Mg 2+ irá interagir inicialmente com qualquer proteína de transporte através de sua camada de hidratação. Cobalto (III) hexaammina, Co (III) Hex, é um análogo covalentemente ligado (não lábil) para a primeira camada de hidratação para vários cátions divalentes, incluindo Mg 2+ . O raio da molécula Co (III) Hex é 244 pm, muito semelhante ao raio de 250 pm da primeira camada de hidratação de Mg 2+ . Este análogo é um inibidor potente do sistema de transporte CorA, mais do que Mg 2+ , Co 2+ ou Ni 2+ . A força adicional da inibição do Co (III) Hex pode vir do bloqueio do poro de transporte devido à incapacidade da proteína de 'desidratar' o substrato. Também foi mostrado que Co (III) Hex não foi transportado para as células, sugerindo que pelo menos desidratação parcial seria necessária para o transporte do substrato normal (Mg 2+ ). A hexaammina de níquel (II), com raio de 255 pm, não inibiu o sistema de transporte de CorA, sugerindo que existe um limite máximo de tamanho para a ligação do íon substrato CorA. Esses resultados sugerem que a propriedade importante envolvida no reconhecimento do Mg 2+ pelo CorA é o tamanho do íon com sua primeira camada de hidratação. Portanto, a mudança de volume geralmente citada para o íon Mg 2+ puro a hidratado de mais de 500 vezes, incluindo a segunda esfera de hidratação, pode não ser biologicamente relevante e pode ser uma razão para a mudança de volume da primeira esfera de 56- dobra para ser mais comumente usado.
MgtA e MgtB
A presença destes dois genes foi a primeira suspeita quando Nelson e Kennedy (1972) mostraram que houve Mg 2+ -repressible e não reprimível de Mg 2+ absorção de sistemas em E. coli . A absorção não reprimível de Mg 2+ é mediada pela proteína CorA. Em S. typhimurium, a captação repressível de Mg 2+ foi eventualmente demonstrada por meio das proteínas MgtA e MgtB.
Tanto o MgtA quanto o MgtB são regulados pelo sistema PhoPQ e são transcritos ativamente durante o processo de infecção de pacientes humanos por S. typhimurium . Embora nenhum dos genes seja necessário para a patogenicidade, a proteína MgtB aumenta a sobrevivência a longo prazo do patógeno na célula. Os genes também são regulados positivamente in vitro quando a concentração de Mg 2+ cai abaixo de 50 μM (Snavely et al. , 1991a). Embora as proteínas tenham valores de km semelhantes a CorA e taxas de transporte aproximadamente 10 vezes menores, os genes podem fazer parte de um sistema de eliminação de Mg 2+ . Chamnongpol e Groisman (2002) apresentam evidências de que o papel dessas proteínas pode ser o de compensar a inativação da proteína CorA pelo regulon PhoPQ. Os autores sugerem que a proteína CorA é inativada para permitir evitar a toxicidade do metal por meio da proteína em ambientes de baixo Mg 2+ a que S. typhimurium é submetido pelas células após a infecção.
As proteínas são ambas ATPases do tipo P e nenhum dos genes mostra qualquer semelhança com CorA. As proteínas MgtA e MgtB são 75% semelhantes (50% idênticas), embora pareça que MgtB possa ter sido adquirido por transferência horizontal de genes como parte da Ilha de Patogenicidade de Salmonella 3. A topologia TM da proteína MgtB foi determinada experimentalmente, mostrando que a proteína tem dez hélices que abrangem a TM com os terminais da proteína no citoplasma (veja a figura). O MgtA está presente em bactérias amplamente divergentes, mas não é tão comum quanto o CorA, enquanto o MgtB parece ter uma distribuição bastante restrita. Nenhuma hipótese para a distribuição incomum foi sugerida.
A figura, adaptada de Smith et al. (1993b), mostra a topologia de membrana determinada experimentalmente da proteína MgtB em S. typhimurium . Os domínios TM são mostrados em azul claro e a orientação na membrana e as posições dos terminais N e C são indicadas. A figura não está desenhada em escala.
Embora as proteínas MgtA e MgtB sejam muito semelhantes, elas apresentam algumas pequenas diferenças na atividade. O MgtB é muito sensível à temperatura, perdendo toda a atividade (no que diz respeito ao transporte do Mg 2+ ) a uma temperatura de 20 ° C. Além disso, MgtB e MgtA são inibidos por diferentes faixas de cátions (Tabela A10.1).
A tabela lista as características de transporte catiônico das proteínas MgtA e MgtB em S. typhimurium , bem como os dados cinéticos para as proteínas de transporte MgtA e MgtB a 37 ° C. Os números Vmax listados entre parênteses são aqueles para absorção a 20 ° C. A inibição do transporte de Mg 2+ por Mn 2+ via MgtA mostrou cinética incomum (ver Figura 1 de Snavely et al. , 1989b)
| Mg 2+ | Co 2+ | ||||
|---|---|---|---|---|---|
| km (μM) | Vmax (pmol / min / 10 8 células) | Ki (μM) | |||
| Co 2+ | Mn 2+ | Ni 2+ | |||
| MgtA | 29 | 115 (24) | 40 | x | 30 |
| MgtB | 6 | 75 (<2) | 8 | 40 | 13 |
As proteínas de MGTA e MgtB são ATPases, utilizando uma molécula de ATP por ciclo de transporte, ao passo que o Mg 2+ absorção através Cora é simplesmente electroquimicamente favorável. Chamnongpol e Groisman (2002) sugeriram que as proteínas MgtA e MgtB fazem parte de um sistema de prevenção de toxicidade de metal. Alternativamente, como a maioria das ATPases do tipo P funcionam como transportadores mediadores de efluxo, foi sugerido que as proteínas MgtA e MgtB atuam como proteínas de efluxo para um cátion atualmente não identificado e o transporte de Mg 2+ é inespecífico ou trocado para manter o eletro -neutralidade do processo de transporte. Outros experimentos serão necessários para definir a função fisiológica dessas proteínas.
MgtE
| MgtE | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estrutura cristalina do transportador de magnésio MgtE. PDB 2zy9
| |||||||||
| Identificadores | |||||||||
| Símbolo | MgtE | ||||||||
| Pfam | PF01769 | ||||||||
| InterPro | IPR006667 | ||||||||
| TCDB | 1.A.26 | ||||||||
| Proteína OPM | 2yvx | ||||||||
| |||||||||
Dois artigos descrevem o MgtE, uma quarta proteína de absorção de Mg 2+ em bactérias não relacionadas a MgtA / B ou CorA. Este gene foi sequenciado e prevê-se que a proteína, com 312 aminoácidos de tamanho, contenha quatro ou cinco domínios abrangentes de TM que estão intimamente organizados na parte C-terminal da proteína (ver figura). Esta região da proteína foi identificada no banco de dados Pfam como um domínio de proteína conservado (PF01769) e as espécies contendo proteínas que têm este domínio de proteína são distribuídas de forma quase igual em todas as Eubacteria e Archaea, embora seja bastante raro em comparação com a distribuição de CorA. No entanto, a diversidade das proteínas contendo o domínio é significativamente maior do que a do domínio CorA. O banco de dados Pfam lista sete grupos distintos de proteínas contendo domínio MgtE, dos quais seis contêm um membro arcaico ou eubacteriano. A expressão de MgtE é freqüentemente controlada por uma estrutura de RNA conservada, líder YkoK ou M-box.
A figura (à direita), adaptada de Smith et al. (1995) e a entrada do banco de dados PFAM, mostra a topologia de membrana prevista por computador da proteína MgtE em Bacillus firmus OF4. Os domínios TM são mostrados em azul claro. Os domínios CBS , nomeados para a proteína em que foram identificados, cistationina-beta sintase , mostrado em laranja, são identificados no banco de dados Pfam como domínios reguladores, mas o mecanismo de ação ainda não foi descrito. Eles são encontrados em vários canais de cloreto dependentes de voltagem. A orientação na membrana e as posições dos terminais N e C são indicadas. Esta figura não está desenhada em escala. Recentemente, esse transportador teve sua estrutura resolvida por cristalografia de raios-x.
O gene MgtE foi identificado pela primeira vez por Smith et al. (1995) durante uma triagem de proteínas semelhantes a CorA em bactérias e complementa a cepa MM281 de S. typhimurium deficiente na absorção de Mg 2+ (corA mgtA mgtB), restaurando o crescimento de tipo selvagem em meio padrão. A cinética de transporte de Mg 2+ para a proteína não foi determinada, pois 28 Mg 2+ não estava disponível. Como um substituto, a captação de 57 Co 2+ foi medida e mostrou ter um km de 82 μM e um Vmax de 354 pmol min −1 10 8 células −1 . O Mg 2+ foi um inibidor competitivo com um Ki de 50 μM - o Ki de inibição do Mg 2+ da captação de 60 Co 2+ via CorA é de 10 μM. Uma comparação dos dados cinéticos disponíveis para MgtA e CorA é mostrada na tabela. Claramente, MgtE não transporta Co 2+ para o mesmo grau como cora, e a inibição do transporte pelo Mg 2+ também é menos eficiente, o que sugere que a afinidade de MgtE para o Mg 2+ é menor do que a cora. O inibidor mais forte da captação de Co 2+ foi o Zn 2+ , com um Ki de 20 μM. O transporte de Zn 2+ por esta proteína pode ser tão importante quanto o de Mg 2+ .
| Mg 2+ | Co 2+ | ||||
|---|---|---|---|---|---|
| km (μM) | Vmax (pmol / min / 10 8 células) | km (μM) | Vmax (pmol / min / 10 8 células) | Ki (Mg 2+ ) (μM) | |
| MgtE | - | - | 82 (a 37 ° C) | 354 (a 37 ° C) | 50 (a 37 ° C) |
| CorA | 15 (a 20 ° C) | 250 (a 20 ° C) | 30 (a 22 ° C) | 500 (a 22 ° C) | 10 (a 22 ° C) |
A tabela mostra uma comparação da cinética de transporte de MgtE e CorA, e os principais valores dos parâmetros cinéticos para eles são listados. Conforme mostrado, os dados foram gerados em diferentes temperaturas de incubação. km e Ki não são significativamente alterados pelas diferentes temperaturas de incubação. Por outro lado, Vmax mostra uma forte correlação positiva com a temperatura, portanto, o valor de Co 2+ Vmax para MgtE não é diretamente comparável com os valores para CorA.
Fermento
Pesquisa inicial
A primeira pesquisa mostrando que a levedura absorve Mg 2+ parece ter sido feita por Schmidt et al. (1949). No entanto, esses autores só mostraram conteúdo alterado de Mg 2+ na levedura em uma tabela dentro do artigo, e as conclusões do relatório tratavam inteiramente do metabolismo do fosfato. Uma série de experimentos de Rothstein mudou o foco mais para a absorção dos cátions metálicos, mostrando que a levedura capta cátions com as seguintes séries de afinidade; Mg 2+ , Co 2+ , Zn 2+ > Mn 2+ > Ni 2+ > Ca 2+ > Sr 2+ . Além disso, foi sugerido que o transporte dos diferentes cátions é mediado pelo mesmo sistema de transporte - uma situação muito parecida com a das bactérias.
Em 1998, MacDiarmid e Gardner finalmente identificaram as proteínas responsáveis pelo fenótipo de transporte catiônico observado em Saccharomyces cerevisiae . Os genes envolvidos neste sistema e um segundo sistema de transporte mitocondrial de Mg 2+ , funcionalmente identificado de forma significativa após a clonagem do gene, são descritos nas seções abaixo.
ALR1 e ALR2
Dois genes, ALR1 e ALR2, foram isolados em uma triagem para tolerância ao Al 3+ (resistência) em leveduras. As construções de superexpressão contendo DNA genômico de levedura foram introduzidas na levedura de tipo selvagem e os transformantes foram rastreados quanto ao crescimento em níveis tóxicos de Al 3+ . Os plasmídeos contendo ALR1 e ALR2 permitiram o crescimento de levedura nestas condições.
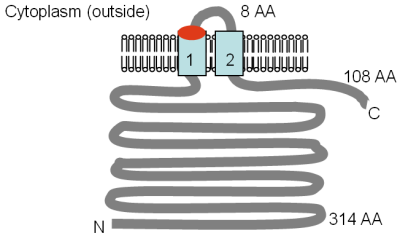
As proteínas Alr1p e Alr2p consistem em 859 e 858 aminoácidos, respectivamente, e são 70% idênticas. Em uma região no C-terminal, metade dessas proteínas são fracamente semelhantes à proteína CorA completa. A topologia TM prevista por computador do Alr1p é mostrada na figura. A presença de um terceiro domínio de TM foi sugerida por MacDiarmid e Gardner (1998), com base na homologia de sequência, e mais recentemente por Lee e Gardner (2006), com base em estudos de mutagênese, tornando a topologia de TM dessas proteínas mais como o de CorA (veja a figura). Além disso, Alr1p contém o motivo GMN conservado na extremidade externa de TM 2 (TM 2 ') e a mutação da metionina (M) neste motivo para uma leucina (L) levou à perda da capacidade de transporte.
A figura mostra as duas topologias TM possíveis do Alr1p. A parte A da figura mostra a topologia de membrana prevista por computador da proteína Alr1p em levedura e a parte B mostra a topologia de Alr1p com base nos resultados experimentais de Lee e Gardner (2006). A localização do motivo GMN é indicada em vermelho e os domínios TM em azul claro. A orientação na membrana e as posições dos terminais N e C são indicadas, os vários tamanhos dos domínios solúveis são dados em aminoácidos (AA) e os domínios TM são numerados pela sua semelhança com CorA. Onde qualquer domínio TM está faltando, os domínios restantes são numerados com números primos. A figura não está desenhada em escala. Um terceiro gene semelhante a ALR está presente em S. cerevisiae e há dois genes homólogos em Schizosaccharomyces pombe e Neurospora crassa . Essas proteínas contêm um motivo GMN como o de CorA, com exceção do segundo gene de N. crassa . Nenhum gene do tipo ALR foi identificado em espécies fora dos fungos.
Os estudos de fracionamento de membrana e fusão de proteína fluorescente verde (GFP) estabeleceram que Alr1p está localizado na membrana plasmática. Observou-se que a localização do Alr1p é internalizada e degradada no vacúolo em resposta a cátions extracelulares. Mg 2+ , em concentrações extracelulares muito baixas (100 μM; <10% do conteúdo de Mg 2+ da mídia padrão ), e Co 2+ e Mn 2+ em concentrações relativamente altas (> 20 × mídia padrão), induziram a mudança em Localização da proteína Alr1p, e o efeito era dependente da ubiquitinação funcional, endocitose e degradação vacuolar. Este mecanismo foi proposto para permitir a regulação da absorção de Mg 2+ pela levedura. No entanto, um relatório recente indica que várias das observações feitas por Stadler et al. não eram reproduzíveis. Por exemplo, a regulação do acúmulo de mRNA de ALR1 pelo suprimento de Mg 2+ não foi observada, e a estabilidade da proteína Alr1 não foi reduzida pela exposição ao excesso de Mg 2+ . A observação original do acúmulo dependente de Mg da proteína Alr1 sob condições de baixo Mg em estado estacionário foi replicada, mas este efeito foi mostrado ser um artefato causado pela adição de um pequeno peptídeo (epítopo) à proteína para permitir sua detecção . Apesar desses problemas, a atividade Alr1 demonstrou responder ao suprimento de Mg, sugerindo que a atividade da proteína é regulada diretamente, como foi observado para algumas proteínas bacterianas CorA.
Um Alr1p funcional (tipo selvagem) ou Alr2p (superexpresso) é necessário para o crescimento de S. cerevisiae em condições padrão (4 mM Mg 2+ ), e Alr1p pode suportar o crescimento normal em concentrações de Mg 2+ tão baixas quanto 30 μM. O 57 Co 2+ é absorvido pela levedura através da proteína Alr1p com um km de 77 - 105 μM (; C. MacDiarmid e RC Gardner, dados não publicados), mas o Ki para a inibição do Mg 2+ desse transporte é atualmente desconhecido. O transporte de outros cátions pela proteína Alr1p foi testado pela inibição do crescimento da levedura. A superexpressão de Alr1p levou ao aumento da sensibilidade a Ca 2+ , Co 2+ , Cu 2+ , La 3+ , Mn 2+ , Ni 2+ e Zn 2+ , uma matriz de cátions semelhantes àqueles que foram transportados para a levedura por um sistema de transporte semelhante ao CorA. O aumento da toxicidade dos cátions na presença do transportador é considerado devido ao aumento do acúmulo do cátion dentro da célula.
A evidência de que Alr1p é principalmente um transportador de Mg 2+ é que a perda de Alr1p leva a uma diminuição do conteúdo celular total de Mg 2+ , mas não de outros cátions. Além disso, dois estudos eletrofisiológicos onde Alr1p foi produzido em leveduras ou oócitos de Xenopus mostraram uma corrente dependente de Mg 2+ na presença da proteína; Salih et al. , em preparação.
A cinética de captação de Mg 2+ por Alr1p foi investigada por técnicas de eletrofisiologia em células de levedura inteiras. Os resultados sugeriram que o Alr1p provavelmente atua como um canal seletivo para íons. No mesmo artigo, os autores relataram que o transporte de Mg 2+ pelo Alr1p variou de 200 pA a 1500 pA, com corrente média de 264 pA. Nenhuma quantificação da quantidade de proteína que produz a corrente foi apresentada, portanto, os resultados carecem de comparabilidade com as proteínas de transporte de Mg 2+ bacterianas .
As técnicas alternativas de análise do radiotraçador 28 Mg 2+ e mag-fura 2 para medir a captação de Mg 2+ ainda não foram usadas com Alr1p. 28 Mg 2+ não está disponível atualmente e o sistema mag-fura 2 provavelmente não fornecerá dados de absorção simples na levedura. A célula de levedura mantém uma distribuição heterogênea de Mg 2+, sugerindo que vários sistemas dentro da levedura estão transportando Mg 2+ para os compartimentos de armazenamento. Este transporte interno muito provavelmente mascarará o processo de captação. A expressão de ALR1 em S. typhimurium sem genes de captação de Mg 2+ pode ser uma alternativa, mas, como afirmado anteriormente, os efeitos de um sistema de expressão heterólogo precisariam ser levados em consideração.
MNR2
O gene MNR2 codifica uma proteína intimamente relacionada às proteínas Alr, mas inclui características conservadas que definem um subgrupo distinto de proteínas CorA em genomas fúngicos, sugerindo um papel distinto na homeostase do Mg 2+ . Como um mutante alr1, o crescimento de um mutante mnr2 foi sensível a condições deficientes em Mg 2+ , mas o mutante mnr2 foi observado para acumular mais Mg 2+ do que uma cepa de tipo selvagem sob essas condições. Esses fenótipos sugerem que o Mnr2 pode regular o armazenamento de Mg 2+ em um compartimento intracelular. Consistente com esta interpretação, a proteína Mnr2 foi localizada na membrana do vacúolo, um compartimento interno implicado no armazenamento do excesso de nutrientes minerais pela levedura. Um papel direto de Mnr2 no transporte de Mg 2+ foi sugerido pela observação de que o aumento da expressão de Mnr2, que redirecionava alguma proteína Mnr2 para a superfície da célula, também suprimia a necessidade de Mg 2+ de uma cepa dupla mutante alr1 alr2. A mutação mnr2 também alterou o acúmulo de outros cátions divalentes, sugerindo que essa mutação pode aumentar a expressão do gene Alr ou a atividade da proteína. Um trabalho recente apoiou este modelo, mostrando que a atividade Alr1 foi aumentada em uma cepa mutante mnr2, e que a mutação estava associada à indução da atividade Alr1 em uma concentração externa de Mg mais alta do que a observada para uma cepa Mnr2 de tipo selvagem. Esses efeitos foram observados sem qualquer alteração no acúmulo da proteína Alr1, novamente indicando que a atividade Alr1 pode ser regulada diretamente pela concentração de Mg dentro da célula.
MRS2 e Lpe10
Como os genes ALR, o gene MRS2 foi clonado e sequenciado antes de ser identificado como um transportador de Mg 2+ . O gene MRS2 foi identificado no genoma nuclear de levedura em uma triagem de supressores de uma mutação de splicing de RNA do gene mitocondrial, e foi clonado e sequenciado por Wiesenberger et al. (1992). Mrs2p não foi identificada como um transportador putativo de Mg 2+ até Bui et al. (1999). Gregan et al. (2001a) identificaram LPE10 por homologia com MRS2 e mostraram que ambos os mutantes LPE10 e MRS2 alteraram o conteúdo de Mg 2+ da mitocôndria de levedura e afetaram a atividade de splicing do RNA na organela. Foi demonstrado que o transporte de Mg 2+ é mediado diretamente por Mrs2p, mas não para Lpe10p.
As proteínas Mrs2p e Lpe10p têm 470 e 413 resíduos de aminoácidos em tamanho, respectivamente, e uma região de 250-300 aminoácidos no meio das proteínas mostra uma semelhança fraca com a proteína CorA completa. As topologias TM das proteínas Mrs2p e Lpe10p foram avaliadas usando um ensaio de proteção de protease e são mostradas na figura. TM 1 e 2 correspondem a TM 2 e 3 na proteína CorA. O motivo GMN conservado está na extremidade externa do primeiro domínio TM, e quando a glicina (G) neste motivo foi mutada para uma cisteína (C) na Mrs2p, o transporte de Mg 2+ foi fortemente reduzido.
A figura mostra a topologia determinada experimentalmente de Mrs2p e Lpe10p conforme adaptado de Bui et al. (1999) e Gregan et al. (2001a). A localização do motivo GMN é indicada em vermelho e os domínios TM em azul claro. A orientação na membrana e as posições dos terminais N e C são indicadas. Os vários tamanhos dos domínios solúveis são dados em aminoácidos (AA), os domínios TM estão numerados e a figura não está desenhada à escala.
Mrs2p foi localizada na membrana mitocondrial interna por fracionamento subcelular e imunodetecção e Lpe10p na mitocôndria. Mitocôndrias sem Mrs2p não mostram uma captação rápida de Mg 2+ , apenas um 'vazamento' lento, e a superacumulação de Mrs2p leva a um aumento na taxa inicial de absorção. Além disso, CorA, quando fundido à sequência líder mitocondrial de Mrs2p, pode complementar parcialmente o defeito mitocondrial conferido pela perda de Mrs2p ou Lpe10p. Portanto, Mrs2p e / ou Lpe10p pode ser o principal sistema de captação de Mg 2+ para mitocôndrias. Uma possibilidade é que as proteínas formem heterodímeros, já que nenhuma das proteínas (quando superexpressa) pode complementar totalmente a perda da outra.
As características de captação de Mg 2+ em mitocôndrias isoladas por Mrs2p foram quantificadas usando mag-fura 2. A captação de Mg 2+ por Mrs2p compartilhou uma série de atributos com CorA. Em primeiro lugar, a captação de Mg 2+ era diretamente dependente do potencial elétrico (ΔΨ) através da membrana limite. Em segundo lugar, a captação é saturada muito abaixo do que o ΔΨ permite teoricamente, de modo que o transporte de Mg 2+ pela Mrs2p é provavelmente regulado de maneira semelhante ao CorA, possivelmente pela inativação da proteína. Terceiro, o efluxo de Mg 2+ foi observado via Mrs2p após a despolarização artificial da membrana mitocondrial pela valinomicina. Finalmente, os fluxos de Mg 2+ através de Mrs2p são inibidos por hexaammina de cobalto (III).
A cinética de captação de Mg 2+ pela Mrs2p foi determinada no Froschauer et al. (2004) artigo sobre CorA em bactérias. A mudança inicial na concentração de Mg 2+ livre foi 150 μM s-1 para o tipo selvagem e 750 μM s-1 para mitocôndrias de levedura que superexpressa MRS2. Nenhuma tentativa foi feita para dimensionar o transporte observado para a quantidade de transportador presente.
Protozoário ( Paramécio )
O transporte de Mg 2+ para Paramecium foi caracterizado amplamente por RR Preston e seus colegas de trabalho. Técnicas eletrofisiológicas em Paramecium inteiro foram usadas para identificar e caracterizar correntes de Mg 2+ em uma série de artigos antes do gene ser clonado por Haynes et al. (2002).
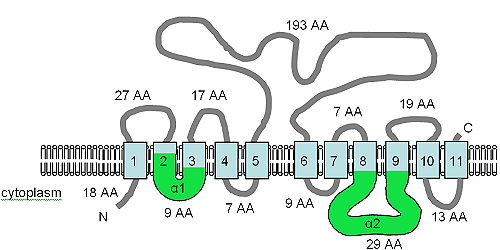
O quadro de leitura aberto para o gene XNTA tem 1707 bp de tamanho, contém dois introns e produz uma proteína prevista de 550 aminoácidos. A proteína tem sido previsto para conter 11 domínios TM e também contém o α1 e a2 motivos (ver figura) do SLC8 ( Na + / Ca 2+ permutador ) e SLC24 ( K + dependentes de Na + / Ca 2+ permutador ) proteínas de transporte de solutos humano. O XntAp é igualmente semelhante às famílias de proteínas SLC8 e SLC24 por sequência de aminoácidos, mas a topologia de TM prevista é mais parecida com a de SLC24, mas a semelhança é, na melhor das hipóteses, fraca e a relação é muito distante. A proteína AtMHX das plantas também compartilha uma relação distante com as proteínas SLC8.
A figura mostra a topologia de TM prevista de XntAp. Adaptado de Haynes et al. (2002), esta figura mostra a topologia de membrana prevista por computador de XntAp em Paramecium. A orientação na membrana foi determinada usando HMMTOP. Os domínios TM são mostrados em azul claro, os domínios α1 e α2 são mostrados em verde. A orientação na membrana e as posições dos terminais N e C são indicadas e a figura não é desenhada em escala.
As correntes dependentes de Mg 2+ transportadas por XntAp são cineticamente semelhantes às de uma proteína de canal e têm uma ordem de seletividade iônica de Mg 2+ > Co 2+ , Mn 2+ > Ca 2+ - uma série novamente muito semelhante à de CorA . Ao contrário das outras proteínas de transporte relatadas até agora, XntAp é dependente de Ca 2+ intracelular . O transporte também depende de ΔΨ, mas novamente o Mg 2+ não é transportado até o equilíbrio, sendo limitado a aproximadamente 0,4 mM de Mg 2+ livre no citoplasma. A existência de um compartimento intracelular com uma concentração livre muito maior de Mg 2+ (8 mM) foi suportada pelos resultados.
Animais
A investigação do Mg 2+ em animais, incluindo humanos, ficou para trás em relação às bactérias e leveduras. Isso se deve em grande parte à complexidade dos sistemas envolvidos, mas também à impressão no campo de que o Mg 2+ foi mantido em níveis elevados em todas as células e não foi alterado por influências externas. Apenas nos últimos 25 anos uma série de relatórios começou a desafiar essa visão, com novas metodologias descobrindo que o teor de Mg 2+ livre é mantido em níveis onde as mudanças podem influenciar o metabolismo celular.
MRS2
Uma pesquisa bioinformática dos bancos de dados de sequência identificou um homólogo do gene MRS2 de levedura em uma variedade de metazoários. A proteína tem uma sequência muito semelhante e topologia de TM prevista para a proteína de levedura, e o motivo GMN está intacto no final do primeiro domínio de TM. A proteína humana, hsaMrs2p, foi localizada na membrana mitocondrial em células de camundongo usando uma proteína de fusão GFP.
Muito pouco se sabe sobre as características de transporte de Mg 2+ da proteína em mamíferos, mas Zsurka et al. (2001) mostrou que o humano Mrs2p complementa os mutantes mrs2 no sistema de captação de Mg 2+ mitocondrial de levedura .
SLC41 (MgtE)
A identificação desta família de genes nos metazoários começou com um método de captura de sequência de sinal para isolar proteínas secretadas e de membrana. Grande parte da identificação veio de análises bioinformáticas. Três genes foram identificados em humanos, outros três em camundongos e três em Caenorhabditis elegans , com um único gene em Anopheles gambiae . A base de dados pFAM lista o domínio MgtE como pFAM01769 e identifica adicionalmente uma proteína contendo o domínio MgtE em Drosophila melanogaster . As proteínas contendo o domínio MgtE podem ser divididas em sete classes, conforme definido por pFAM usando o tipo e a organização dos domínios identificáveis em cada proteína. As proteínas metazoárias estão presentes em três dos sete grupos. Todas as proteínas metazoa contêm dois domínios MgtE, mas alguns deles foram previstos apenas por reconhecimento de contexto (Coin, Bateman e Durbin, não publicado. Consulte o site do pFAM para obter mais detalhes).
A proteína SLC41A1 humana contém dois domínios MgtE com 52% e 46% respectiva similaridade com a sequência de consenso PF01769 e prevê-se que contenha dez domínios TM, cinco em cada domínio MgtE (ver figura), o que sugere que a proteína MgtE da bactéria pode funcionar como um dímero.
Adaptado de Wabakken et al. (2003) e o banco de dados pFAM, a figura mostra a topologia de membrana prevista por computador de MgtE em H. sapiens . Os domínios TM são mostrados em azul claro, a orientação na membrana e as posições dos terminais N e C são indicadas e a figura não está desenhada em escala.
Wabakken et al. (2003) descobriram que o transcrito do gene SLC41A1 foi expresso em todos os tecidos humanos testados, mas em níveis variáveis, com o coração e testículo tendo a maior expressão do gene. Nenhuma explicação do padrão de expressão foi sugerida em relação à fisiologia relacionada ao Mg 2+ .
Não foi demonstrado se as proteínas SLC41 transportam Mg 2+ ou complementam uma mutação de transporte de Mg 2+ em qualquer sistema experimental. No entanto, foi sugerido que, como as proteínas MgtE não têm outra função conhecida, é provável que sejam transportadoras de Mg 2+ nos metazoários, assim como nas bactérias. Isso precisará ser verificado usando um dos sistemas experimentais agora padrão para examinar o transporte de Mg 2+ .
TRPM6 / TRPM7
A investigação de genes e proteínas TRPM em células humanas é uma área de intenso estudo recente e, às vezes, debate. Montell et al. (2002) revisaram a pesquisa sobre os genes TRP, e uma segunda revisão por Montell (2003) revisou a pesquisa sobre os genes TRPM.
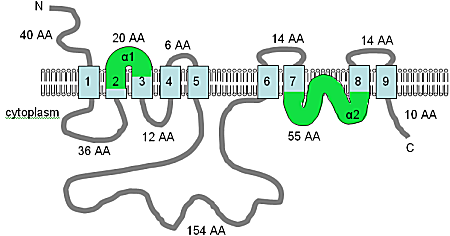
A família TRPM de canais iônicos tem membros em todo o metazoa. As proteínas TRPM6 e TRPM7 são altamente incomuns, contendo um domínio de canal iônico e um domínio de quinase (Figura 1.7), cujo papel traz o debate mais acalorado.
A atividade dessas duas proteínas tem sido muito difícil de quantificar. O TRPM7 por si só parece ser um canal de Ca 2+ , mas na presença de TRPM6 a série de afinidade dos cátions transportados coloca o Mg 2+ acima do Ca 2+ . As diferenças na condutância relatada foram causadas pelos padrões de expressão desses genes. O TRPM7 é expresso em todos os tipos de células testados até agora, enquanto o TRPM6 mostra um padrão de expressão mais restrito. Uma escolha infeliz de sistema experimental por Voets et al. , (2004) concluíram que o TRPM6 é um transportador funcional de Mg 2+ . No entanto, trabalhos posteriores de Chubanov et al. (2004) mostraram claramente que o TRPM7 é necessário para a atividade do TRPM6 e que os resultados de Voets et al. são explicados pela expressão de TRPM7 na linha celular experimental usada por Voets et al. em seus experimentos. Se o TRPM6 é funcional por si só, ainda não foi determinado.
A topologia de TM prevista das proteínas TPRM6 e TRPM7 foi adaptada de Nadler et al. (2001), Runnels et al. (2001) e Montell et al. (2002), esta figura mostra a topologia de membrana prevista por computador das proteínas TRPM6 e TRPM7 no Homo sapiens . Neste momento, a topologia mostrada deve ser considerada uma hipótese provisória. Os domínios TM são mostrados em azul claro, a alça de poro em roxo, o motivo TRP em vermelho e o domínio quinase em verde. A orientação na membrana e as posições dos terminais N e C são indicadas e a figura não é desenhada em escala.
As conclusões do Voets et al. (2004) estão provavelmente incorretos ao atribuir as correntes dependentes de Mg 2+ ao TRPM7 sozinho, e seus dados cinéticos provavelmente refletem o canal TRPM7 / TRPM6 combinado. O relatório apresenta uma coleção robusta de dados consistentes com uma atividade semelhante a canal passando Mg 2+ , com base em ambas as técnicas eletrofisiológicas e também mag-fura 2 para determinar alterações no citoplasma livre Mg 2+ .
Transporte paracelular
As claudinas permitem o transporte de Mg 2+ pela via paracelular ; isto é, ele medeia o transporte do íon através das junções estreitas entre as células que formam uma camada de células epiteliais. Em particular, Claudin-16 permite a recaptação seletiva de Mg 2+ no rim humano. Alguns pacientes com mutações no gene CLDN19 também apresentam transporte de magnésio alterado.
O gene Claudin-16 foi clonado por Simon et al. (1999), mas somente após uma série de relatos descreveram o próprio fluxo de Mg 2+ sem nenhum gene ou proteína. O padrão de expressão do gene foi determinado por RT-PCR e mostrou-se estreitamente confinado a uma região contínua do túbulo renal que vai do ramo medular espesso descendente até o túbulo contorcido distal. Esta localização foi consistente com os relatórios anteriores para a localização da recaptação de Mg 2+ pelo rim. Após a clonagem, mutações no gene foram identificadas em pacientes com hipomagnesemia familiar com hipercalciúria e nefrocalcinose, fortalecendo as ligações entre o gene e a captação de Mg 2+ .
Plantas
O conhecimento atual dos mecanismos moleculares para o transporte de Mg 2+ em plantas é muito limitado, com apenas três publicações relatando uma base molecular para o transporte de Mg 2+ em plantas. No entanto, a importância do Mg 2+ para as plantas está bem descrita, e os estudos fisiológicos e ecofisiológicos sobre os efeitos do Mg 2+ são numerosos. Esta seção irá resumir o conhecimento de uma família de genes identificada em plantas que estão distantemente relacionadas ao CorA. Outro gene, um trocador Mg 2+ / H + (AtMHX), não relacionado a essa família de genes e ao CorA também foi identificado, está localizado na membrana vacuolar e será descrito a seguir.
A família de genes AtMRS2
Schock et al. (2000) identificaram e nomearam a família AtMRS2 com base na similaridade dos genes com o gene MRS2 da levedura. Os autores também mostraram que o gene AtMRS2-1 poderia complementar um fenótipo mutante de levedura Δmrs2. De forma independente, Li et al. (2001) publicou um relatório identificando a família e mostrando que dois membros adicionais poderiam complementar mutantes deficientes no transporte de Mg 2+ , um em S. typhimurium e outro em S. cerevisiae .
Os três genes que demonstraram transportar Mg 2+ são AtMRS2-1, AtMRS2-10 e AtMRS2-11, e esses genes produzem proteínas de 442, 443 e 459 aminoácidos, respectivamente. Cada uma das proteínas mostra semelhança significativa com a Mrs2p de levedura e uma semelhança fraca com CorA de bactérias, contém o motivo de aminoácido GMN conservado na extremidade externa do primeiro domínio TM e prevê-se que tenha dois domínios TM.
O gene AtMRS2-1, quando expresso em levedura a partir do promotor MRS2 e sendo fundido C-terminalmente aos primeiros 95 aminoácidos da proteína Mrs2p, foi direcionado para a mitocôndria, onde complementou um mutante Δmrs2 fenotipicamente (splicing de RNA mitocondrial foi restaurado) e no que diz respeito ao conteúdo de Mg 2+ da organela. Não foram apresentados dados sobre a cinética do transporte. O gene AtMRS2-11 foi analisado em levedura (na cepa alr1 alr2), onde foi demonstrado que a expressão do gene aumentou significativamente a taxa de captação de Mg 2+ em células famintas sobre o controle, conforme medido usando espectroscopia de absorção atômica com chama de conteúdo celular total de Mg 2+ . No entanto, Alr1p mostrou ser significativamente mais eficaz no transporte de Mg 2+ em baixas concentrações extracelulares, sugerindo que a afinidade de AtMRS2-11 para Mg 2+ é menor do que a de Alr1p. Uma análise eletrofisiológica (clamp de voltagem) da proteína AtMRS2-11 em oócitos de Xenopus também mostrou uma corrente dependente de Mg 2+ nos potenciais de membrana (ΔΨ) de –100 - –150 mV em seu interior. Esses valores são fisiologicamente significativos, pois várias membranas em plantas mantêm ΔΨ nesta faixa. No entanto, o autor teve dificuldade em reproduzir esses resultados devido a uma aparente "morte" de oócitos contendo a proteína AtMRS2-11 e, portanto, esses resultados devem ser vistos com cautela.
O transportador AtMRS2-10 foi analisado usando a análise de captação do traçador radioativo. 63Ni 2+ foi usado como o íon substituto e Mg 2+ mostrou inibir a captação de 63Ni 2+ com um Ki de 20 μM. A captação também foi inibida por Co (III) Hex e por outros cátions divalentes. Apenas Co 2+ e Cu 2+ inibiram o transporte com valores de Ki menores que 1 mM.
A proteína AtMRS2-10 foi fundida a GFP e mostrou estar localizada na membrana plasmática. Um experimento semelhante foi tentado no Schock et al. (2000), mas a localização observada não foi significativamente diferente daquela observada com GFP não fundido. A razão mais provável para a falta de uma localização definitiva do AtMRS2-1 no Schock et al. O artigo é que os autores removeram os domínios TM da proteína, impedindo assim sua inserção em uma membrana.
O significado fisiológico exato das proteínas AtMRS2-1 e AtMRS2-10 em plantas ainda não foi esclarecido. O gene AtMRS2-11 foi superexpresso (do promotor CaMV 35S) em A. thaliana. Foi demonstrado que a linha transgênica acumula altos níveis do transcrito AtMRS2-11. Um forte fenótipo de deficiência de Mg 2+ (manchas necróticas nas folhas, ver Capítulo 1.5 abaixo) foi registrado durante o processo de triagem (nas gerações T1 e T2) para uma linhagem homozigota, mas este fenótipo foi perdido na geração T3 e poderia não pode ser reproduzido quando as gerações anteriores foram rastreadas uma segunda vez. O autor sugeriu que os efeitos ambientais eram a causa mais provável do fenótipo inconsistente.
AtMHX
O primeiro transportador de magnésio isolado em qualquer organismo multicelular, AtMHX não mostra nenhuma semelhança com qualquer proteína de transporte de Mg 2+ isolada anteriormente . O gene foi inicialmente identificado no banco de dados de sequências de DNA genômico de A. thaliana, por sua semelhança com a família SLC8 de genes trocadores Na + / Ca 2+ em humanos.
Prevê-se que a sequência de cDNA de 1990 pb produza uma proteína de 539 aminoácidos. AtMHX está intimamente relacionado à família SLC8 no nível de aminoácidos e compartilha uma topologia com onze domínios TM previstos (Figura A10.5). Há uma diferença importante na sequência, em que a alça longa não membranar (ver Figura A10.5) tem 148 aminoácidos na proteína AtMHX, mas 500 aminoácidos nas proteínas SLC8. No entanto, esse loop não é bem conservado e não é necessário para a função de transporte na família SLC8.
O gene AtMHX é expresso em toda a planta, mas mais fortemente no tecido vascular. Os autores sugerem que o papel fisiológico da proteína é armazenar Mg 2+ nesses tecidos para liberação posterior, quando necessário. A localização da proteína na membrana vacuolar apóia essa sugestão (ver também Capítulo 1.5).
A proteína transporta Mg 2+ para o espaço vacuolar e H + para fora, conforme demonstrado por técnicas eletrofisiológicas. O transporte é conduzido pelo ΔpH mantido entre o espaço vacuolar (pH 4,5 - 5,9) e o citoplasma (pH 7,3 - 7,6) por uma H + -ATPase. Não foi determinado como o transporte de Mg 2+ pela proteína é regulado. Observou-se que as correntes passavam pela proteína em ambas as direções, mas a corrente de saída de Mg 2+ exigia um pH "citoplasmático" de 5,5, uma condição não encontrada nas células vegetais em circunstâncias normais. Além do transporte de Mg 2+ , Shaul et al. (1999) também mostrou que a proteína poderia transportar Zn 2+ e Fe 2+ , mas não relatou a capacidade da proteína de transportar outros cátions divalentes (por exemplo, Co 2+ e Ni 2+ ) ou sua suscetibilidade à inibição por cobalto (III) hexaammina.
A cinética detalhada do transporte de Mg 2+ não foi determinada para AtMHX. No entanto, efeitos fisiológicos foram demonstrados. Quando as plantas de A. thaliana foram transformadas com construções de superexpressão do gene AtMHX conduzido pelo promotor CaMV 35S, as plantas superacumularam a proteína e mostraram um fenótipo de lesões necróticas nas folhas, o que os autores sugerem ser causado por uma ruptura no função normal do vacúolo, dada a observação de que o conteúdo total de Mg 2+ (ou Zn 2+ ) das plantas não foi alterado nas plantas transgênicas.
A imagem foi adaptada de Shaul et al. (1999) e Quednau et al. (2004), e combinada com uma análise usando HMMTOP, esta figura mostra a topologia de membrana prevista por computador da proteína AtMHX em Arabidopsis thaliana . Neste momento, a topologia mostrada deve ser considerada uma hipótese provisória. Os domínios TM são mostrados em azul claro, a orientação na membrana e as posições dos terminais N e C são indicadas e a figura não está desenhada em escala. Os domínios α1 e α2, mostrados em verde, são bastante hidrofóbicos e podem ser inseridos na membrana.