Teoria da solução de Flory-Huggins - Flory–Huggins solution theory
A teoria da solução de Flory-Huggins é um modelo de rede da termodinâmica de soluções de polímero que leva em conta a grande dissimilaridade nos tamanhos moleculares ao adaptar a expressão usual para a entropia da mistura . O resultado é uma equação para a mudança de energia livre de Gibbs para misturar um polímero com um solvente . Embora faça suposições simplificadas, ele gera resultados úteis para a interpretação de experimentos.
Teoria
A equação termodinâmica para a mudança de energia de Gibbs que acompanha a mistura a temperatura constante e pressão (externa) é
Uma mudança, denotada por , é o valor de uma variável para uma solução ou mistura menos os valores para os componentes puros considerados separadamente. O objetivo é encontrar fórmulas explícitas para e , os incrementos de entalpia e entropia associados ao processo de mistura .
O resultado obtido por Flory e Huggins é
O lado direito é uma função do número de moles e da fração de volume do solvente ( componente ), do número de moles e da fração de volume do polímero (componente ), com a introdução de um parâmetro para levar em conta a energia do polímero interdispersante e moléculas de solvente. é a constante do gás e é a temperatura absoluta . A fração de volume é análoga à fração molar , mas é ponderada para levar em conta os tamanhos relativos das moléculas. Para um pequeno soluto, as frações molares apareceriam, e essa modificação é a inovação devida a Flory e Huggins. No caso mais geral, o parâmetro de mistura,, é um parâmetro de energia livre, incluindo um componente entrópico.
Derivação
Primeiro calculamos a entropia da mistura , o aumento na incerteza sobre a localização das moléculas quando elas são intercaladas. Nas fases puras condensadas - solvente e polímero - em todos os lugares que olhamos encontramos uma molécula. Claro, qualquer noção de "encontrar" uma molécula em um determinado local é um experimento de pensamento, pois não podemos realmente examinar locais espaciais do tamanho de moléculas. A expressão para a entropia da mistura de pequenas moléculas em termos de frações molares não é mais razoável quando o soluto é uma cadeia macromolecular . Levamos em conta essa dis simetria nos tamanhos moleculares, assumindo que segmentos de polímero individuais e moléculas de solvente individuais ocupam locais em uma rede . Cada local é ocupado por exatamente uma molécula do solvente ou por um monômero da cadeia do polímero, então o número total de locais é
é o número de moléculas de solvente e é o número de moléculas de polímero, cada uma com segmentos.
Para um passeio aleatório em uma rede, podemos calcular a mudança de entropia (o aumento na incerteza espacial ) como resultado da mistura de soluto e solvente.
onde está a constante de Boltzmann . Defina as frações de volume da rede e
Essas também são as probabilidades de que um determinado sítio de rede, escolhido ao acaso , seja ocupado por uma molécula de solvente ou um segmento de polímero, respectivamente. Assim
Para um pequeno soluto cujas moléculas ocupam apenas um sítio da rede, igual a um, as frações de volume reduzem-se a frações moleculares ou molares e recuperamos a entropia usual da mistura .
Além do efeito entrópico, podemos esperar uma mudança de entalpia . Há três interações moleculares a serem consideradas: solvente-solvente , monômero-monômero (não a ligação covalente , mas entre diferentes seções da cadeia) e monômero-solvente . Cada um dos últimos ocorre às custas da média dos outros dois, então o incremento de energia por contato monômero-solvente é
O número total de tais contatos é
onde é o número de coordenação, o número de vizinhos mais próximos para um sítio de rede, cada um ocupado por um segmento de cadeia ou uma molécula de solvente. Ou seja, é o número total de segmentos de polímero (monômeros) na solução, então é o número de sites vizinhos mais próximos de todos os segmentos de polímero. Multiplicando pela probabilidade de que qualquer local seja ocupado por uma molécula de solvente, obtemos o número total de interações moleculares polímero-solvente. Uma aproximação seguindo a teoria do campo médio é feita seguindo este procedimento, reduzindo assim o problema complexo de muitas interações a um problema mais simples de uma interação.
A mudança de entalpia é igual à mudança de energia por interação de monômero de polímero-solvente multiplicada pelo número de tais interações
O parâmetro de interação polímero-solvente chi é definido como
Depende da natureza do solvente e do soluto e é o único parâmetro específico do material no modelo. A mudança de entalpia torna-se
Termos de montagem, a mudança total de energia livre é
onde temos convertido a expressão de moléculas e a moles e transferindo a constante de Avogadro para a constante dos gases .
O valor do parâmetro de interação pode ser estimado a partir dos parâmetros de solubilidade de Hildebrand e
onde é o volume real de um segmento de polímero.
No caso mais geral, a interação e o parâmetro de mistura resultante,, é um parâmetro de energia livre, incluindo assim um componente entrópico. Isso significa que, além da entropia de mistura regular, há outra contribuição entrópica da interação entre o solvente e o monômero. Essa contribuição às vezes é muito importante para fazer previsões quantitativas das propriedades termodinâmicas.
Existem teorias de solução mais avançadas, como a teoria Flory-Krigbaum .
Separação de fase líquido-líquido
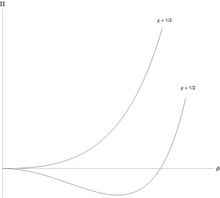
Os polímeros podem se separar do solvente, de maneira característica. A energia livre de Flory-Huggins por unidade de volume, para um polímero com monômeros, pode ser escrita em uma forma adimensional simples
para a fração de volume dos monômeros, e . A pressão osmótica (em unidades reduzidas) é .
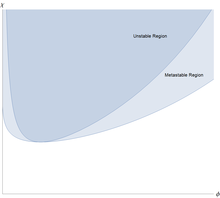
A solução de polímero é estável em relação a pequenas flutuações quando a segunda derivada desta energia livre é positiva. Esta segunda derivada é
e a solução primeiro se torna instável, então esta e a terceira derivada são ambas iguais a zero. Um pouco de álgebra mostra que a solução de polímero primeiro se torna instável em um ponto crítico em
Isso significa que para todos os valores da interação monômero-solvente eficaz é fracamente repulsivo, mas isso é muito fraco para causar separação líquido / líquido. No entanto, quando , há separação em duas fases coexistentes, uma mais rica em polímero, mas mais pobre em solvente, que a outra.
A característica incomum da separação de fase líquido / líquido é que ela é altamente assimétrica: a fração de volume dos monômeros no ponto crítico é aproximadamente , o que é muito pequeno para polímeros grandes. A quantidade de polímero na fase de coexistência rica em solvente / pobre em polímero é extremamente pequena para polímeros longos. A fase rica em solvente está próxima do solvente puro. Isso é peculiar aos polímeros, uma mistura de pequenas moléculas pode ser aproximada usando a expressão de Flory-Huggins com , e então e ambas as fases coexistentes estão longe de ser puras.
Misturas de polímeros
Os polímeros sintéticos raramente consistem em cadeias de comprimento uniforme em solvente. A densidade de energia livre de Flory-Huggins pode ser generalizada para uma mistura de componentes N de polímeros com comprimentos de
Para uma mistura binária de polímero , onde uma espécie consiste em monômeros e os outros monômeros, isso simplifica para
Como no caso das soluções diluídas de polímero, os primeiros dois termos do lado direito representam a entropia da mistura. Para polímeros grandes de e esses termos são insignificantemente pequenos. Isso implica que, para que exista uma mistura estável , para que os polímeros A e B se misturem, seus segmentos devem se atrair.
Limitações
A teoria de Flory-Huggins tende a concordar bem com experimentos no regime de concentração semi-diluída e pode ser usada para ajustar dados para misturas ainda mais complicadas com concentrações mais altas. A teoria prevê qualitativamente a separação de fases, a tendência de espécies de alto peso molecular serem imiscíveis, a dependência da interação-temperatura e outras características comumente observadas em misturas de polímeros. No entanto, a teoria de Flory-Huggins não modificada falha em prever a temperatura de solução crítica mais baixa observada em algumas misturas de polímeros e a falta de dependência da temperatura crítica no comprimento da cadeia . Além disso, pode ser mostrado que para uma mistura binária de espécies de polímero com comprimentos de cadeia iguais, a concentração crítica deve ser ; no entanto, misturas de polímeros foram observadas onde este parâmetro é altamente assimétrico. Em certas combinações, a entropia de mistura pode dominar a interação do monômero. Ao adotar a aproximação de campo médio, a dependência do complexo de parâmetros na temperatura , composição da mistura e comprimento da cadeia foi descartada. Especificamente, as interações além do vizinho mais próximo podem ser altamente relevantes para o comportamento da mistura e a distribuição dos segmentos de polímero não é necessariamente uniforme, portanto, certos locais de rede podem experimentar energias de interação díspares daquela aproximada pela teoria do campo médio.
Um efeito bem estudado sobre as energias de interação negligenciadas pela teoria não modificada de Flory Huggins é a correlação em cadeia. Em misturas de polímeros diluídas, onde as cadeias são bem separadas, as forças intramoleculares entre os monômeros da cadeia de polímero dominam e conduzem a desmistura levando a regiões onde a concentração de polímero é alta. Conforme a concentração do polímero aumenta, as cadeias tendem a se sobrepor e o efeito se torna menos importante. Na verdade, a demarcação entre soluções diluídas e semi-diluídas é comumente definida pela concentração onde os polímeros começam a se sobrepor, o que pode ser estimado como
Aqui, m é a massa de uma única cadeia de polímero e é o raio de rotação da cadeia .
Referências
links externos
- "Conformações, Soluções e Peso Molecular" (capítulo do livro) , Capítulo 3 do Título do Livro: Ciência e Tecnologia do Polímero; por Joel R. Fried; 2ª edição, 2003
Notas de rodapé
- ^ "Thermodynamicsof HighPolymer Solutions,"Paul J. Flory Journal of Chemical Physics,agosto de 1941, Volume 9, Issue 8, p. 660Abstract. Flory sugeriu que o nome de Huggins deveria ser o primeiro, já que ele havia publicado vários meses antes: Flory, PJ, "Thermodynamics of highpolimer solutions,"J. Chem. Phys. 10: 51-61 (1942) Citation Classic No. 18, 6 de maio de 1985
- ^ "Solutions of Long ChainCompounds",Maurice L. Huggins Journal of Chemical Physics,maio de 1941, Volume 9, Edição 5, p. 440Resumo
- ^ Estamos ignorando ovolume livredevido à desordem molecular em líquidos e sólidos amorfos em comparação com oscristais. Isso, e a suposição de quemonômerose moléculas de soluto são realmente do mesmo tamanho, são as principaisaproximaçõesgeométricasneste modelo.
- ^ Para umpolímerosintéticoreal, há umadistribuiçãoestatística decomprimentosdecadeia, entãoseria umamédia.
- ^ Aentalpiaé aenergia internacorrigida para qualquerpressão-volume de trabalhoconstante (externo). Não estamos fazendo nenhuma distinção aqui. Isso permite a aproximação daenergia livredeHelmholtz, que é a forma natural de energia livre da teoria da rede de Flory-Huggins, para a energia livre de Gibbs.
- ^ Na verdade, dois dos locais adjacentes a um segmento de polímero são ocupados por outros segmentos de polímero, uma vez que faz parte de umacadeia; e mais um, sendo três, paralocais deramificação, mas apenas um paraterminais.







![\ Delta G_ {m} = RT [\, n_ {1} \ ln \ phi _ {1} + n_ {2} \ ln \ phi _ {2} + n_ {1} \ phi _ {2} \ chi _ {{12}} \,] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/0365a596a07bd13b3c31697e8a5dcf1819d7d5bb)













![\ Delta S_ {m} = - k [\, N_ {1} \ ln (N_ {1} / N) + N_ {2} \ ln (xN_ {2} / N) \,] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0c5ee22dcb99cee91513fc5f0ba88d92c8aa08d)



![\ Delta S_ {m} = - k [\, N_ {1} \ ln \ phi _ {1} + N_ {2} \ ln \ phi _ {2} \,] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/85de93887873fc7d1af06d123c3a2eb2b1dc2831)