Epotilona - Epothilone
| Epotilonas | |
|---|---|

Epotilonas A (R = H) e B (R = CH 3 ) |
|
| Fórmulas Químicas |
A: C 26 H 39 NO 6 S |
| Massas moleculares |
A: 493,66 g / mol |
| Números CAS |
A: 152044-53-6 |
| PubChem |
A: 448799 |

Epotilonas C (R = H) e D (R = CH 3 ) |
|
| Fórmulas Químicas |
C: C 26 H 39 NO 5 S |
| Massas moleculares |
C: 477,66 g / mol |
| Números CAS |
D: 189453-10-9 |
| PubChem |
C: 9891226 |

Epotilonas E (R = H) e F (R = CH 3 ) |
|
| Fórmulas Químicas |
E: C 26 H 39 NO 7 S |
| Massas moleculares |
E: 509,66 g / mol |
| Isenção de responsabilidade e referências | |
As epotilonas são uma classe de potenciais drogas contra o câncer. Como os taxanos , eles evitam que as células cancerosas se dividam interferindo na tubulina , mas nos primeiros testes as epotilonas têm melhor eficácia e efeitos adversos mais brandos do que os taxanos.
Em setembro de 2008, as epotilonas A a F foram identificadas e caracterizadas. Os primeiros estudos em linhas de células cancerosas e em pacientes com câncer humanos indicam eficácia superior aos taxanos . Seu mecanismo de ação é semelhante, mas sua estrutura química é mais simples. Devido à sua melhor solubilidade em água, os cremóforos (agentes solubilizantes usados para o paclitaxel que podem afetar a função cardíaca e causar hipersensibilidade grave) não são necessários. Propriedades semelhantes à endotoxina conhecidas do paclitaxel, como ativação de macrófagos que sintetizam citocinas inflamatórias e óxido nítrico, não são observadas para a epotilona B.
Epotilonas foram originalmente identificado como metabólitos produzidos pelo solo-moradia mixobact�ia Sorangium cellulosum .
História
A estrutura da epotilona A foi determinada em 1996 usando cristalografia de raios-x .
Mecanismo de ação
O principal mecanismo da classe da epotilona é a inibição da função dos microtúbulos . Os microtúbulos são essenciais para a divisão celular e, portanto, as epotilonas impedem as células de se dividirem adequadamente. A epotilona B possui os mesmos efeitos biológicos do paclitaxel tanto in vitro como em células de cultura. Isso ocorre porque eles compartilham o mesmo local de ligação, bem como afinidade de ligação ao microtúbulo. Como o paclitaxel, a epotilona B liga-se à subunidade do heterodímero αβ-tubulina. Uma vez ligada, a taxa de dissociação da tubulina αβ diminui, estabilizando assim os microtúbulos. Além disso, a epotilona B também mostrou induzir a polimerização da tubulina em microtúbulos sem a presença de GTP. Isso é causado pela formação de feixes de microtúbulos em todo o citoplasma. Finalmente, a epotilona B também causa parada do ciclo celular na fase de transição G2-M, levando à citotoxicidade e, eventualmente, à apoptose celular. A capacidade da epotilona de inibir a função do fuso é geralmente atribuída à supressão da dinâmica dos microtúbulos; mas estudos recentes demonstraram que a supressão da dinâmica ocorre em concentrações mais baixas do que as necessárias para bloquear a mitose. Nas concentrações antimitóticas mais elevadas, o paclitaxel parece agir suprimindo o descolamento dos microtúbulos dos centrossomas, um processo que é normalmente ativado durante a mitose. É bem possível que a epotilona também possa atuar por meio de mecanismo semelhante.
Análogos aprovados para uso médico
Um análogo, a ixabepilona , foi aprovado em outubro de 2007 pela Food and Drug Administration dos Estados Unidos para uso no tratamento de câncer de mama metastático agressivo ou localmente avançado , que não responde mais às quimioterapias atualmente disponíveis. Em novembro de 2008, a EMEA recusou uma autorização de introdução no mercado para a ixabepilona.
Testes clínicos
Vários análogos sintéticos da epotilona estão atualmente em desenvolvimento clínico para o tratamento de vários tipos de câncer.
A epotilona B provou conter atividades anticâncer potentes in vivo em níveis de dose tolerados em vários modelos de xenoenxerto humano. Como resultado, a epotilona B ( patupilona ) e vários análogos estão A partir de 2001 passando por várias fases clínicas: patupilona e a sagopilona totalmente sintética [SH-Y03757A, ZK-EPO, estrutura química ] estão em testes de fase II; BMS-310705 em ensaios de fase I).
Os resultados de um estudo de fase III com ixabepilona (BMS-247550) em combinação com capecitabina no câncer de mama metastático foram anunciados (2007 - levando à aprovação do FDA).
A patupilona falhou em um ensaio clínico de fase III para câncer de ovário em 2010.
Utidelone é um análogo da epotilona geneticamente modificado que demonstrou benefícios em um estudo de fase III do câncer de mama quando adicionado à capecitabina .
Síntese total
Devido à alta potência e necessidade clínica para tratamentos de câncer, as epotilonas têm sido alvo de muitas sínteses totais . O primeiro grupo a publicar a síntese total de epotilonas foi SJ Danishefsky et al. em 1996. Esta síntese total de epotilona A foi alcançada por meio de uma condensação de enolato-aldeído de éster intramolecular. Outras sínteses de epotilonas foram publicadas por Nicolaou , Schinzer, Mulzer e Carreira . Nesta abordagem, os principais blocos de construção aldeído , glicidóis e cetoácido foram construídos e acoplados ao precursor de metátese de olefina por meio de uma reação de aldol e, em seguida, um acoplamento de esterificação . O catalisador de Grubbs foi empregado para fechar a olefina bis terminal do composto precursor. Os compostos resultantes eram isômeros cis- e trans-macrocíclicos com estereocentros distintos . A epoxidação de cis- e trans-olefinas produz epotilona A e seus análogos.
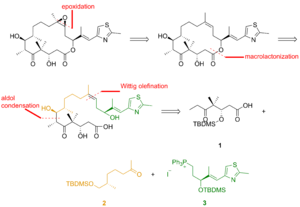
Uma das sínteses totais de epotilona B é delineada abaixo e foi descrita pelo laboratório de KC Nicolaou . A análise retrosintética revelou 1 , 2 e 3 como os blocos de construção (Figura 1).
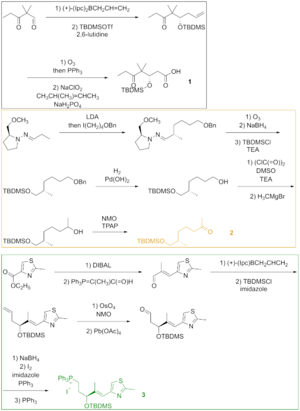
Como visto na Figura 2, o cetoácido 1 foi gerado a partir do ceto aldeído que foi convertido no éter silílico por meio de alilboração assimétrica e sililação do álcool resultante. A ozonólise do éter silílico e a oxidação de Lindgren - Pinnick do aldeído proporcionaram o cetoácido. A cetona 2 foi construída por alquilação de Enders a partir da hidrazona. Ozonólise, a última etapa da alquilação de Enders, foi seguida pela redução do aldeído e sililação do álcool resultante. A hidrogenólise do éter benzílico deu o álcool, que foi oxidado sob a condição de Swern e alquilado com o reagente de Grignard para produzir o álcool secundário. A oxidação deste álcool com o reagente de Ley-Griffith deu a cetona desejada. O tiazol 3 foi sintetizado a partir do éster, que foi reduzido com hidreto de diisobutilalumínio , e o aldeído foi feito reagir com o ileto estabilizado na reação de Wittig . A alilboração assimétrica do aldeído α, β-insaturado e a proteção do grupo hidroxilo deram o éter silílico, cuja olefina terminal foi reagida com tetróxido de ósmio a um diol que foi clivado com tetraacetato de chumbo para fornecer o aldeído. Redução, iodação e tratamento com trifenilfosfina levaram ao sal de fosfônio.
Os fragmentos 1 , 2 e 3 reagiram um com o outro para entregar epotilona B em uma abordagem incluindo reação de Wittig , reação de aldol e esterificação de Yamaguchi (Figura 3). Cromatografia de camada fina preparativa foi usada para separar os diastereômeros.
Biossíntese
A epotilona B é uma policetídeo macrolactona de 16 membros com um grupo metil tiazol conectado ao macrociclo por uma ligação olefínica. O esqueleto do policetídeo foi sintetizado pela policetídeo sintetase tipo I (PKS) e o anel tiazol foi derivado de uma cisteína incorporada por um peptídeo sintetase não ribossômico (NRPS). Nesta biossíntese, PKS e NRPS usam proteínas transportadoras , que foram modificadas pós-tradução por grupos fosfopanteteína , para se juntar à cadeia crescente. A PKS usa o tioéster de coenzima-A para catalisar a reação e modificar os substratos, reduzindo seletivamente o β carbonil em hidroxil (Cetoredutase, KR), o alceno (Desidratase, DH) e o alcano (Enoil Redutase, ER). PKS-I também pode metilar o carbono α do substrato. O NRPS, por outro lado, usa aminoácidos ativados na enzima como aminoacil adenilatos. Ao contrário de PKS, epimerização , N-metilação e formação de heterociclo ocorrem na enzima NRPS.
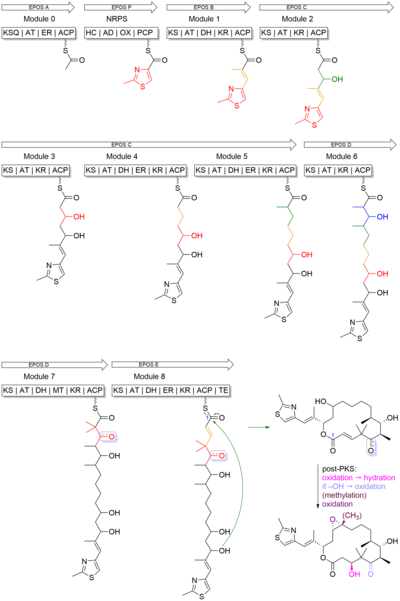
A epotilona B começa com uma unidade inicial 2-metil-4-carboxitiazol, que foi formada através do acoplamento translacional entre PKS, módulo EPOS A (epoA) e módulo NRPS, EPOS P (epoP). O EPOS A contém uma β-cetoacil-sintase modificada (malonil-ACP descarboxilase, KSQ), uma aciltransferase (AT), uma enoil redutase (ER) e um domínio de proteína transportadora de acila (ACP). O EPOS P, entretanto, contém uma heterocilação, uma adenilação, uma oxidase e um domínio de tiolação. Esses domínios são importantes porque estão envolvidos na formação do anel heterocíclico de cinco membros do tiazol. Como pode ser visto na Figura 4 , o EPOS P ativa a cisteína e se liga à cisteína ativada como um aminoacil-S-PCP. Uma vez que a cisteína foi ligada, EPOS A carrega uma unidade de acetato no complexo EPOS P, iniciando assim a formação do anel tiazolina por ciclodeidratação intramolecular.
Uma vez que o anel 2-metiltiazol foi feito, ele é então transferido para o PKS EPOS B (epoB), EPOS C (epoC), EPOS D (epoD), EPOS E (epoE) e EPOS F (epoF) para alongamento subsequente e modificação para gerar a ligação olefínica, o anel de 16 membros e o epóxido, como visto na Figura 5 . Uma coisa importante a se notar é a síntese da unidade gem-dimetil no módulo 7. Essas duas dimetilas não foram sintetizadas por duas C-metilação sucessivas. Em vez disso, um do grupo metil foi derivado da unidade extensora de propionato, enquanto o segundo grupo metil foi integrado por um domínio C-metil-transferase.