Alfa-aminoadípica semialdeído sintase - Alpha-aminoadipic semialdehyde synthase
A semialdeído sintase alfa-aminoadípica é uma enzima codificada pelo gene AASS em humanos e está envolvida em sua principal via de degradação da lisina . É semelhante às enzimas separadas codificadas pelos genes LYS1 e LYS9 na levedura e está relacionado, embora não seja semelhante em estrutura, à enzima bifuncional encontrada nas plantas. Em humanos, as mutações no gene AASS e a correspondente enzima alfa-aminoadípica semialdeído sintase estão associadas à hiperlisinemia familiar . Esta condição é herdada em um padrão autossômico recessivo e não é considerada uma condição particularmente negativa, o que a torna uma doença rara .
Função
A proteína alfa-aminoadípica semialdeído sintase catalisa as duas primeiras etapas na degradação da L- lisina em mamíferos através da via da sacaropina dentro da mitocôndria , que se acredita ser a principal via metabólica para a degradação da lisina em eucariotos superiores . A via secundária específica em que esta enzima se concentra é a síntese de glutaril-CoA a partir da L-lisina. O glutaril-CoA pode atuar como um intermediário em uma via de conversão / degradação mais expandida de L-lisina para acetil-CoA.
Dois componentes perceptíveis da degradação da L-lisina pela via da sacaropina são a reação / produto glutamato de uso intermediário e o eventual sumidouro de carbono acetil-CoA . O glutamato é um composto importante dentro do corpo que atua como um neurotransmissor ligado ao aprendizado e à doença de Huntington. O acetil-CoA é indiscutivelmente de um nível de importância ainda maior, agindo como um dos componentes integrais do ciclo do ácido cítrico / Kreb, com a função primária de entregar um grupo acetil a ser oxidado para a produção de energia. Assim, a função da alfa-aminoadípica semialdeído sintase está ligada aos níveis de dois compostos integrais dentro do corpo.
Mecanismo
Primeiro, a porção N-terminal desta enzima que contém lisina - cetoglutarato redutase (LOR / LKR) atividade ( EC : 1.5.1.8) condensa lisina e 2-oxoglutarato em uma molécula chamada sacaropina (Reação 1 na figura à direita) . Então, a porção C-terminal desta enzima, que contém sacaropina desidrogenase (SHD) atividade (EC: 1.5.1.9), catalisa a oxidação da sacaropina para produzir alfa-aminoadípico semialdeído e glutamato (Reação 2 na figura à direita) . Nota: Essas reações são o inverso das etapas correspondentes nas vias de biossíntese de lisina presentes em leveduras e fungos .
Essas reações também podem ser visualizadas na forma de equação de reação:
N (6) - (L-1,3-dicarboxipropil) -L-lisina + NADP + + H2O = L-lisina + 2-oxoglutarato + NADPH seguido por
N (6) - (L-1,3-dicarboxipropil) -L-lisina + NAD + + H2O = L-glutamato + (S) -2-amino-6-oxohexanoato + NADH.
Estrutura
A enzima humana nativa é bifuncional, muito parecida com a LKR / SHD encontrada nas plantas e, portanto, é considerada semelhante em estrutura. A bifuncionalidade dessa enzima vem do fato de conter dois sítios ativos distintos, um em seu terminal C e outro em seu terminal N. A porção C-terminal da alfa-aminoadípica semialdeído sintase contém a atividade SHD e a porção N-terminal contém LKR. Até à data, não foi determinada uma estrutura da alfa-aminoadípica semialdeído sintase. A enzima não tem região ligante presente em plantas entre seus terminais C e N, então as teorias sugerem que a estrutura real contém uma região de atividade LKR ligada a uma região de atividade de SHD, como aquela em Magnaporthe grisea .

Relevância da doença
A semialdeído sintase alfa-aminoadípica é codificada pelo gene AASS, e mutações nesse gene levam à hiperlisinemia. Isso é caracterizado por degradação prejudicada da lisina, o que resulta em níveis elevados de lisina no sangue e na urina. Esses níveis aumentados de lisina não parecem ter nenhum efeito negativo no corpo. Outros nomes para esta condição incluem:
- doença de deficiência de semialdeído alfa-aminoadípico
- hiperlisinemia familiar
- Doença de deficiência de lisina alfa-cetoglutarato redutase
- doença por deficiência de sacaropina desidrogenase
- sacaropinúria
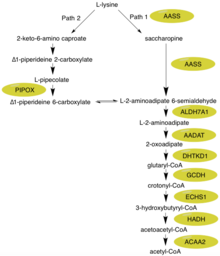
A hiperlisinemia é caracterizada por níveis elevados de lisina plasmática que excedem 600 μmol / L e podem atingir até 2.000 μmol / L. Esses níveis aumentados de lisina não parecem ter nenhum efeito negativo no corpo. A principal razão para isso é que várias reações bioquímicas alternativas podem ocorrer. Primeiro, a lisina pode ser usada no lugar da ornitina no ciclo da ureia, resultando na produção de homoarginina. Além disso, embora a maioria dos mamíferos use a via da sacaropina para a maior parte da degradação da lisina (Caminho 1), o cérebro tem uma via alternativa (Caminho 2) que passa por um intermediário de ácido L-pipecólico - ambos podem ser vistos na figura. É importante notar que o Caminho 1 ocorre na mitocôndria, enquanto o Caminho 2 ocorre no peroxissomo. Olhando para outras enzimas-chave dentro da via de degradação da L-lisina, ALDH7A1 é deficiente em crianças com convulsões dependentes de piridoxina. O GCDH é deficiente na acidúria glutárica tipo 1. O 2-oxoadipato intermediário é metabolizado pela 2-oxoadipato desidrogenase, semelhante ao complexo ácido cítrico / enzima do ciclo de Kreb 2-oxoglutarato desidrogenase.
Dois tipos de hiperlisinemia familiar foram descritos até agora: o tipo I está associado a uma deficiência combinada das duas atividades enzimáticas, LOR e SDH, enquanto na hiperlisinemia familiar tipo II apenas a atividade da sacaropina desidrogenase é prejudicada. A hiperlisinemia do tipo II também é conhecida como sacaropinúria.
Uma condição adicional que mostrou estar relacionada à hiperlisinemia é a deficiência de dienoil-CoA redutase, embora esta seja uma descoberta relativamente recente e não existam muitas publicações que apóiem isso.
Referências
Leitura adicional
- Maruyama K, Sugano S (janeiro de 1994). "Oligo-capping: um método simples para substituir a estrutura cap de mRNAs eucarióticos com oligoribonucleotídeos". Gene . 138 (1–2): 171–4. doi : 10.1016 / 0378-1119 (94) 90802-8 . PMID 8125298 .
links externos
- Localização do gene humano AASS no navegador do genoma UCSC .
- Detalhes do gene humano AASS no navegador do genoma UCSC .