Sintase do ácido aminolevulínico - Aminolevulinic acid synthase
| 5-aminolevulinato sintase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dímero da sintase do ácido aminolevulínico, Rhodobacter capsulatus
| |||||||||
| Identificadores | |||||||||
| EC nº | 2.3.1.37 | ||||||||
| CAS no. | 9037-14-3 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
O ácido aminolevulínico sintase ( ALA sintase , ALAS ou ácido delta-aminolevulínico sintase ) é uma enzima ( EC 2.3.1.37 ) que catalisa a síntese de ácido δ-aminolevulínico (ALA), o primeiro precursor comum na biossíntese de todos os tetrapirróis , como os hemes , cobalaminas e clorofilas. A reação é a seguinte:
- succinil-CoA + glicina ácido δ-aminolevulínico + CoA + CO 2
Esta enzima é expressa em todos os eucariotos não vegetais e na classe α de proteobactérias e a reação que catalisa é algumas vezes referida como a via de Shemin para a formação de ALA. Outros organismos produzem ALA por meio de uma via de três enzimas conhecida como via C5. O ALA é sintetizado pela condensação de glicina e succinil-CoA . Em humanos, a transcrição da ALA sintase é rigidamente controlada pela presença de elementos de ligação ao Fe 2+ , para prevenir o acúmulo de intermediários porfirínicos na ausência de ferro. Existem duas formas de ALA sintase no corpo. Uma forma é expressa nas células precursoras dos glóbulos vermelhos ( ALAS2 ), enquanto a outra ( ALAS1 ) é expressa de forma ubíqua em todo o corpo. A forma de hemácias é codificada por um gene no cromossomo x, enquanto a outra forma é codificada por um gene no cromossomo 3.
A doença anemia sideroblástica ligada ao X é causada por mutações no gene ALA sintase no cromossomo X, enquanto nenhuma doença é conhecida por ser causada por mutações no outro gene. Foi demonstrado recentemente que mutações de ganho de função no gene ALA sintase específico do eritróide causam uma forma anteriormente desconhecida de porfiria conhecida como protoporfiria dominante ligada ao X.
Estrutura e propriedades da enzima
As enzimas dependentes de PLP são prevalentes porque são necessárias para transformar aminoácidos em outros recursos. ALAS é um homodímero com subunidades de tamanho semelhante e os locais ativos consistindo em cadeias laterais de aminoácidos, como arginina, treonina e lisina, existem em uma interface de subunidade. A proteína quando extraída dos esferóides de R. contém 1.600 vezes e pesa cerca de 80.000 daltons. A atividade enzimática varia para diferentes fontes da enzima.
Mecanismo de reação
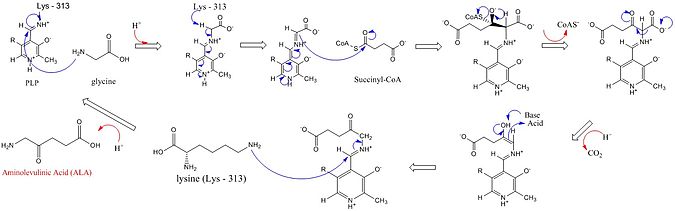
Os sítios ativos de ALAS utilizam três cadeias laterais de aminoácidos principais: Arg-85 e Thr-430 e Lys-313. Embora esses três aminoácidos tenham sido identificados para permitir que essa reação prossiga, eles seriam inativos sem a adição do cofator piridoxal 5'-fosfato (PLP), cujo papel nesta síntese é detalhado na imagem abaixo. Antes que a reação possa começar, o cofator PLP se liga à cadeia lateral da lisina para formar uma base de Schiff que promove o ataque pelo substrato de glicina. A lisina atua como base geral durante este mecanismo. No mecanismo de reação detalhado, os átomos de hidrônio que são adicionados vêm de uma variedade de resíduos que oferecem ligações de hidrogênio para facilitar a síntese de ALA. A ALA sintase remove o grupo carboxila da glicina e o CoA do succinil-CoA por meio de seu grupo prostético fosfato de piridoxal (um derivado da vitamina b6), formando ácido δ-aminolevulínico (dALA), assim chamado porque o grupo amino está no quarto átomo de carbono na molécula. Este mecanismo de reação é particularmente único em relação a outras enzimas que usam o cofator PLP porque a glicina é inicialmente desprotonada por um sítio ativo de lisina altamente conservado, levando à condensação com succinil-CoA e perda de CoA. A protonação do grupo carbonila do intermediário por um sítio ativo de histidina leva à perda do grupo carboxila. O último intermediário é finalmente reprotonado para produzir ALA. A dissociação do ALA da enzima é a etapa limitante da taxa da reação enzimática e mostrou ser dependente de uma mudança conformacional lenta da enzima. A função do fosfato de piridoxal é facilitar a remoção do hidrogênio, utilizando o anel eletrofílico de piridínio como reservatório de elétrons.
A localização dessa enzima em sistemas biológicos é um indicativo do feedback que ela pode receber. A ALA Synthase foi encontrada em bactérias, leveduras, fígado de aves e mamíferos, células sanguíneas e medula óssea. A localização dessa enzima nas células animais é dentro da mitocôndria. Uma vez que a enzima parece estar localizada perto de sua fonte de succinil-CoA e o final da via do heme indica que os pontos inicial e final da biossíntese do heme servem como feedback para a ALA sintase. A ALA sintase também é inibida por hemina e glicose .
Função biológica
ALAS1 e ALAS2 catalisam a primeira etapa no processo de síntese do heme. É a primeira etapa irreversível e também é limitante da taxa. Isso significa que o início da formação de hemes é muito intencional e sujeito a uma variedade de áreas de feedback. Por exemplo, os dois substratos, oxaloacetato e glicina, são altamente produzidos e utilizados em outros processos biológicos essenciais, como a glicólise e o ciclo do TCA. A imagem abaixo ilustra a via de síntese do heme e o papel que o ALAS desempenha.

Relevância da doença
A deficiência de ácido aminolevulínico sintase resulta na falta de capacidade de criar heme, uma vez que sua função é catalisar a primeira etapa do processo. Essas deficiências geralmente são resultado de mutações genéticas que podem resultar em uma variedade de doenças. Uma dessas doenças é a anemia sideroblástica ligada ao X, que resulta no aparecimento de glóbulos vermelhos na medula óssea. Esta doença está ligada especificamente a mutações nos genes que codificam para ALAS2.
Referências
links externos
- NIH
- Abu-Farha M., Niles J, Willmore W (2005). "A proteína 5-aminolevulinato sintase específica do eritóide é estabilizada por baixo oxigênio e inibição proteassomal". Biochem Cell Biol . 83 (5): 620–30. doi : 10.1139 / o05-045 . PMID 16234850 .
- Shemin, D; Rittenberg, D (1945). "A utilização da glicina para a síntese de uma porfirina". J. Biol. Chem . 159 : 567–8.
- Doença de defeito ANEMIAS SIDEROBLÁSTICAS -ALAS-2