RPE65 - RPE65
A proteína de 65 kDa específica do epitélio pigmentar da retina, também conhecida como isomerohidrolase retinóide, é uma enzima do ciclo visual dos vertebrados que é codificada em humanos pelo gene RPE65 . O RPE65 é expresso no epitélio pigmentar da retina (RPE, uma camada de células epiteliais que nutrem as células fotorreceptoras ) e é responsável pela conversão de todos os ésteres de retinil trans em 11-cis- retinol durante a fototransdução . O 11-cis-retinol é então usado na regeneração visual do pigmento em células fotorreceptoras . RPE65 pertence à família de enzimas carotenóides oxigenase .
Função
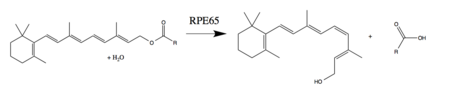
RPE65 é uma enzima crítica no ciclo visual dos vertebrados encontrada no epitélio pigmentado da retina. Também é encontrado em bastonetes e cones. A fotoisomerização de 11-cis-retinal para todo-trans-retinal inicia a via de fototransdução através da qual o cérebro detecta a luz. O all-trans-retinol não é fotoativo e, portanto, deve ser reconvertido em 11-cis-retinal antes de poder se recombinar com a opsina para formar um pigmento visual ativo. RPE65 reverte a fotoisomerização convertendo um éster trans-retinílico em 11-cis-retinol. Mais comumente, o substrato éster é o palmitato de retinila . As outras enzimas do ciclo visual completam as reações necessárias para oxidar e esterificar todo-trans-retinol em um éster retinílico (substrato de RPE65) e para oxidar 11-cis-retinol em 11-cis-retinal (o componente de pigmento visual fotoativo necessário) .
RPE65 também é referido como retinol isomerase ou retinóide isomerase, devido a debates anteriores sobre o substrato da enzima e se ela estava envolvida na hidrólise do éster .
Estrutura
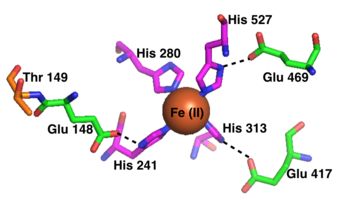
RPE65 é um dímero de duas subunidades simétricas e enzimaticamente independentes. O sítio ativo de cada subunidade tem uma estrutura de hélice beta de sete lâminas com quatro histidinas que contêm um cofator de ferro (II) . Este motivo estrutural é comum entre os membros estudados da família de enzimas carotenóides oxigenase . RPE65 está fortemente associado à membrana do retículo endoplasmático liso nas células RPE.
Estrutura ativa do site
O sítio ativo de cada sítio ativo RPE65 contém um cofator Fe (II) ligado por quatro histidinas (His 180 , His 241 , His 313 e His 527 ), cada um contribuído por uma pá separada na estrutura da hélice beta. Três das quatro histidinas são coordenadas aos resíduos de ácido glutâmico próximos (Glu 148 , Glu 417 e Glu 469 ), que se acredita ajudar a posicionar as histidinas para ligar o cofator de ferro em uma geometria octaédrica . Phe 103 , Thr 147 e Glu 148 circundam o sítio ativo onde ajudam a estabilizar o carbocátion intermediário e aumentar a estereosseletividade de RPE65 para 11-cis-retinol sobre 13-cis-retinol.
Os reagentes e produtos provavelmente entram e saem do sítio ativo através de um túnel hidrofóbico que se pensa abrir na membrana lipídica para absorção direta do substrato lipídico. Um segundo túnel menor também atinge o local ativo e pode servir como via para a água, mas é muito estreito para transportar os reagentes e produtos retinóides.
Interações de membrana
RPE65 está fortemente associado à membrana do sER. sER é anormalmente abundante em células RPE devido ao seu papel no processamento de retinóides lipídicos . Estudos estruturais indicam que RPE65 está parcialmente embutido na membrana sER por meio de interações entre sua face hidrofóbica e o interior da membrana lipídica . Isso é apoiado pela necessidade de detergente para solubilizar RPE65. Uma parte importante da face hidrofóbica de RPE65, resíduos 109-126, forma uma hélice alfa anfipática que provavelmente contribui para a afinidade de membrana da proteína. Além disso, Cys 112 é palmitoilado em RPE65 nativo, apoiando ainda mais a teoria de que a face hidrofóbica de RPE65 está embutida na membrana.
A face hidrofóbica contém a entrada para o grande túnel que leva ao sítio ativo da enzima . A presença deste canal na face hidrofóbica combinada com a capacidade demonstrada de RPE65 de absorver a direção do substrato da bicamada lipídica é consistente com RPE65 sendo parcialmente incorporado na membrana.
Conservação
RPE65 foi isolado de uma ampla gama de vertebrados, incluindo peixes-zebra, galinhas, ratos, sapos e humanos. Sua estrutura é altamente conservada entre as espécies, particularmente na hélice beta e provavelmente nas regiões ligadas à membrana. As sequências de aminoácidos de RPE65 humano e bovino diferem em menos de 1%. Os resíduos de histidina da estrutura da hélice beta e o cofator de ferro ligado (II) são 100% conservados entre os ortólogos RPE65 estudados e outros membros da família da oxigenase carotenóide .
Solúvel RPE65 (sRPE65)
Anteriormente, foi proposto que RPE65 existe em duas formas interconvertidas: mRPE65 ligado à membrana e sRPE65 solúvel. Esta teoria sugeriu que a conversão reversível de sRPE65 em mRPE65 por palmitoilação em Cys 231 , Cys 329 e Cys 330 desempenhou um papel na regulação do ciclo retinóide e dotando mRPE65 com sua afinidade de membrana. No entanto, estudos cristalográficos de RPE65 demonstraram que esses resíduos não são palmitoilados nem voltados para a superfície. Novos estudos também não conseguiram confirmar a presença de RPE solúvel em abundância65. Assim, essa teoria foi amplamente abandonada.
Mecanismo
RPE65 catalisa a conversão de éster all-trans-retinil em 11-cis-retinol por meio de uma clivagem de ligação S N 1 O-alquil proposta . A combinação de RPE65 de uma clivagem de O-alquil éster, isomerização geométrica e adição de água é atualmente considerada única na biologia. No entanto, as reações de clivagem de O-alquil éster com intermediários carbocátion estabilizados de forma semelhante são usadas por químicos orgânicos.
Clivagem de O-Alquil
A clivagem O-alquil da ligação éster, auxiliada por um cofator Fe (II), cria um intermediário de carbocátion que é estabilizado pela cadeia de polieno conjugada. A deslocalização do carbocátion reduz a ordem de ligação da cadeia de polieno, reduzindo assim a energia de ativação da isomerização trans para cis. Além disso, Phe 103 e Thr 178 estabilizam o carbocátion isomerizado e são considerados responsáveis pela estereosseletividade da enzima. Após a isomerização, um ataque nucleofílico pela água em C15 restaura a conjugação da cadeia de polieno e completa a clivagem da ligação éster.
Mecanismo S N 2 alternativo
Quase todas as outras reações de hidrólise de ésteres bioquímicos ocorrem por meio da reação S N 2 no carbono acílico . No entanto, estudos de marcação de isótopos demonstraram que o oxigênio no produto 11-cis-retinol final de RPE65 se origina do solvente em vez do éster reagente, apoiando o mecanismo de clivagem de O-alquil. Além disso, um mecanismo de reação de hidrólise do éster S N 2 dependeria de um ataque S N 2 desfavorável em separado no C11 rico em elétrons por algum nucleófilo - mais provavelmente um resíduo de cistina - para completar a porção de isomerização da reação. Não é apenas o ataque nucleofílico de um alceno energeticamente desfavorável, mas a região do sítio ativo carece de resíduos de cistina para atuar como o nucleófilo.
Significado clínico
Mutações neste gene foram associadas à amaurose congênita de Leber tipo 2 (LCA2) e retinite pigmentosa (RP). Mutações RPE65 são as mutações mais comumente detectadas em pacientes com LCA na Dinamarca. A grande maioria das mutações RPE65 em pacientes com LCA2 e RP ocorre no regime de hélice beta e acredita-se que inibe o dobramento adequado de proteínas e a ligação do cofator de ferro. Os locais de mutação de hélice particularmente comuns são Tyr 368 e His 182 . A substituição em Arg 91 também é comum e demonstrou afetar as interações da membrana RPE65 e a absorção do substrato.
Embora a perda completa da função esteja associada a doenças como LCA e RP, a inibição parcial de RPE65 foi proposta como um tratamento para a degeneração macular relacionada à idade (DMRI). All-trans-retinylamine (Ret-NH2) e emixustat ambos têm sido mostrados para inibir competitivamente RPE65. O Emixustat está atualmente passando por testes clínicos de fase 3 da FDA como uma terapia para a DMRI.
O trabalho de Jean Bennett e Katherine A. High com a mutação RPE65 reverteu uma forma hereditária de cegueira. Eles receberam a primeira aprovação do FDA de uma terapia genética para uma doença genética, que é chamada de Voretigene neparvovec . Por suas realizações científicas, Jean Bennett e Katherine A. High foram nomeados como um dos três finalistas em 2018 para o prêmio Lorraine Cross de US $ 1 milhão da Sanford Health por inovação em ciência e medicina.
Veja também
Referências
Leitura adicional
- Estrutura e função da proteína
- Båvik CO, Busch C, Eriksson U (novembro de 1992). "Caracterização de um receptor de membrana de proteína de ligação ao retinol plasmático expresso no epitélio pigmentar da retina" . The Journal of Biological Chemistry . 267 (32): 23035–42. doi : 10.1016 / S0021-9258 (18) 50052-1 . PMID 1331074 .
- Hamel CP, Tsilou E, Harris E, Pfeffer BA, Hooks JJ, Detrick B, Redmond TM (março de 1993). "Uma proteína microssomal regulada pelo desenvolvimento, específica para o epitélio pigmentar da retina dos vertebrados". Journal of Neuroscience Research . 34 (4): 414–25. doi : 10.1002 / jnr.490340406 . PMID 8474143 . S2CID 1590344 .
- Tsilou E, Hamel CP, Yu S, Redmond TM (outubro de 1997). "RPE65, a principal proteína da membrana microssomal do epitélio pigmentar da retina, associa-se aos lipossomas fosfolipídicos" . Arquivos de Bioquímica e Biofísica . 346 (1): 21–7. doi : 10.1006 / abbi.1997.0276 . PMID 9328280 .
- Estudos Clínicos e Genéticos
- Koenekoop RK, Lopez I, den Hollander AI, Allikmets R, Cremers FP (julho de 2007). "Teste genético para distrofias e disfunções da retina: benefícios, dilemas e soluções". Oftalmologia Clínica e Experimental . 35 (5): 473–85. doi : 10.1111 / j.1442-9071.2007.01534.x . PMID 17651254 . S2CID 37487873 .
- Nicoletti A, Wong DJ, Kawase K, Gibson LH, Yang-Feng TL, Richards JE, Thompson DA (abril de 1995). "Caracterização molecular do gene humano que codifica uma proteína abundante de 61 kDa específica para o epitélio pigmentar da retina". Human Molecular Genetics . 4 (4): 641–9. doi : 10.1093 / hmg / 4.4.641 . PMID 7633413 .
- Hamel CP, Jenkins NA, Gilbert DJ, Copeland NG, Redmond TM (abril de 1994). "O gene para a proteína específica do epitélio pigmentar da retina RPE65 está localizado em 1p31 humano e em camundongo 3". Genômica . 20 (3): 509–12. doi : 10.1006 / geno.1994.1212 . PMID 8034329 .
- Marlhens F, Bareil C, Griffoin JM, Zrenner E, Amalric P, Eliaou C, Liu SY, Harris E, Redmond TM, Arnaud B, Claustres M, Hamel CP (outubro de 1997). "Mutações em RPE65 causam amaurose congênita de Leber". Nature Genetics . 17 (2): 139–41. doi : 10.1038 / ng1097-139 . PMID 9326927 . S2CID 19648351 .
- Gu SM, Thompson DA, Srikumari CR, Lorenz B, Finckh U, Nicoletti A, Murthy KR, Rathmann M, Kumaramanickavel G, Denton MJ, Gal A (outubro de 1997). "Mutações em RPE65 causam distrofia retiniana severa autossômica recessiva de início na infância" . Nature Genetics . 17 (2): 194–7. doi : 10.1038 / ng1097-194 . PMID 9326941 . S2CID 3122835 .
- Morimura H, Fishman GA, Grover SA, Fulton AB, Berson EL, Dryja TP (março de 1998). "Mutações no gene RPE65 em pacientes com retinite pigmentar autossômica recessiva ou amaurose congênita leber" . Anais da Academia Nacional de Ciências dos Estados Unidos da América . 95 (6): 3088–93. Bibcode : 1998PNAS ... 95.3088M . doi : 10.1073 / pnas.95.6.3088 . PMC 19699 . PMID 9501220 .
- Nicoletti A, Kawase K, Thompson DA (março de 1998). "Análise do promotor de RPE65, o gene que codifica uma proteína específica do epitélio pigmentar da retina de 61 kDa". Oftalmologia Investigativa e Ciências Visuais . 39 (3): 637–44. PMID 9501877 .
- Marlhens F, Griffoin JM, Bareil C, Arnaud B, Claustres M, Hamel CP (1999). "Distrofia retinal autossômica recessiva associada a duas novas mutações no gene RPE65" . European Journal of Human Genetics . 6 (5): 527–31. doi : 10.1038 / sj.ejhg.5200205 . PMID 9801879 .
- Ma JX, Zhang D, Laser M, Brownlee NA, Re GG, Hazen-Martin DJ, Redmond TM, Crouch RK (junho de 1999). "Identificação de RPE65 em células renais transformadas". FEBS Letters . 452 (3): 199–204. doi : 10.1016 / S0014-5793 (99) 00606-7 . PMID 10386590 . S2CID 24731751 .
- Lotery AJ, Namperumalsamy P , Jacobson SG, Weleber RG, Fishman GA, Musarella MA, Hoyt CS, Héon E, Levin A, Jan J, Lam B, Carr RE, Franklin A, Radha S, Andorf JL, Sheffield VC, Stone EM (Abril de 2000). "Análise de mutação de 3 genes em pacientes com amaurose congênita de Leber" . Arquivos de oftalmologia . 118 (4): 538–43. doi : 10.1001 / archopht.118.4.538 . PMID 10766140 .
- Simovich MJ, Miller B, Ezzeldin H, Kirkland BT, McLeod G, Fulmer C, Nathans J, Jacobson SG, Pittler SJ (agosto de 2001). "Quatro novas mutações no gene RPE65 em pacientes com amaurose congênita de Leber" . Mutação Humana . 18 (2): 164. doi : 10.1002 / humu.1168 . PMID 11462243 .
- Thompson DA, McHenry CL, Li Y, Richards JE, Othman MI, Schwinger E, Vollrath D, Jacobson SG, Gal A (janeiro de 2002). "Distrofia retiniana devido à isodisomia paterna para o cromossomo 1 ou cromossomo 2, com homoalelismo para mutações em RPE65 ou MERTK, respectivamente" . American Journal of Human Genetics . 70 (1): 224–9. doi : 10.1086 / 338455 . PMC 384890 . PMID 11727200 .
- Felius J, Thompson DA, Khan NW, Bingham EL, Jamison JA, Kemp JA, Sieving PA (janeiro de 2002). "Curso clínico e função visual em uma família com mutações no gene RPE65" . Arquivos de oftalmologia . 120 (1): 55–61. doi : 10.1001 / archopht.120.1.55 . PMID 11786058 .
- Joseph B, Srinivasan A, Soumittra N, Vidhya A, Shetty NS, Uthra S, Kumaramanickavel G (abril de 2002). "Gene RPE65: PCR multiplex e triagem de mutação em pacientes da Índia com doenças degenerativas da retina". Journal of Genetics . 81 (1): 19–23. doi : 10.1007 / BF02715866 . PMID 12357075 . S2CID 36083188 .
- Yzer S, van den Born LI, Schuil J, Kroes HY, van Genderen MM, Boonstra FN, van den Helm B, Brunner HG, Koenekoop RK, Cremers FP (setembro de 2003). "Uma mutação fundadora Tyr368His RPE65 está associada à expressão variável e progressão de distrofia retinal de início precoce em 10 famílias de uma população geneticamente isolada" . Journal of Medical Genetics . 40 (9): 709–13. doi : 10.1136 / jmg.40.9.709 . PMC 1735582 . PMID 12960219 .