Estereocontrole macrocíclico - Macrocyclic stereocontrol
O estereocontrole macrocíclico se refere ao resultado direcionado de uma dada reação química intermolecular ou intramolecular , geralmente uma reação orgânica , que é governada pela preferência conformacional ou geométrica de um anel carbocíclico ou heterocíclico , em que o anel contém 8 ou mais átomos .
Introdução
O estereocontrole para anéis de ciclohexano está bem estabelecido na química orgânica, em grande parte devido ao posicionamento preferencial axial / equatorial dos substituintes no anel. O estereocontrole macrocíclico modela a substituição e as reações de anéis médios e grandes em química orgânica , com elementos estereogênicos remotos fornecendo influência conformacional suficiente para direcionar o resultado de uma reação.
As primeiras suposições em relação aos macrociclos na química sintética os consideravam muito flexíveis para fornecer qualquer grau de controle estereoquímico ou regioquímico em uma reação. Os experimentos de W. Clark ainda no final dos anos 1970 e 1980 desafiaram essa suposição, enquanto vários outros encontraram dados cristalográficos e dados de RMN que sugeriam que os anéis macrocíclicos não eram as espécies flexíveis e conformacionalmente mal definidas que muitos presumiam.
O grau em que um anel macrocíclico é rígido ou flexível depende significativamente da substituição do anel e do tamanho geral. Significativamente, mesmo pequenas preferências conformacionais, como aquelas previstas em macrociclos flexíveis, podem influenciar profundamente o estado fundamental de uma dada reação, proporcionando estereocontrole, como na síntese de miiakolídeo. A modelagem computacional pode prever conformações de anéis médios com razoável precisão, pois Still usou cálculos de modelagem de mecânica molecular para prever conformações de anel para determinar a reatividade potencial e resultados estereoquímicos.
As classes de reação usadas na síntese de produtos naturais sob o modelo de estereocontrole macrocíclico para obter uma estereoquímica desejada incluem: hidrogenações, como em neopeltolida e (±) -metinolida, epoxidações, como em (±) -periplanona B e lonomycin A, hidroborações, como em 9-dihidroeritronolídeo B, alquilações de enolato como em (±) -3-desoxirosaranolida, dihidroxilações como em cladiell-11-eno-3,6,7-triol e reduções como em eucanabinolídeo.
Preferências conformacionais
Os macrociclos podem acessar uma série de conformações estáveis, com preferência por residir naquelas que minimizam o número de interações transanulares não ligadas dentro do anel. Anéis médios (8-11 átomos) são os mais tensos com energia de tensão entre 9-13 (kcal / mol); a análise dos fatores importantes na consideração de conformações macrocíclicas maiores pode, portanto, ser modelada olhando para as conformações de anel médias. A análise conformacional de anéis de membros ímpares sugere que eles tendem a residir em formas menos simétricas com diferenças de energia menores entre conformações estáveis.
Ciclooctano
A análise conformacional dos anéis médios começa com o exame do ciclooctano . Métodos espectroscópicos determinaram que octano possui três conformações principais: cadeira-barco , cadeira-cadeira , e barco-barco . O ciclooctano prefere residir em uma conformação de barco-cadeira, minimizando o número de interações de etano eclipsadas (mostrado em azul), bem como a tensão de torção. A conformação cadeira-cadeira é a segunda conformação mais abundante à temperatura ambiente, com uma proporção de 96: 4 cadeira-barco: cadeira-cadeira observada.
As preferências posicionais de substituição no conformador de estado fundamental de metil ciclooctano podem ser aproximadas usando parâmetros semelhantes àqueles para anéis menores. Em geral, os substituintes exibem preferências para posicionamento equatorial, exceto para a estrutura de menor energia (pseudo-valor A de -0,3 kcal / mol na figura abaixo) em que a substituição axial é favorecida. O "pseudo valor A" é melhor tratado como a diferença de energia aproximada entre colocar o substituinte de metila nas posições equatorial ou axial. A interação mais desfavorável energeticamente envolve a substituição axial no vértice da porção do barco do anel (6,1 kcal / mol).

Essas diferenças energéticas podem ajudar a racionalizar as conformações de menor energia de estruturas de anéis de 8 átomos contendo um centro sp 2 . Nessas estruturas, o barco-cadeira é o modelo do estado fundamental, com a substituição forçando a estrutura a adotar uma conformação tal que as interações não ligadas sejam minimizadas da estrutura pai. Pela figura do cicloocteno abaixo, pode-se observar que uma face está mais exposta que a outra, prenunciando uma discussão sobre ângulos de ataque privilegiados (ver ataque periférico).

A análise de raios-X de ciclooctanos funcionalizados forneceu prova das preferências conformacionais nesses anéis médios. Significativamente, os modelos calculados corresponderam aos dados de raios-X obtidos, indicando que a modelagem computacional desses sistemas poderia, em alguns casos, prever conformações com bastante precisão. O caráter sp 2 aumentado dos anéis de ciclopropano favorece que eles sejam colocados de forma semelhante, de modo que aliviem as interações não ligadas.

Ciclodecano
Semelhante ao ciclooctano, um anel de ciclodecano exibe várias conformações com duas conformações de energia mais baixa. A conformação barco-cadeira-barco é energeticamente minimizada, enquanto a conformação cadeira-cadeira-cadeira tem interações eclipsantes significativas.
Essas preferências conformacionais de estado fundamental são analogias úteis para sistemas de anéis macrocíclicos mais funcionalizados, onde os efeitos locais ainda podem ser governados para a primeira aproximação por conformações com energia minimizada, embora o tamanho do anel maior permita mais flexibilidade conformacional de toda a estrutura. Por exemplo, em metil ciclodecano, pode-se esperar que o anel adote a conformação minimizada de barco-cadeira-barco. A figura abaixo mostra a penalidade energética entre colocar o grupo metil em certos locais dentro da estrutura barco-cadeira-barco. Ao contrário dos sistemas de pequenos anéis canônicos, o sistema ciclodecano com o grupo metil colocado nos "cantos" da estrutura não exibe preferência por posicionamento axial vs. equatorial devido à presença de uma interação inevitável gauche-butano em ambas as conformações. Interações significativamente mais intensas se desenvolvem quando o grupo metil é colocado na posição axial em outros locais na conformação barco-cadeira-barco.

Sistemas de anel maiores
Princípios semelhantes orientam as conformações de menor energia de sistemas de anéis maiores. Junto com os princípios de estereocontrole acíclico descritos abaixo, as interações sutis entre substituintes remotos em anéis grandes, análogos àqueles observados para anéis com 8-10 membros, podem influenciar as preferências conformacionais de uma molécula. Em conjunto com os efeitos dos substituintes remotos, as interações acíclicas locais também podem desempenhar um papel importante na determinação do resultado das reações macrocíclicas. A flexibilidade conformacional de anéis maiores permite potencialmente uma combinação de estereocontrole acíclico e macrocíclico para reações diretas.

Reatividade e preferências conformacionais
O resultado estereoquímico de uma dada reação em um macrociclo capaz de adotar várias conformações pode ser modelado por um cenário de Curtin-Hammett. No diagrama abaixo, as duas conformações de estado fundamental existem em equilíbrio, com alguma diferença em suas energias de estado fundamental. A conformação B tem menos energia do que a conformação A e, embora possua uma barreira de energia semelhante ao seu estado de transição em uma reação hipotética, o produto formado é predominantemente o produto B (PB) decorrente da conformação B por meio do estado de transição B (TS B). A preferência inerente de um anel de existir em uma conformação em relação a outra fornece uma ferramenta para o controle estereosseletivo de reações enviesando o anel em uma determinada configuração no estado fundamental. As diferenças de energia, ΔΔG ‡ e ΔG 0 são considerações significativas neste cenário. A preferência por uma conformação em relação a outra pode ser caracterizada por ΔG 0 , a diferença de energia livre, que pode, em algum nível, ser estimada a partir da análise conformacional. A diferença de energia livre entre os dois estados de transição de cada conformação em seu caminho para a formação do produto é dada por ΔΔG ‡ . O valor de ΔG 0 entre não apenas uma, mas muitas conformações acessíveis é o ímpeto energético subjacente para as reações que ocorrem a partir da conformação de estado fundamental mais estável e é o ponto crucial do modelo de ataque periférico descrito abaixo.

O modelo de ataque periférico
Os anéis macrocíclicos contendo centros sp 2 exibem uma preferência conformacional pelos centros sp 2 para evitar interações transanulares não ligadas por orientação perpendicular ao plano do anel. Clark W. Still propôs que as conformações do estado fundamental dos anéis macrocíclicos, contendo a orientação de energia minimizada do centro sp 2 , exibem uma face de uma olefina para fora do anel. A adição de reagentes do lado externo da face da olefina e do anel (ataque periférico) é assim favorecida, enquanto o ataque através do anel na diastereoface interna é desfavorecido. As conformações do estado fundamental ditam a face exposta do sítio reativo do macrociclo, portanto, os elementos de estereocontrole local e distante devem ser considerados. O modelo de ataque periférico é válido para várias classes de macrociclos, embora se baseie na suposição de que as geometrias do estado fundamental permanecem imperturbadas no estado de transição correspondente da reação.
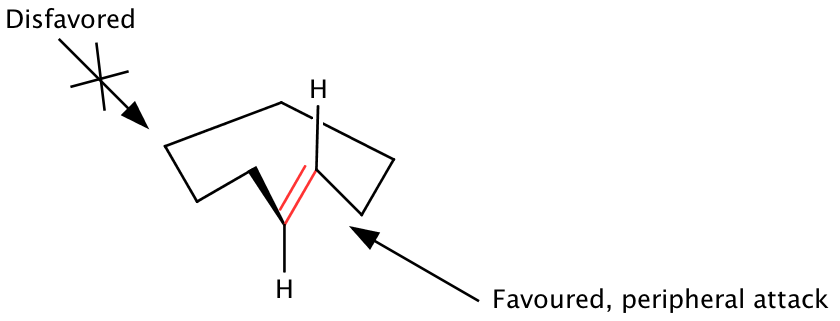
Reações intermoleculares
As primeiras investigações do estereocontrole macrocíclico estudaram a alquilação de cetonas cíclicas de 8 membros com substituições variáveis. No exemplo abaixo, a alquilação de 2-metilciclooctanona ocorreu para produzir o produto predominantemente trans. Procedendo da conformação de energia mais baixa de 2-metilcicloctanona, o ataque periférico é observado a partir de qualquer uma das conformações de enolato de baixa energia (diferença energética de 0,5 (kcal / mol)), resultando em um produto trans de qualquer uma das duas conformações de estado de transição representadas .

Ao contrário do caso da ciclooctanona, a alquilação de anéis de 2-ciclodecanona não exibe diastereosseletividade significativa.

No entanto, lactonas cíclicas de 10 membros exibem diastereosseletividade significativa. A proximidade do grupo metil à ligação éster foi diretamente correlacionada com a razão diastereomérica dos produtos de reação, com a colocação na posição 9 (abaixo) produzindo a maior seletividade. Em contraste, quando o grupo metila foi colocado na posição 7, uma mistura 1: 1 de diastereômeros foi obtida. A colocação do grupo metil na posição 9 na posição axial produz a conformação do estado fundamental mais estável do anel de 10 membros levando a alta diastereosseletividade.

A adição do conjugado à E-enona abaixo também segue o modelo de ataque periférico esperado para produzir produto predominantemente trans. A alta seletividade nesta adição pode ser atribuída à colocação de centros sp 2 de forma que as interações transanulares não ligadas sejam minimizadas, enquanto também coloca a substituição de metila na posição mais energeticamente favorável para anéis de ciclodecano. Esta conformação do estado fundamental viesa fortemente a adição de conjugados à diastereofácia menos impedida.

Reações intramoleculares
Semelhante às reações intermoleculares, as reações intramoleculares podem mostrar estereosseletividade significativa a partir da conformação do estado fundamental da molécula. Na reação de Diels-Alder intramolecular descrita abaixo, a conformação de energia mais baixa produz o produto observado. A estrutura que minimiza as interações estéricas repulsivas fornece o produto observado por ter a barreira mais baixa para um estado de transição para a reação. Embora nenhum ataque externo de um reagente ocorra, essa reação pode ser pensada de forma semelhante àquelas modeladas com ataque periférico; a conformação de energia mais baixa é a mais provável de reagir para uma determinada reação.

As conformações de menor energia dos macrociclos também influenciam as reações intramoleculares envolvendo a formação de ligações transanulares. Na sequência de adição de Michael intramolecular abaixo, a conformação do estado fundamental minimiza as interações transanulares, colocando os centros sp 2 nos vértices apropriados, ao mesmo tempo que minimiza as interações diaxiais.

Exemplos proeminentes em síntese
Esses princípios foram aplicados em vários alvos de produtos naturais contendo anéis de médio e grande porte. As sínteses de cladiell-11-eno-3,6,7-triol, (±) -periplanona B, eucanabinolida e neopeltolida são todas significativas em seu uso de estereocontrole macrocíclico a fim de obter os alvos estruturais desejados.
Cladiell-11-eno-3,6,7-triol
A família cladielina de produtos naturais marinhos possui uma arquitetura molecular interessante, geralmente contendo um anel de tamanho médio de 9 membros. A síntese de (-) - cladiella-6,11-dien-3-ol permitiu o acesso a uma variedade de outros membros da família da cladielina. Notavelmente, a conversão para cladiell-11-eno-3,6,7-triol faz uso do estereocontrole macrocíclico na diidroxilação de uma olefina trissubstituída. A seguir é mostrada a etapa sintética controlada pela conformação do estado fundamental do macrociclo, permitindo a diidroxilação estereosseletiva sem o uso de um reagente assimétrico. Este exemplo de adição controlada de substrato é um exemplo do modelo de ataque periférico em que dois centros na molécula são adicionados dois ao mesmo tempo de forma combinada.

(±) -Periplanona B
A síntese de (±) -periplanona B é um exemplo proeminente de estereocontrole macrocíclico. A periplanona B é um feromônio sexual da barata fêmea americana e tem sido alvo de várias tentativas de síntese. Significativamente, duas reações no precursor macrocíclico para (±) -periplanona B foram direcionadas usando apenas preferências conformacionais do estado fundamental e o modelo de ataque periférico. Reagindo a partir da conformação barco-cadeira-barco mais estável, a epoxidação assimétrica da olefina cis-interna pode ser alcançada sem usar um método de epoxidação controlado por reagente ou uma epoxidação dirigida com um álcool alílico.

A epoxidação da cetona foi alcançada e pode ser modelada pelo ataque periférico do ileto de enxofre no grupo carbonila em uma reação de Johnson-Corey-Chaykovsky para produzir a forma protegida de (±) -periplanona B. Desproteção do álcool seguida de oxidação produziu o produto natural desejado.

Eucanabinolida
Na síntese do germacranolídeo citotóxico sesquiterpeno eucanabinolídeo, Still demonstra a aplicação do modelo de ataque periférico à redução de uma cetona para o estabelecimento de um novo estereocentro utilizando NaBH 4 . Significativamente, a síntese de eucanabinolídeo se baseou no uso de modelagem computacional da mecânica molecular (MM2) para prever a conformação de energia mais baixa do macrociclo para projetar reações estereoquímicas controladas por substrato.

Neopeltolida
Neopeltolide foi originalmente isolado de esponjas perto da costa jamaicana e exibe atividade citotóxica nanomolar contra várias linhas de células cancerosas. A síntese do núcleo macrocíclico de neopeltolídeo exibe uma hidrogenação controlada pela conformação do estado fundamental do macrociclo.

Críticas
O modelo de ataque periférico é baseado na previsão de conformações de energia mais baixa de um sistema inerentemente complicado, onde perturbações diferenciadas podem causar enormes consequências estereodiferenciadoras. Ao modelar o ataque periférico usando o cenário Curtin-Hammett descrito acima, o estado de transição é excluído desta análise de conformação, assumindo que a barreira para cada estado de transição de uma determinada conformação é a mesma e, portanto, que as conformações de estado fundamental são o único fator determinante do produto . Uma crítica significativa é o mapeamento de conformações de anéis de tamanho médio e influências em sistemas de anéis maiores. Os macrociclos podem possuir vários graus de rigidez em sua estrutura, tornando um único modelo de ataque periférico difícil de aplicar a todos os sistemas. Diferentes classes de reações podem não se encaixar no modelo de ataque periférico, como reações como epoxidações, hidroxilações, alquilações e reduções, todas procedem através de diferentes estados de transição.


