Flortaucipir ( 18 F) -Flortaucipir (18F)
 | |
| Dados clínicos | |
|---|---|
| Pronúncia | flor tau 'si pir 18 F |
| Nomes comerciais | Tauvid |
| Outros nomes | 18F-AV-1451, 18 F-AV-1451, 18 F-T807, Flortaucipir F-18, flortaucipir F 18 ( USAN EUA ) |
| Dados de licença | |
| Vias de administração |
Intravenoso |
| Código ATC | |
| Status legal | |
| Status legal | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Dados químicos e físicos | |
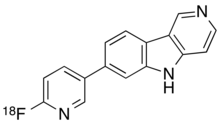
| Fórmula | C 16 H 10 [ 18 F] N 3 |
| Massa molar | 262,27 g / mol |
| Modelo 3D ( JSmol ) | |
| |
| |
Flortaucipir ( 18 F) , vendido sob o nome de marca Tauvid , é um agente de diagnóstico radioactivos indicados para utilização com tomografia por emissão de positrões (PET) de imagem para a imagem do cérebro.
As reações adversas mais comuns incluem dor de cabeça, dor no local da injeção e aumento da pressão arterial.
Duas proteínas - tau e amilóide - são reconhecidas como marcas da doença de Alzheimer . Em pessoas com doença de Alzheimer, as formas patológicas das proteínas tau se desenvolvem dentro dos neurônios do cérebro, criando emaranhados neurofibrilares . Depois que o flortaucipir ( 18 F) é administrado por via intravenosa, ele se liga a locais no cérebro associados a esse dobramento incorreto da proteína tau. O cérebro pode então ser visualizado com uma tomografia para ajudar a identificar a presença de patologia tau.
É a primeira droga usada para ajudar a imaginar uma característica distintiva da doença de Alzheimer no cérebro, chamada patologia tau. A Food and Drug Administration (FDA) dos EUA o considera um medicamento de primeira linha .
Usos médicos
Flortaucipir ( 18 F) é um agente diagnóstico radioativo para adultos com deficiência cognitiva que estão sendo avaliados para a doença de Alzheimer. É indicado para imagens de tomografia por emissão de pósitrons (PET) do cérebro para estimar a densidade e distribuição de emaranhados neurofibrilares de tau agregados (NFTs), um marcador primário da doença de Alzheimer.
Flortaucipir ( 18 F) não é indicado para uso na avaliação de pessoas com encefalopatia traumática crônica (CTE).
Química
Quimicamente, o flortaucipir F 18 é 7- (6- [F-18] fluoropiridin-3-il) -5H-pirido [4,3 b] indol.
História
O flortaucipir ( 18 F) foi aprovado para uso médico nos Estados Unidos em maio de 2020.
A segurança e eficácia da imagem do flortaucipir ( 18 F) foram avaliadas em dois estudos clínicos. Em cada estudo, cinco avaliadores leram e interpretaram a imagem do flortaucipir ( 18 F). Os avaliadores desconheciam as informações clínicas e interpretaram a imagem como positiva ou negativa.
O primeiro estudo envolveu 156 participantes que estavam em estado terminal e concordaram em se submeter a imagens com flortaucipir ( 18 F) e participar de um programa de doação de cérebro post-mortem. Em 64 dos participantes que morreram dentro de nove meses após a varredura cerebral com flortaucipir ( 18 F), a leitura dos avaliadores da varredura com flortaucipir ( 18 F) foi comparada com leituras post-mortem de patologistas independentes que avaliaram a densidade e distribuição dos emaranhados neurofibrilares (NFTs) no mesmo cérebro. O estudo mostrou que os avaliadores que liam as imagens do flortaucipir ( 18 F) tinham uma alta probabilidade de avaliar corretamente os participantes com patologia tau e uma probabilidade média a alta de avaliar corretamente os participantes sem tau patologia.
O segundo estudo incluiu os mesmos participantes com doença terminal do primeiro estudo, mais 18 participantes adicionais com doença terminal e 159 participantes com deficiência cognitiva sendo avaliados para a doença de Alzheimer (a população de pacientes indicada). O estudo avaliou o quão bem as leituras dos avaliadores do flortaucipir ( 18 F) concordavam com as avaliações de cada um das leituras. A concordância perfeita do leitor seria 1, enquanto nenhuma concordância do leitor seria 0. Neste estudo, a concordância do leitor foi de 0,87 em todos os 241 participantes. Em uma análise de subgrupo separada que incluiu os 82 participantes com doenças terminais diagnosticados após a morte e os 159 participantes com deficiência cognitiva, a concordância do leitor foi de 0,90 para os participantes na população indicada e de 0,82 nos participantes com doenças terminais.
O FDA aprovou o flortaucipir ( 18 F) com base em evidências de 1921 participantes de 19 estudos realizados em 322 locais nos Estados Unidos, Austrália, Bélgica, Canadá, França, Japão, Holanda e Polônia.
A capacidade do flortaucipir ( 18 F) para detectar a patologia tau foi avaliada em participantes com estágios geralmente graves de demência e pode ser menor em participantes em estágios iniciais de declínio cognitivo do que nos participantes com doença terminal que foram estudados.
A Food and Drug Administration (FDA) dos EUA concedeu o pedido de revisão prioritária de flortaucipir ( 18 F) e concedeu a aprovação do Tauvid à Avid Radiopharmaceuticals, Inc.
Referências
Leitura adicional
- Pontecorvo MJ, Devous MD, Kennedy I, et al. (Junho de 2019). "Um estudo longitudinal multicêntrico de flortaucipir (18F) no envelhecimento normal, comprometimento cognitivo leve e demência da doença de Alzheimer" . Brain . 142 (6): 1723–1735. doi : 10.1093 / brain / awz090 . PMC 6536847 . PMID 31009046 .
- Schonhaut DR, McMillan CT, Spina S, et al. (Outubro de 2017). "A tomografia por emissão de pósitrons de 18 F-flortaucipir tau distingue paralisia supranuclear progressiva estabelecida de controles e doença de Parkinson: um estudo multicêntrico" . Ann. Neurol . 82 (4): 622–634. doi : 10.1002 / ana.25060 . PMC 5665658 . PMID 28980714 .
links externos
- "Flortaucipir F18" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- Número do ensaio clínico NCT03507257 para "Longitudinal Early-início Alzheimer's Disease Study Protocol (LEADS)" em ClinicalTrials.gov
- Número do ensaio clínico NCT02278367 para "Avaliação Clínica de 18F-AV-1451" em ClinicalTrials.gov
- Número do ensaio clínico NCT02516046 para "18F-AV-1451 Autopsy Study" em ClinicalTrials.gov
- Número do ensaio clínico NCT03901092 para "Um estudo de leitor para avaliar a precisão e confiabilidade da interpretação de PET do Flortaucipir F 18" em ClinicalTrials.gov
