Desidrogenase de flavoproteína de transferência de elétrons - Electron-transferring-flavoprotein dehydrogenase
| Desidrogenase de flavoproteína de transferência de elétrons | |||||||
|---|---|---|---|---|---|---|---|
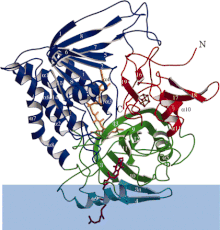 Diagrama de fita da flavoproteína desidrogenase de transferência de elétrons com cada domínio funcional diferentemente colorido. A faixa azul é a área da membrana.
| |||||||
| Identificadores | |||||||
| Símbolo | ETFD | ||||||
| Alt. símbolos | ETF-QO | ||||||
| Gene NCBI | 2110 | ||||||
| HGNC | 3483 | ||||||
| OMIM | 231675 | ||||||
| PDB | 2GMH | ||||||
| RefSeq | NM_004453 | ||||||
| UniProt | Q16134 | ||||||
| Outros dados | |||||||
| Número CE | 1.5.5.1 | ||||||
| Locus | Chr. 4 q4q32.1 | ||||||
| |||||||
A flavoproteína desidrogenase de transferência de elétrons ( ETF desidrogenase ou flavoproteína de transferência de elétrons-ubiquinona oxidoredutase , EC 1.5.5.1 ) é uma enzima que transfere elétrons da flavoproteína de transferência de elétrons na matriz mitocondrial , para o pool de ubiquinona na membrana mitocondrial interna . Faz parte da cadeia de transporte de elétrons . A enzima é encontrada em procariotos e eucariotos e contém um aglomerado de flavina e FE-S . Em humanos, é codificado pelo gene ETFDH . A deficiência de ETF desidrogenase causa a doença genética humana, deficiência de múltiplas acil-CoA desidrogenase .
Função
ETQ-QO liga a oxidação de ácidos graxos e alguns aminoácidos à fosforilação oxidativa na mitocôndria. Especificamente, catalisa a transferência de elétrons da flavoproteína de transferência de elétrons (ETF) para a ubiquinona, reduzindo-a a ubiquinol. Toda a sequência de reações de transferência é a seguinte:
Acil-CoA → Acil-CoA desidrogenase → ETF → ETF-QO → UQ → Complexo III .
Reação catalisada
A reação geral catalisada por ETF-QO é a seguinte:
ETF-QO (vermelho) + ubiquinona ↔ ETF-QO (ox) + ubiquinol
A atividade enzimática é geralmente avaliada espectrofotometricamente por reação com octanoil-CoA como doador de elétrons e ubiquinona-1 como aceitador de elétrons. A enzima também pode ser testada por meio da desproporção de ETF semiquinona. Ambas as reações estão abaixo:
Octanoil-CoA + Q 1 ↔ Q 1 H 2 + Oct-2-enoil-CoA
2 ETF 1- ↔ ETF ox + ETF 2-
Estrutura
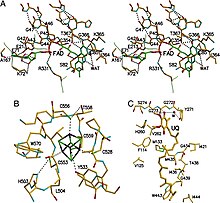
ETF-QO consiste em um domínio estrutural com três domínios funcionais compactados em estreita proximidade: um domínio FAD, um domínio de cluster 4Fe4S e um domínio de ligação UQ. O FAD está em uma conformação estendida e está profundamente enterrado em seu domínio funcional. Múltiplas ligações de hidrogênio e um dipolo helicoidal positivo modulam o potencial redox do FAD e podem, possivelmente, estabilizar o intermediário semiquinona aniônico . O cluster 4Fe4S também é estabilizado por extensas ligações de hidrogênio ao redor do cluster e seus componentes de cisteína . A ligação da ubiquinona é obtida por meio de uma bolsa de ligação hidrofóbica profunda que é um modo diferente do que outras proteínas de ligação UQ, como succinato-Q oxidoredutase . Embora ETF-QO seja uma proteína de membrana integral, ela não atravessa toda a membrana, ao contrário de outras proteínas de ligação UQ.
Mecanismo
O mecanismo exato para a redução é desconhecido, embora existam duas hipóteses de caminhos. A primeira via é a transferência de elétrons de um ETF reduzido de elétrons, um de cada vez, para o centro FAD de potencial inferior. Um elétron é transferido do FAD reduzido para o aglomerado de ferro, resultando em um estado reduzido de dois elétrons com um elétron cada no FAD e domínios do aglomerado. Em seguida, a ubiquinona ligada é reduzida a ubiquinol, pelo menos temporariamente formando a semiubiquinona reduzida isoladamente. A segunda via envolve a doação de elétrons do ETF para o aglomerado de ferro, seguida por transições internas entre os dois centros de elétrons. Após o equilíbrio, o resto do caminho segue como acima.
Significado clínico
A deficiência de ETF-QO resulta em um distúrbio conhecido como acidemia glutárica tipo II (também conhecido como MADD para deficiência múltipla de acil-CoA desidrogenase), em que há um acúmulo impróprio de gorduras e proteínas no corpo. As complicações podem envolver acidose ou hipoglicemia , com outros sintomas, como fraqueza geral, aumento do fígado, insuficiência cardíaca aumentada e deficiência de carnitina . Os casos mais graves envolvem defeitos congênitos e crise metabólica total. Geneticamente, é uma doença autossômica recessiva, tornando sua ocorrência bastante rara. A maioria dos pacientes afetados é o resultado de mutações de ponto único em torno da interface da ubiquinona do FAD. As formas mais brandas do distúrbio respondem à terapia com riboflavina e são denominadas MADD responsivo à riboflavina (RR-MADD), embora devido às mutações variáveis que causam o tratamento da doença e os sintomas possam variar consideravelmente.