Ciclo de cálcio - Calcium cycle
| Parte de uma série sobre |
| Ciclos biogeoquímicos |
|---|
 |
O ciclo do cálcio é uma transferência de cálcio entre as fases dissolvida e sólida . Há um suprimento contínuo de íons de cálcio para os cursos d' água a partir de rochas , organismos e solos . Os íons de cálcio são consumidos e removidos de ambientes aquosos à medida que reagem para formar estruturas insolúveis, como carbonato de cálcio e silicato de cálcio, que podem se depositar para formar sedimentos ou exoesqueletos de organismos. Os íons de cálcio também podem ser utilizados biologicamente , pois o cálcio é essencial para funções biológicas, como a produção de ossos e dentes ou a função celular. O ciclo do cálcio é um fio condutor entre os processos terrestres, marinhos, geológicos e biológicos. O cálcio se move por esses diferentes meios à medida que circula pela Terra. O ciclo do cálcio marinho é afetado pela mudança do dióxido de carbono atmosférico devido à acidificação dos oceanos .
Intemperismo do cálcio e entradas na água do mar
O cálcio é armazenado em reservatórios geológicos, mais comumente na forma de carbonato de cálcio ou silicato de cálcio. Rochas contendo cálcio incluem calcita , dolomita , fosfato e gesso . As rochas se dissolvem lentamente por processos físicos e químicos, transportando íons de cálcio para os rios e oceanos. Os íons de cálcio (Ca 2+ ) e os íons de magnésio (Mg 2+ ) têm a mesma carga (+2) e tamanhos semelhantes, portanto, reagem de forma semelhante e são capazes de se substituir em alguns minerais, como carbonatos . Os minerais contendo Ca 2+ são freqüentemente mais facilmente resistidos do que os minerais Mg 2+ , então o Ca 2+ é frequentemente mais enriquecido em cursos de água do que o Mg 2+ . Rios contendo mais Ca 2+ dissolvido são geralmente considerados mais alcalinos . O cálcio é um dos elementos mais comuns encontrados na água do mar. As entradas de cálcio dissolvido (Ca 2+ ) para o oceano incluem o intemperismo do sulfato de cálcio , silicato de cálcio e carbonato de cálcio, reação basalto-água do mar e dolomitização .
Carbonato de cálcio biogênico e a bomba biológica
O carbonato de cálcio biogênico é formado quando organismos marinhos, como coccolitóforos , corais , pterópodes e outros moluscos, transformam íons de cálcio e bicarbonato em conchas e exoesqueletos de calcita ou aragonita , ambas as formas de carbonato de cálcio. Este é o sumidouro dominante para o cálcio dissolvido no oceano. Os organismos mortos afundam no fundo do oceano, depositando camadas de concha que, com o tempo, se cimentam para formar o calcário . Esta é a origem do calcário marinho e terrestre.
O cálcio precipita em carbonato de cálcio de acordo com a seguinte equação:
Ca 2+ + 2HCO 3 - → CO 2 + H 2 O + CaCO 3
A relação entre o cálcio dissolvido e o carbonato de cálcio é muito afetada pelos níveis de dióxido de carbono (CO 2 ) na atmosfera.
O aumento do dióxido de carbono leva a mais bicarbonato no oceano de acordo com a seguinte equação:
CO 2 + CO 3 2− + H 2 O → 2HCO 3 -
Com a acidificação dos oceanos , as entradas de dióxido de carbono promovem a dissolução do carbonato de cálcio e prejudicam os organismos marinhos dependentes de sua calcita protetora ou conchas de aragonita . A solubilidade do carbonato de cálcio aumenta com a pressão e o dióxido de carbono e diminui com a temperatura. Assim, o carbonato de cálcio é mais solúvel em águas profundas do que em águas superficiais devido à maior pressão e temperatura mais baixa. Como resultado, a precipitação de carbonato de cálcio é mais comum em oceanos mais rasos. A profundidade na qual a taxa de dissolução da calcita é igual à taxa de precipitação da calcita é conhecida como profundidade de compensação da calcita .
Mudanças no clima global e no ciclo do carbono
A acidez do oceano devido ao dióxido de carbono já aumentou 25% desde a revolução industrial. Como as emissões de dióxido de carbono aumentam e se acumulam continuamente, isso afetará negativamente a vida de muitos ecossistemas marinhos. O carbonato de cálcio usado para formar o exoesqueleto de muitos organismos marinhos começará a se decompor, deixando esses animais vulneráveis e incapazes de viver em seus habitats. Em última análise, isso tem um efeito de fluxo sobre os predadores, afetando ainda mais a função de muitas redes alimentares em todo o mundo.
Mudanças nas concentrações de cálcio ao longo do tempo geológico
Isótopos estáveis de cálcio têm sido usados para estudar entradas e saídas de cálcio dissolvido em ambientes marinhos. Por exemplo, um estudo descobriu que os níveis de cálcio diminuíram entre 25 e 50 por cento ao longo de um período de 40 milhões de anos, sugerindo que as saídas de Ca 2+ dissolvido excederam seus insumos. O isótopo Calcium-44 pode ajudar a indicar variações no carbonato de cálcio em longos períodos de tempo e ajudar a explicar as variantes na temperatura global. Declínios no isótopo Cálcio-44 geralmente se correlacionam com períodos de resfriamento, já que a dissolução do carbonato de cálcio normalmente significa uma diminuição na temperatura. Assim, os isótopos de cálcio se correlacionam com o clima da Terra por longos períodos de tempo.
Uso humano / animal de cálcio
Por ser um elemento essencial, o cálcio é obtido por meio de fontes dietéticas, a maioria proveniente de laticínios. Os três mecanismos mais importantes que controlam o uso de cálcio no corpo são a absorção intestinal, a absorção renal e a renovação óssea, que é controlada predominantemente por hormônios e seus receptores correspondentes no intestino, rins e ossos, respectivamente. Isso permite o uso de cálcio em todo o corpo, nomeadamente no crescimento ósseo , sinalização celular , coagulação do sangue, contração muscular e função neuronal .
O cálcio é um dos componentes essenciais do osso, contribuindo para a sua resistência e estrutura, além de ser o principal local de armazenamento dentro do corpo. Dentro dos músculos, seu uso principal é permitir as contrações. As células musculares retiram cálcio do sangue, permitindo que ele se ligue à troponina, um componente da fibra muscular que sinaliza uma contração ao mover a actina e a miosina. Após uma contração, o cálcio se dissipa e os filamentos voltam ao estado de repouso antes da liberação de mais cálcio para a próxima contração. Além disso, o cálcio desempenha um papel significativo ao permitir que os impulsos nervosos sejam transmitidos entre os neurônios. A liberação de íons de cálcio de sinais de canais iônicos voltados para a liberação de neurotransmissores na sinapse. Isso permite a despolarização de um neurônio, transmitindo assim o sinal para o próximo neurônio, onde o processo é mais uma vez repetido. Sem a presença de íons cálcio, a liberação de neurotransmissores não ocorreria, impedindo o envio de sinais e dificultando os processos corporais.
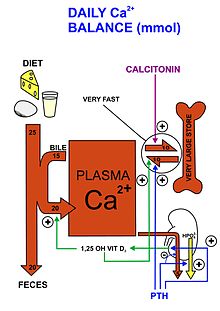
Mecanismos de feedback negativo são implementados para controlar os níveis de cálcio. Quando níveis baixos de cálcio são detectados no corpo, a paratireoide libera o hormônio da paratireoide (PTH), que viaja pela corrente sanguínea até os ossos e rins. Nos ossos, a presença de PTH estimula os osteoclastos. Essas células quebram os ossos para liberar cálcio na corrente sanguínea, onde pode ser usado pelo resto do corpo nos processos acima. Nos rins, o PTH estimula a reabsorção do cálcio para que não seja perdido do corpo pela urina e retorne à corrente sanguínea. Por último, o PTH atua no intestino promovendo indiretamente enzimas que ativam a vitamina D, um sinal para que o intestino absorva mais cálcio, aumentando ainda mais os níveis de cálcio no sangue. Isso continuará até que o corpo libere muito cálcio na corrente sanguínea. O excesso de cálcio, então, promove a liberação de calcitonina da glândula tireoide, revertendo efetivamente o processo de PTH. A atividade dos osteoclastos é interrompida e os osteoblastos assumem o controle, utilizando o excesso de cálcio na corrente sanguínea para formar um novo osso. A reabsorção do cálcio nos rins é evitada, permitindo a excreção do excesso de cálcio pela urina. Por meio desses mecanismos hormonais, a homeostase do cálcio é mantida no corpo.
Cálcio nas plantas e no solo
O cálcio é um componente essencial do solo. Quando depositado na forma de cal, não pode ser aproveitado pelas plantas. Para combater isso, o dióxido de carbono produzido pelas plantas reage com a água do meio ambiente para produzir ácido carbônico. O ácido carbônico é então capaz de dissolver o calcário, permitindo a liberação de íons de cálcio. Esta reação está mais prontamente disponível com partículas menores de calcário do que com grandes pedaços de rocha devido ao aumento da área de superfície. Quando a cal é lixiviada para o solo, os níveis de cálcio inevitavelmente aumentam, estabilizando o pH e permitindo que o cálcio se misture com a água para formar íons Ca 2+ , tornando-o solúvel e acessível às plantas para ser absorvido e utilizado pelo sistema radicular. Os íons de cálcio sobem pelo xilema da planta junto com a água para chegar às folhas. A planta pode utilizar este cálcio na forma de pectato de cálcio para estabilizar as paredes celulares e fornecer rigidez. O cálcio também é usado por enzimas vegetais para sinalizar o crescimento e coordenar os processos de promoção da vida. Além disso, a liberação de íons de cálcio permite que os microrganismos acessem o fósforo e outros micronutrientes com maior facilidade, melhorando o ecossistema do solo drasticamente, promovendo indiretamente o crescimento e a nutrição das plantas.
A morte inevitável de plantas e animais resulta no retorno do cálcio contido no organismo ao solo para ser utilizado por outras plantas. Os organismos em decomposição os decompõem, devolvendo o cálcio ao solo e permitindo que o ciclo do cálcio continue. Além disso, esses animais e plantas são comidos por outros animais, dando continuidade ao ciclo da mesma forma. No entanto, é importante notar que a introdução moderna de cálcio no solo por humanos (por meio de fertilizantes e outros produtos hortícolas) resultou em uma concentração maior de cálcio contido no solo.
Usos industriais do cálcio e seu impacto no ciclo do cálcio
O ciclo natural do cálcio foi alterado pela intervenção humana. O cálcio é extraído predominantemente de depósitos de calcário para ser utilizado por muitos processos industriais. Purificação de minério de ferro e alumínio, substituindo forro de freio de amianto e alguns revestimentos para cabos elétricos. Além disso, o cálcio é usado dentro de casa para manter o pH alcalino de piscinas, neutralizando desinfetantes ácidos e na indústria de produção de alimentos para produzir bicarbonato de sódio, alguns vinhos e massa.
Com seus usos difundidos, um grande volume de cálcio deve ser obtido de minas e pedreiras para suprir a alta demanda. À medida que mais calcário e água são removidos das minas, os depósitos subterrâneos de rocha são freqüentemente enfraquecidos, tornando o solo mais suscetível a buracos. Poços e mineração afetam a presença de água subterrânea, potencialmente levando a um lençol freático mais baixo ou caminhos alterados de água corrente. Isso pode afetar os ecossistemas locais ou terras agrícolas, pois o abastecimento de água é restrito. Além disso, a água que é liberada das áreas de mineração terá maiores concentrações de cálcio dissolvido. Isso pode ser liberado nos oceanos ou absorvido pelo solo. Embora nem sempre seja prejudicial, ele altera o ciclo natural do cálcio, que pode ter efeitos de fluxo para os ecossistemas. Além disso, a água bombeada das minas aumenta o perigo de inundações a jusante, ao mesmo tempo que diminui o volume de água em reservatórios a montante, como pântanos, lagoas de pântanos. No entanto, é importante notar que a mineração de calcário é comparativamente menos prejudicial do que outro processo de mineração, com potencial para restaurar o meio ambiente depois que a mina não estiver mais em uso
A importância do ciclo do cálcio e as previsões futuras
O ciclo do cálcio liga o cálcio iônico e não iônico em ambientes marinhos e terrestres e é essencial para o funcionamento de todos os organismos vivos. Em animais, o cálcio permite que os neurônios transmitam sinais abrindo canais de voltagem que permitem que os neurotransmissores alcancem a próxima célula, formação e desenvolvimento ósseo e função renal, enquanto são mantidos por hormônios que garantem que a homeostase do cálcio seja alcançada. Nas plantas, o cálcio promove a atividade enzimática e garante a função da parede celular, proporcionando estabilidade às plantas. Também permite que os crustáceos formem conchas e a existência de corais, visto que o cálcio fornece estrutura, rigidez e força às estruturas quando complexado (combinado) a outros átomos. Sem sua presença no meio ambiente, muitos processos de preservação da vida não existiriam. No contexto moderno, o cálcio também permite que muitos processos industriais ocorram, promovendo novos desenvolvimentos tecnológicos.
Com sua estreita relação com o ciclo do carbono e os efeitos dos gases de efeito estufa, prevê-se que os ciclos do cálcio e do carbono mudem nos próximos anos. O rastreamento de isótopos de cálcio permite a previsão de mudanças ambientais, com muitas fontes sugerindo o aumento das temperaturas na atmosfera e no ambiente marinho. Como resultado, isso irá alterar drasticamente a decomposição das rochas, o pH dos oceanos e dos cursos d'água e, portanto, a sedimentação do cálcio, abrigando uma série de implicações no ciclo do cálcio.
Devido às complexas interações do cálcio com muitas facetas da vida, é improvável que os efeitos das condições ambientais alteradas sejam conhecidos até que ocorram. As previsões podem, no entanto, ser feitas provisoriamente, com base em pesquisas baseadas em evidências. O aumento dos níveis de dióxido de carbono e a diminuição do pH do oceano irão alterar a solubilidade do cálcio, evitando que os corais e organismos com casca desenvolvam seus exoesqueletos baseados em cálcio, tornando-os vulneráveis ou incapazes de sobreviver.