Alótropos de ferro - Allotropes of iron


À pressão atmosférica , existem três formas alotrópicas de ferro : ferro alfa (α-Fe), ferro gama (γ-Fe) e ferro delta (δ-Fe). Em pressão muito alta, existe uma quarta forma, chamada ferro épsilon (ε-Fe) . Algumas evidências experimentais controversas sugerem a existência de uma quinta forma de alta pressão que é estável em pressões e temperaturas muito altas.
As fases do ferro à pressão atmosférica são importantes devido às diferenças na solubilidade do carbono , formando diferentes tipos de aço . As fases de alta pressão do ferro são importantes como modelos para as partes sólidas dos núcleos planetários. O núcleo interno da Terra é geralmente assumido como consistindo essencialmente de uma liga cristalina de ferro- níquel com estrutura ε. Acredita-se que o núcleo externo que circunda o núcleo interno sólido seja composto de ferro líquido misturado com níquel e vestígios de elementos mais leves.
Alótropos de pressão padrão
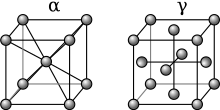
Ferro alfa (α-Fe)
Abaixo de 912 ° C (1.674 ° F), o ferro tem uma estrutura cristalina cúbica centrada no corpo (bcc) e é conhecido como ferro α ou ferrita . É termodinamicamente estável e um metal bastante macio. α-Fe pode ser submetido a pressões de até ca. 15 GPa antes de se transformar em uma forma de alta pressão denominada ε-Fe discutida abaixo.
Magneticamente, o ferro α é paramagnético em altas temperaturas. Porém, abaixo de sua temperatura de Curie (T C ou A 2 ) de 771 ° C (1044 K ou 1420 ° F), ele se torna ferromagnético . No passado, a forma paramagnética do ferro α era conhecida como ferro beta (β-Fe). Mesmo que a leve distorção tetragonal no estado ferromagnético constitua uma verdadeira transição de fase, a natureza contínua dessa transição resulta em apenas uma importância menor no tratamento térmico do aço . O A 2 forma a fronteira entre os campos de ferro beta e alfa no diagrama de fase da Figura 1.
Da mesma forma, A 2 tem apenas uma importância menor em comparação com as temperaturas críticas A 1 ( eutetóide ), A 3 e A cm . O A cm , onde a austenita está em equilíbrio com cementita + γ-Fe, está além da borda direita na Fig. 1. O campo de fase α + γ é, tecnicamente, o campo β + γ acima de A 2 . A designação beta mantém a continuidade da progressão da letra grega de fases em ferro e aço: α-Fe, β-Fe, austenita (γ-Fe), δ-Fe de alta temperatura e hexaferro de alta pressão (ε-Fe) .
A fase primária do aço de baixo carbono ou aço doce e da maioria dos ferros fundidos em temperatura ambiente é o α-Fe ferromagnético . Possui uma dureza de aproximadamente 80 Brinell . A solubilidade máxima é de cerca de 0,02% em peso a 727 ° C (1.341 ° F) e 0,001% de carbono a 0 ° C (32 ° F). Quando se dissolve em ferro, os átomos de carbono ocupam "buracos" intersticiais. Com cerca de duas vezes o diâmetro do buraco tetraédrico , o carbono introduz um forte campo de deformação local.
O aço macio ( aço carbono com até cerca de 0,2% em peso C) consiste principalmente em α-Fe e quantidades crescentes de cementita (Fe 3 C, um carboneto de ferro). A mistura adota uma estrutura laminar chamada perlita . Uma vez que a bainita e a perlita contêm α-Fe como componente, qualquer liga de ferro-carbono conterá alguma quantidade de α-Fe se atingir o equilíbrio à temperatura ambiente. A quantidade de α-Fe depende do processo de resfriamento.
A 2 temperatura crítica e aquecimento por indução
O β-Fe e a temperatura crítica A 2 são importantes no aquecimento por indução do aço, como para tratamentos térmicos de endurecimento superficial. O aço é tipicamente austenitizado a 900-1000 ° C antes de ser temperado e revenido . O campo magnético alternado de alta frequência de aquecimento por indução aquece o aço por dois mecanismos abaixo da temperatura de Curie: aquecimento por resistência ou Joule (I 2 R) e perdas por histerese ferromagnética . Acima da Um 2 , o mecanismo de histerese desaparece e a quantidade necessária de energia por cada grau de aumento de temperatura é substancialmente maior do que abaixo Um 2 . Os circuitos de correspondência de carga podem ser necessários para variar a impedância na fonte de energia de indução para compensar a mudança.
Ferro gama (γ-Fe)
Ao aquecer o ferro acima de 912 ° C (1.674 ° F), sua estrutura cristalina muda para uma estrutura cristalina cúbica centrada na face (fcc). Nessa forma, é chamado de ferro gama (γ-Fe) ou austenita . O ferro γ pode dissolver consideravelmente mais carbono (até 2,04% em massa a 1.146 ° C). Esta forma γ de saturação de carbono é exibida no aço inoxidável .
Ferro delta (δ-Fe)
Curiosamente, acima de 1.394 ° C (2.541 ° F) o ferro volta para a estrutura bcc, conhecida como δ-Fe. O δ-ferro pode dissolver até 0,08% do carbono em massa a 1.475 ° C. É estável até seu ponto de fusão de 1.538 ° C (2.800 ° F).
Alótropos de alta pressão
Ferro épsilon / Hexaferrum (ε-Fe)
Em pressões acima de aproximadamente 10 GPa e temperaturas de algumas centenas de kelvin ou menos, o ferro α muda para uma estrutura hexagonal compactada (hcp), que também é conhecida como ferro ε ou hexaferrum; a fase γ de alta temperatura também muda para ferro ε, mas o faz a uma pressão mais alta. Antiferromagnetismo em ligas de épsilon-Fe com Mn, Os e Ru tem sido observado.
Alta temperatura e pressão experimental
Uma forma estável alternativa, se existir, pode aparecer a pressões de pelo menos 50 GPa e temperaturas de pelo menos 1.500 K; pensa-se que tem uma estrutura ortorrômbica ou dupla hcp. em dezembro de 2011, experimentos recentes e em andamento estão sendo conduzidos em alótropos de carbono superdenso e de alta pressão .
Transições de fase
Pontos de fusão e ebulição
O ponto de fusão do ferro é experimentalmente bem definido para pressões menores que 50 GPa.
Para pressões maiores, dados publicados (a partir de 2007) colocam o ponto triplo γ-ε-líquido em pressões que diferem por dezenas de gigapascais e 1000 K no ponto de fusão. De modo geral, as simulações de computador de dinâmica molecular de derretimento de ferro e experimentos de ondas de choque sugerem pontos de fusão mais altos e uma inclinação muito mais acentuada da curva de fusão do que experimentos estáticos realizados em células de bigorna de diamante .
Os pontos de fusão e ebulição do ferro, juntamente com sua entalpia de atomização , são mais baixos do que os dos elementos 3d do grupo anterior de escândio a cromo , mostrando a contribuição diminuída dos elétrons 3d para ligações metálicas à medida que são atraídos mais e mais para o núcleo inerte pelo núcleo; no entanto, eles são mais altos do que os valores do elemento manganês anterior porque esse elemento tem uma subcamada 3d preenchida pela metade e, conseqüentemente, seus elétrons-d não são facilmente deslocalizados. Essa mesma tendência aparece para o rutênio, mas não para o ósmio.
Transições de fase estrutural
As temperaturas exatas nas quais o ferro fará a transição de uma estrutura de cristal para outra depende de quanto e de que tipo de outros elementos estão dissolvidos no ferro. O limite de fase entre as diferentes fases sólidas é desenhado em um diagrama de fase binário , geralmente representado como temperatura versus porcentagem de ferro. Adicionar alguns elementos, como cromo , reduz a faixa de temperatura da fase gama, enquanto outros aumentam a faixa de temperatura da fase gama. Em elementos que reduzem o intervalo da fase gama, o limite da fase alfa-gama se conecta com o limite da fase gama-delta, formando o que normalmente é chamado de loop Gama . Adicionar aditivos de loop gama mantém o ferro em uma estrutura cúbica centrada no corpo e evita que o aço sofra transição de fase para outros estados sólidos.