Cloreto de urânio (III) - Uranium(III) chloride
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Cloreto de urânio (III)
|
|
| Outros nomes
Cloreto de
urânio Tricloreto de urânio Cloreto hipouranoso |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Cl 3 U | |
| Massa molar | 344,38 g · mol −1 |
| Aparência | Sólido cristalino verde |
| Densidade | 5.500 g / cm 3 , líquido |
| Ponto de fusão | 837 ° C (1.539 ° F; 1.110 K) |
| Ponto de ebulição | 1.657 ° C (3.015 ° F; 1.930 K) |
| Solúvel | |
| Estrutura | |
| Hibridização | Tricapped trigonal prismático |
| Perigos | |
| Ponto de inflamação | Não inflamável |
| Não inflamável | |
| Compostos relacionados | |
|
Compostos relacionados
|
Cloreto de urânio (IV) , cloreto de urânio (V) , cloreto de urânio (VI) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O cloreto de urânio (III) , UCl 3 , é um composto químico que contém o urânio e o cloro do metal da terra . O UCl 3 é usado principalmente para reprocessar o combustível nuclear usado. O cloreto de urânio (III) é sintetizado de várias maneiras a partir do cloreto de urânio (IV) ; entretanto, o UCl 3 é menos estável do que o UCl 4 .
Preparação
Existem duas maneiras de sintetizar cloreto de urânio (III). Os processos a seguir descrevem como produzir cloreto de urânio (III).
(1) Em uma mistura de NaCl-KCl a 670–710 ° C, adicione tetracloreto de urânio com urânio metálico.
(2) Aqueça o cloreto de urânio (IV) em gás hidrogênio.
Propriedades
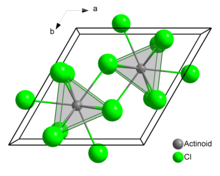
No cloreto de urânio (III) sólido, cada átomo de urânio tem nove átomos de cloro próximos, aproximadamente à mesma distância, em uma configuração prismática trigonal tripla.
O cloreto de urânio (III) é um sólido cristalino verde à temperatura ambiente. UCl 3 funde a 837 ° C e ferve a 1657 ° C. O cloreto de urânio (III) tem uma densidade de 5500 kg / m 3 ou 5,500 g / cm 3 .
Sua composição por peso:
- Cloro: 30,84%
- Urânio: 69,16%
Seus estados oxidativos formais:
- Cloro: -1
- Urânio: +3
O cloreto de urânio (III) é muito solúvel em água e também muito higroscópico . O UCl 3 é mais estável em solução de ácido clorídrico .
Usos
Reagente
O cloreto de urânio (III) é usado em reações com tetra - hidrofurano (THF) e metilciclopentadieno de sódio para preparar vários complexos de metaloceno de urânio .
Catalisador
O cloreto de urânio (III) é usado como catalisador durante as reações entre o hidreto de alumínio e lítio (LiAlH 4 ) e as olefinas para produzir compostos de alquil aluminato.
Forma fundida
A forma fundida do cloreto de urânio (III) é um composto típico em processos piroquímicos, pois é importante no reprocessamento de combustíveis nucleares usados. UCl 3 é geralmente a forma que o urânio assume como combustível irradiado em processos de eletrorrefinação.
Hidratos
Existem três hidratos de cloreto de urânio (III):
- UCl 3 . 2H 2 O . 2CH 3 CN
- UCl 3 . 6H 2 O
- UCl 3 . 7H 2 O
Cada um é sintetizado pela redução do cloreto de urânio (IV) em metilcianeto ( acetonitrila ), com quantidades específicas de água e ácido propiônico .
Precauções
Embora não haja dados de longo prazo sobre os efeitos tóxicos do UCl 3 , é importante minimizar a exposição a este composto quando possível.
Semelhante a outros compostos de urânio que são solúveis, o UCl 3 é provavelmente absorvido pelo sangue através das bolsas alveolares dos pulmões alguns dias após a exposição. A exposição ao cloreto de urânio (III) leva à toxicidade do sistema renal .
Referências
- ^ Serrano, K .; Taxil, P .; Dugne, O .; Bouvet, S .; Puech, EJ Nucl. Mater. 2000, 282, 137–145.
- ^ Remsen, Ira. Química Inorgânica. Nova York: Henry Holt and Company, 1890.
- ^ Wells AF (1984) Structural Inorganic Chemistry 5ª edição Oxford Science Publications ISBN 0-19-855370-6
- ^ Comey, Arthur M .; Hahn, Dorothy A. A Dictionary of Chemical Solubilities: Inorganic. Nova York: The MacMillan Company, 1921.
- ^ Brenna, JG; Anderson, RA; Zalkin, A. Inorg. Chem. 1986, 25, 1756-1760.
- ^ Le Marechal, JF; Ephritikine, M .; Folcher, GJ Organomet. Chem. 1986, 309, C1 – C3.
- ^ a b Okamoto, Y .; Madden, P .; Minato, KJ Nucl. Mater. 2005, 344, 109-114.
- ^ Okamoto, Y .; Kobayashi, F .; Ogawa, TJ Alloys Compd. 1998, 271, 355-358.
- ^ Mech, A .; Karbowick, M .; Lis, T. Polyhedron. 2006, 25, 2083–2092.
- ^ Bertell, Rosalie. "Veteranos da Guerra do Golfo e urânio empobrecido." Maio de 1999. Disponível: http://ccnr.org/du_hague.html
links externos
- Informações de cloreto de urânio (III) em Webelements
- Cloreto de urânio (III) International Bio-Analytical Industries, Inc.
- Urânio empobrecido: todas as perguntas sobre o DU e a Síndrome da Guerra do Golfo ainda não foram respondidas
