Ununennium - Ununennium
| Ununennium | ||||||
|---|---|---|---|---|---|---|
| Pronúncia |
/ ˌ uː n . u n ɛ n i ə m / ( escutar ) |
|||||
| Nomes alternativos | elemento 119, eka-frâncio | |||||
| Ununênio na tabela periódica | ||||||
| ||||||
| Número atômico ( Z ) | 119 | |||||
| Grupo | grupo 1: hidrogênio e metais alcalinos | |||||
| Período | período 8 | |||||
| Bloquear | bloco s | |||||
| Configuração de elétron | [ Og ] 8s 1 (previsto) | |||||
| Elétrons por camada | 2, 8, 18, 32, 32, 18, 8, 1 (previsto) | |||||
| Propriedades físicas | ||||||
| Fase em STP | desconhecido (pode ser sólido ou líquido) | |||||
| Ponto de fusão | 273–303 K (0–30 ° C, 32–86 ° F) (previsto) | |||||
| Ponto de ebulição | 903 K (630 ° C, 1166 ° F) (previsto) | |||||
| Densidade (próximo à rt ) | 3 g / cm 3 (previsto) | |||||
| Calor de fusão | 2,01–2,05 kJ / mol (extrapolado) | |||||
| Propriedades atômicas | ||||||
| Estados de oxidação | ( +1 ), (+3) (previsto) | |||||
| Eletro-negatividade | Escala de Pauling: 0,86 (previsto) | |||||
| Energias de ionização | ||||||
| Raio atômico | empírico: 240 pm (previsto) | |||||
| Raio covalente | 263-281 pm (extrapolado) | |||||
| Outras propriedades | ||||||
| Estrutura de cristal | cúbica de corpo centrado (BCC)
(extrapolado) |
|||||
| Número CAS | 54846-86-5 | |||||
| História | ||||||
| Nomeação | Nome do elemento sistemático IUPAC | |||||
Ununennium , também conhecido como eka-frâncio ou elemento 119 , é o elemento químico hipotético com o símbolo Uue e número atômico 119. Ununennium e Uue são o nome e o símbolo sistemáticos temporários IUPAC respectivamente, que são usados até que o elemento seja descoberto, confirmado e um nome permanente é decidido. Na tabela periódica dos elementos, espera-se que seja um elemento de bloco s , um metal alcalino e o primeiro elemento do oitavo período . É o elemento mais leve que ainda não foi sintetizado.
Tentativas malsucedidas de sintetizar o elemento estão em andamento na RIKEN (Japão) e no Joint Institute for Nuclear Research ( Dubna , Rússia). Evidências teóricas e experimentais mostraram que a síntese do ununênio provavelmente será muito mais difícil do que a dos elementos anteriores, e pode até ser o penúltimo elemento que pode ser sintetizado com a tecnologia atual.
A posição do Ununennium como o sétimo metal alcalino sugere que ele teria propriedades semelhantes às de seus congêneres mais leves . No entanto, os efeitos relativísticos podem fazer com que algumas de suas propriedades sejam diferentes daquelas esperadas de uma aplicação direta de tendências periódicas . Por exemplo, espera-se que o ununênio seja menos reativo do que o césio e o frâncio e tenha um comportamento mais próximo do potássio ou do rubídio e, embora deva mostrar o estado de oxidação +1 característico dos metais alcalinos, também se prevê que mostre o +3 estado de oxidação, que é desconhecido em qualquer outro metal alcalino.
Introdução

| Vídeo externo | |
|---|---|
|
|
Os núcleos atômicos mais pesados são criados em reações nucleares que combinam dois outros núcleos de tamanhos desiguais em um; grosso modo, quanto mais desiguais os dois núcleos em termos de massa, maior a possibilidade de os dois reagirem. O material formado pelos núcleos mais pesados é transformado em alvo, que é então bombardeado pelo feixe de núcleos mais leves. Dois núcleos só podem se fundir em um se se aproximarem um do outro; normalmente, os núcleos (todos carregados positivamente) se repelem devido à repulsão eletrostática . A interação forte pode superar essa repulsão, mas apenas dentro de uma distância muito curta de um núcleo; os núcleos do feixe são, portanto, grandemente acelerados a fim de tornar essa repulsão insignificante em comparação com a velocidade do núcleo do feixe. Chegar perto sozinho não é suficiente para dois núcleos se fundirem: quando dois núcleos se aproximam, eles geralmente permanecem juntos por aproximadamente 10-20 segundos e então se separam (não necessariamente na mesma composição de antes da reação) em vez de formar um único núcleo. Se a fusão ocorrer, a fusão temporária - denominada núcleo composto - é um estado excitado . Para perder sua energia de excitação e atingir um estado mais estável, um núcleo composto fissiona ou ejeta um ou vários nêutrons , que carregam a energia. Isso ocorre em aproximadamente 10 a 16 segundos após a colisão inicial.
O feixe passa pelo alvo e atinge a próxima câmara, o separador; se um novo núcleo é produzido, ele é carregado com este feixe. No separador, o núcleo recém-produzido é separado de outros nuclídeos (o do feixe original e quaisquer outros produtos de reação) e transferido para um detector de barreira de superfície , que pára o núcleo. A localização exata do próximo impacto no detector é marcada; também marcados são sua energia e o tempo da chegada. A transferência leva cerca de 10 −6 segundos; para ser detectado, o núcleo deve sobreviver por tanto tempo. O núcleo é registrado novamente assim que sua decadência é registrada, e a localização, a energia e o tempo de decadência são medidos.
A estabilidade de um núcleo é fornecida pela interação forte. No entanto, seu alcance é muito curto; à medida que os núcleos se tornam maiores, sua influência sobre os núcleos mais externos ( prótons e nêutrons) enfraquece. Ao mesmo tempo, o núcleo é dilacerado pela repulsão eletrostática entre prótons, pois tem alcance ilimitado. Os núcleos dos elementos mais pesados são, portanto, teoricamente previstos e, até agora, observou-se que decaem principalmente por meio de modos de decaimento que são causados por tal repulsão: decadência alfa e fissão espontânea ; esses modos são predominantes para núcleos de elementos superpesados . Os decaimentos alfa são registrados pelas partículas alfa emitidas e os produtos do decaimento são fáceis de determinar antes do decaimento real; se tal decaimento ou uma série de decaimentos consecutivos produz um núcleo conhecido, o produto original de uma reação pode ser determinado aritmeticamente. A fissão espontânea, entretanto, produz vários núcleos como produtos, de modo que o nuclídeo original não pode ser determinado a partir de suas filhas.
A informação à disposição dos físicos com o objetivo de sintetizar um dos elementos mais pesados são, portanto, as informações coletadas nos detectores: localização, energia e tempo de chegada de uma partícula ao detector e de seu decaimento. Os físicos analisam esses dados e procuram concluir que ele foi de fato causado por um novo elemento e não poderia ter sido causado por um nuclídeo diferente do alegado. Freqüentemente, os dados fornecidos são insuficientes para concluir que um novo elemento foi definitivamente criado e não há outra explicação para os efeitos observados; erros na interpretação dos dados foram cometidos.
História
Elementos superpesados são produzidos por fusão nuclear . Essas reações de fusão podem ser divididas em fusão "quente" e "fria", dependendo da energia de excitação do núcleo composto produzido. Em reações de fusão a quente, projéteis muito leves e de alta energia são acelerados em direção a alvos muito pesados ( actinídeos ), dando origem a núcleos compostos em alta energia de excitação (~ 40-50 MeV ) que podem fissão ou, alternativamente, evaporar vários (3 a 5 ) nêutrons. Em reações de fusão a frio (que usam projéteis mais pesados, normalmente do quarto período , e alvos mais leves, geralmente chumbo e bismuto ), os núcleos fundidos produzidos têm uma energia de excitação relativamente baixa (~ 10-20 MeV), o que diminui a probabilidade de que estes produtos sofrerão reações de fissão. À medida que os núcleos fundidos se resfriam ao estado fundamental , eles exigem a emissão de apenas um ou dois nêutrons. No entanto, as reações de fusão a quente tendem a produzir produtos mais ricos em nêutrons porque os actinídeos têm as maiores proporções nêutron-próton de todos os elementos que podem ser produzidos atualmente em quantidades macroscópicas.
Ununennium e unbinilium (elementos 119 e 120) são os elementos com os números atômicos mais baixos que ainda não foram sintetizados. As tentativas de sintetizá-los iriam ultrapassar os limites da tecnologia atual, devido às seções transversais decrescentes das reações de produção e suas provavelmente curtas meias-vidas , que devem ser da ordem de microssegundos. Elementos além do unbiunium (elemento 121) provavelmente teriam vida muito curta para serem detectados com a tecnologia atual: eles decairiam em um microssegundo, antes de chegar aos detectores. A possibilidade de detecção dos elementos 121 a 124 depende muito do modelo teórico que está sendo usado, pois suas meias-vidas são previstas como muito próximas da fronteira de um microssegundo. Anteriormente, uma ajuda importante (caracterizada como "balas de prata") na síntese de elementos superpesados veio das conchas nucleares deformadas ao redor do hassium -270 que aumentaram a estabilidade dos núcleos circundantes e a existência do isótopo de cálcio quase estável rico em nêutrons- 48 que poderia ser usado como um projétil para produzir isótopos de elementos superpesados mais ricos em nêutrons. Quanto mais rico em nêutrons for um nuclídeo superpesado , mais próximo se espera que ele esteja da procurada ilha de estabilidade . Mesmo assim, os isótopos sintetizados ainda têm menos nêutrons do que os esperados na ilha de estabilidade. Além disso, o uso de cálcio-48 para sintetizar o ununênio exigiria um alvo de einstênio -253 ou -254, que são muito difíceis de produzir em quantidades suficientemente grandes (apenas microgramas estão atualmente disponíveis; em comparação, miligramas de berquélio e califórnio estão disponíveis). A produção mais prática de outros elementos superpesados exigiria projéteis mais pesados do que 48 Ca.
Tentativas de síntese
Passado
A síntese do ununênio foi tentada pela primeira vez em 1985, bombardeando um alvo de einstênio-254 com íons cálcio-48 no acelerador superHILAC em Berkeley, Califórnia:
-
254
99Es
+ 48
20Ca
→ 302
119Uue
* → sem átomos
Nenhum átomo foi identificado, levando a uma seção transversal limitante de 300 nb . Cálculos posteriores sugerem que a seção transversal da reação 3n (que resultaria em 299 Uue e três nêutrons como produtos) seria na verdade seiscentas mil vezes menor do que esse limite superior, a 0,5 pb.
Como o ununennium é o elemento mais leve ainda não descoberto, ele tem sido alvo de experimentos de síntese por equipes alemãs, russas e japonesas nos últimos anos. A equipe russa do Joint Institute for Nuclear Research em Dubna, Rússia, planejou conduzir um experimento antes de 2012, e nenhum resultado foi divulgado, o que implica fortemente que o experimento não foi realizado ou nenhum átomo do ununênio foi identificado. De abril a setembro de 2012, uma tentativa de sintetizar os isótopos 295 Uue e 296 Uue foi feita bombardeando um alvo de berquélio -249 com titânio -50 no Centro GSI Helmholtz para Pesquisa de Íons Pesados em Darmstadt , Alemanha. Com base na seção transversal teoricamente prevista, esperava-se que um átomo do ununênio fosse sintetizado cinco meses após o início do experimento.
-
249
97Bk
+ 50
22Ti
→ 299
119Uue
* → 296
119Uue
+ 3 1
0
n
-
249
97Bk
+ 50
22Ti
→ 299
119Uue
* → 295
119Uue
+ 4 1
0
n
O experimento foi originalmente planejado para continuar até novembro de 2012, mas foi interrompido cedo para fazer uso do alvo de 249 Bk para confirmar a síntese de tennessina (alterando assim os projéteis para 48 Ca). Esta reação entre 249 Bk e 50 Ti foi prevista como a reação prática mais favorável para a formação do ununênio, já que é bastante assimétrica, embora também um tanto fria. (A reação entre 254 Es e 48 Ca seria superior, mas preparar quantidades em miligramas de 254 Es para um alvo é difícil.) No entanto, a mudança necessária da "bala de prata" 48 Ca para 50 Ti divide o rendimento esperado do ununênio por cerca de vinte, pois o rendimento é fortemente dependente da assimetria da reação de fusão.
Devido às meias-vidas curtas previstas, a equipe GSI usou novos eletrônicos "rápidos", capazes de registrar eventos de decaimento em microssegundos. Nenhum átomo de ununênio foi identificado, implicando em uma seção transversal limitante de 65 fb. A seção transversal real prevista é de cerca de 40 fb, que está no limite da tecnologia atual. (A seção transversal mais baixa recorde de uma reação experimentalmente bem-sucedida é de 30 fb para a reação entre 209 Bi e 70 Zn produzindo niônio .)
Presente
A equipe da RIKEN em Wakō , no Japão, começou a bombardear alvos de cúrio -248 com um feixe de vanádio -51 em junho de 2018 para procurar o elemento 119. O cúrio foi escolhido como alvo, em vez de berquélio ou califórnio mais pesado, pois esses alvos mais pesados são difíceis de preparar. Espera-se que a assimetria reduzida da reação reduza aproximadamente à metade a seção transversal, exigindo uma sensibilidade "da ordem de pelo menos 30 fb". Os alvos de 248 cm foram fornecidos pelo Laboratório Nacional de Oak Ridge , que forneceu o alvo de 249 Bk necessário a partir da síntese de tennessina (elemento 117) em Dubna. O experimento RIKEN começou sendo conduzido em um ciclotron enquanto atualizava seus aceleradores lineares; a atualização foi concluída em 2020. O bombardeio pode ser continuado com ambas as máquinas até que o primeiro evento seja observado; o experimento está sendo executado de forma intermitente por pelo menos 100 dias por ano. Hideto En'yo , diretor do RIKEN Nishina Center, previu que os elementos 119 e 120 provavelmente seriam descobertos em 2022. Os esforços da equipe RIKEN estão sendo financiados pelo Imperador do Japão .
-
248
96Cm
+ 51
23V
→ 299
119Uue
* → 296
119Uue
+ 3 1
0
n
-
248
96Cm
+ 51
23V
→ 299
119Uue
* → 295
119Uue
+ 4 1
0
n
Espera-se que os isótopos produzidos do ununênio sofram dois decaimentos alfa para isótopos conhecidos de moscovium ( 288 Mc e 287 Mc, respectivamente), o que os ancoraria a uma sequência conhecida de cinco decaimentos alfa adicionais e corroborar sua produção. A seção transversal prevista para essas reações é de cerca de 10 fb.
Planejado
Seguindo a síntese reivindicada de 293 Og em 1999 no Laboratório Nacional Lawrence Berkeley de 208 Pb e 86 Kr, as reações análogas 209 Bi + 86 Kr e 208 Pb + 87 Rb foram propostas para a síntese do elemento 119 e seu alfa então desconhecido filhas de decadência , elementos 117 , 115 e 113 . A retração desses resultados em 2001 e cálculos mais recentes sobre as seções transversais para reações de fusão "a frio" lançam dúvidas sobre essa possibilidade; por exemplo, um rendimento máximo de 2 fb é previsto para a produção de 294 Uue na primeira reação. Os feixes de íons radioativos podem fornecer um método alternativo utilizando um alvo de chumbo ou bismuto e podem permitir a produção de mais isótopos ricos em nêutrons, caso eles se tornem disponíveis nas intensidades necessárias.
A equipe do Joint Institute for Nuclear Research em Dubna , Rússia, planejou iniciar novos experimentos na síntese do ununênio usando a reação 249 Bk + 50 Ti usando um novo complexo experimental. Em novembro de 2019, os resultados eram esperados para meados de 2021, no mínimo.
Os laboratórios da RIKEN no Japão e do JINR na Rússia são os mais adequados para esses experimentos, pois são os únicos no mundo onde os longos tempos de feixe são acessíveis para reações com baixas seções transversais previstas.
Nomeação
Usando nomenclatura de Mendeleev para elementos não identificados e não descobertos , ununénnio deve ser conhecido como eka- frâncio . Usando as recomendações da IUPAC de 1979 , o elemento deve ser temporariamente chamado de ununennium (símbolo Uue ) até que seja descoberto, a descoberta seja confirmada e um nome permanente seja escolhido. Embora amplamente utilizadas na comunidade química em todos os níveis, de salas de aula de química a livros avançados, as recomendações são principalmente ignoradas entre os cientistas que trabalham teoricamente ou experimentalmente com elementos superpesados, que o chamam de "elemento 119", com o símbolo E119 , (119) ou 119 .
Propriedades previstas
Estabilidade nuclear e isótopos


A estabilidade dos núcleos diminui muito com o aumento do número atômico após o cúrio , o elemento 96, cuja meia-vida é quatro ordens de magnitude mais longa do que a de qualquer elemento de número superior conhecido atualmente. Todos os isótopos com um número atômico acima de 101 sofrem decaimento radioativo com meia-vida de menos de 30 horas. Nenhum elemento com número atômico acima de 82 (após o chumbo ) possui isótopos estáveis. No entanto, por razões ainda não bem compreendidas, há um ligeiro aumento da estabilidade nuclear em torno dos números atômicos 110 - 114 , o que leva ao surgimento do que é conhecido na física nuclear como a " ilha de estabilidade ". Este conceito, proposto por Universidade da Califórnia professor de Glenn Seaborg , explica por elementos superpesados durar mais tempo do que o previsto.
As meias-vidas de decaimento alfa previstas para 291-307 Uue são da ordem de microssegundos. A meia-vida de decaimento alfa mais longa prevista é de ~ 485 microssegundos para o isótopo 294 Uue. Ao fatorar todos os modos de decaimento, as meias-vidas previstas caem ainda mais para apenas dezenas de microssegundos. Alguns isótopos mais pesados podem ser mais estáveis; Fricke e Waber previram que 315 Uue seria o isótopo ununênio mais estável em 1971. Isso tem consequências para a síntese do ununênio, já que os isótopos com meia-vida abaixo de um microssegundo decaem antes de chegar ao detector, e os isótopos mais pesados não podem ser sintetizados pelo colisão de qualquer alvo utilizável conhecido e núcleos de projéteis. No entanto, novos modelos teóricos mostram que a lacuna esperada em energia entre os orbitais de prótons 2f 7/2 (preenchido no elemento 114) e 2f 5/2 (preenchido no elemento 120) é menor do que o esperado, de modo que o elemento 114 não parece mais ser uma camada nuclear fechada esférica estável, e esta lacuna de energia pode aumentar a estabilidade dos elementos 119 e 120. O próximo núcleo duplamente mágico agora deve estar em torno do 306 Ubb esférico ( elemento 122 ), mas a meia-vida baixa esperada e A seção transversal de baixa produção deste nuclídeo torna sua síntese um desafio.
Atômico e físico
Sendo o primeiro elemento do período 8 , o ununênio é considerado um metal alcalino, ocupando seu lugar na tabela periódica abaixo do lítio , sódio , potássio , rubídio , césio e frâncio . Cada um desses elementos tem um elétron de valência no orbital s mais externo (configuração do elétron de valência n s 1 ), que é facilmente perdido em reações químicas para formar o estado de oxidação +1 : assim, os metais alcalinos são elementos muito reativos . Prevê-se que o Ununennium continue a tendência e tenha uma configuração eletrônica de valência de 8s 1 . Portanto, espera-se que ele se comporte de maneira muito semelhante a seus congêneres mais leves ; no entanto, também se prevê que difira dos metais alcalinos mais leves em algumas propriedades.
A principal razão para as diferenças previstas entre o ununênio e os outros metais alcalinos é a interação spin-órbita (SO) - a interação mútua entre o movimento e o spin dos elétrons . A interação SO é especialmente forte para os elementos superpesados porque seus elétrons se movem mais rápido - em velocidades comparáveis à velocidade da luz - do que aqueles em átomos mais leves. Nos átomos do ununênio, ele reduz os níveis de energia do elétron 7p e 8s, estabilizando os elétrons correspondentes, mas dois dos níveis de energia do elétron 7p são mais estabilizados do que os outros quatro. O efeito é chamado de divisão de subshell, pois divide o subshell 7p em partes mais estabilizadas e menos estabilizadas. Químicos computacionais entendem a divisão como uma mudança do segundo número quântico ( azimutal ) l de 1 para 1/2 e 3/2 para as partes mais estabilizadas e menos estabilizadas da subcamada 7p, respectivamente. Assim, o elétron 8s externo do ununênio é estabilizado e se torna mais difícil de remover do que o esperado, enquanto os elétrons 7p 3/2 são desestabilizados, talvez permitindo que participem de reações químicas. Essa estabilização do orbital s mais externo (já significativo no frâncio) é o fator-chave que afeta a química do ununênio e faz com que todas as tendências das propriedades atômicas e moleculares dos metais alcalinos invertam a direção após o césio.
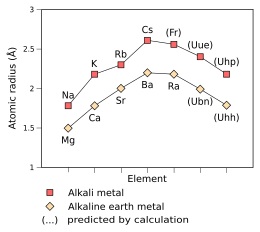
Raios atômicos empíricos (Na – Cs, Mg – Ra) e preditos (Fr – Uhp, Ubn – Uhh) dos metais alcalinos e alcalino-terrosos do terceiro ao nono período , medidos em angstroms
|

Afinidades eletrônicas empíricas (Na – Cs), semi-empíricas (Fr) e preditas (Uue) dos metais alcalinos do terceiro ao oitavo período , medidas em elétron-volts . Eles diminuem de Li para Cs, mas o valor Fr,492 ± 10 meV , é 20 meV mais alto que o de Cs, e o de Uue é muito mais alto ainda em 662 meV.
|
Devido à estabilização de seu elétron 8s externo, a primeira energia de ionização do ununênio - a energia necessária para remover um elétron de um átomo neutro - é estimada em 4,53 eV, mais alta do que a dos metais alcalinos conhecidos do potássio em diante. Este efeito é tão grande que o unbiunium (elemento 121) está previsto para ter uma energia de ionização inferior de 4,45 eV, de modo que o metal alcalino no período 8 não teria a energia de ionização mais baixa no período, como é verdade para todos os períodos anteriores. Espera-se que a afinidade eletrônica do Ununênio seja muito maior do que a do césio e do frâncio; de fato, espera-se que o ununênio tenha uma afinidade eletrônica maior do que todos os metais alcalinos mais leves do que ele em cerca de 0,662 eV, próxima à do cobalto (0,662 eV) e do cromo (0,676 eV). Os efeitos relativísticos também causam uma queda muito grande na polarizabilidade do ununênio para 169,7 au De fato, a polarização dipolo estática (α D ) do ununênio, uma quantidade para a qual os impactos da relatividade são proporcionais ao quadrado do número atômico do elemento, foi calculado para ser pequeno e semelhante ao do sódio.
O elétron do átomo do ununênio semelhante ao hidrogênio - oxidado de forma que tenha apenas um elétron, Uue 118+ - está previsto para se mover tão rapidamente que sua massa é 1,99 vezes a de um elétron imóvel , uma característica proveniente dos efeitos relativísticos . Para comparação, o valor para o frâncio semelhante ao hidrogênio é 1,29 e o valor para o césio semelhante ao hidrogênio é 1,091. Segundo extrapolações simples das leis da relatividade, isso indiretamente indica a contração do raio atômico para cerca de 240 pm , muito próxima à do rubídio (247 pm); o raio metálico também é reduzido correspondentemente para 260 pm. O raio iônico de Uue + é esperado em 180 pm.
Prevê-se que o ununênio tenha um ponto de fusão entre 0 ° C e 30 ° C: portanto, pode ser um líquido à temperatura ambiente. Não se sabe se isso continua a tendência de diminuição dos pontos de fusão ao longo do grupo, já que o ponto de fusão do césio é 28,5 ° C e o do frâncio é estimado em cerca de 8,0 ° C. O ponto de ebulição do ununênio está previsto em cerca de 630 ° C, semelhante ao do frâncio, estimado em cerca de 620 ° C; isto é mais baixo do que o ponto de ebulição do césio de 671 ° C. A densidade do ununênio foi predita variadamente entre 3 e 4 g / cm 3 , continuando a tendência de aumento da densidade no grupo: a densidade do frâncio é estimada em 2,48 g / cm 3 , e a do césio é conhecida como 1,93 g / cm 3 .
Químico
| Composto | Comprimento da ligação (Å) | Energia de dissociação de ligação (kJ / mol) |
|---|---|---|
| Li 2 | 2.673 | 101,9 |
| Na 2 | 3.079 | 72,04 |
| K 2 | 3,924 | 53,25 |
| Rb 2 | 4,210 | 47,77 |
| Cs 2 | 4.648 | 43,66 |
| Fr 2 | ~ 4,61 | ~ 42,1 |
| Uue 2 | ~ 4,27 | ~ 53,4 |
Prevê-se que a química do ununênio seja semelhante à dos metais alcalinos, mas provavelmente se comportaria mais como potássio ou rubídio do que como césio ou frâncio. Isso se deve a efeitos relativísticos, pois em sua ausência as tendências periódicas predizem que o ununênio é ainda mais reativo do que o césio e o frâncio. Esta reatividade reduzida é devido à estabilização relativística do elétron de valência do ununênio, aumentando a primeira energia de ionização do ununênio e diminuindo os raios metálico e iônico ; esse efeito já é visto para o frâncio.
A química do ununênio no estado de oxidação +1 deve ser mais semelhante à química do rubídio do que à do frâncio. Por outro lado, o raio iônico do íon Uue + é previsto para ser maior do que o de Rb + , porque os orbitais 7p são desestabilizados e são, portanto, maiores do que os orbitais p das camadas inferiores. O ununênio também pode mostrar o estado de oxidação +3 , que não é visto em nenhum outro metal alcalino, além do estado de oxidação +1 que é característico dos outros metais alcalinos e também é o principal estado de oxidação de todos os metais alcalinos conhecidos: isso ocorre por causa da desestabilização e expansão do spinor 7p 3/2 , fazendo com que seus elétrons mais externos tenham uma energia de ionização mais baixa do que o esperado. Espera-se que muitos compostos do ununênio tenham um grande caráter covalente , devido ao envolvimento dos elétrons 7p 3/2 na ligação: este efeito também é visto em menor extensão no frâncio, que mostra uma contribuição de 6p 3/2 para a ligação em superóxido de frâncio (FrO 2 ). Assim, em vez de ununénnio sendo o mais electropositivo elemento, como um simples extrapolação pareceria indicar, em vez de césio mantém esta posição, com ununénnio de electronegatividade mais provável de estar perto de sódio 's (0,93 na escala de Pauling). O potencial de redução padrão do par Uue + / Uue é previsto em -2,9 V, o mesmo que o do par Fr + / Fr e um pouco acima daquele do par K + / K a -2,931 V.
Comprimentos de ligação e energias de dissociação de ligação de MAu (M = um metal alcalino). Todos os dados são previstos, exceto para as energias de dissociação de ligação de KAu, RbAu e CsAu. Composto Comprimento da ligação (Å) Energia de dissociação de ligação (kJ / mol) KAu 2.856 2,75 RbAu 2.967 2,48 CsAu 3.050 2,53 FrAu 3.097 2,75 UueAu 3.074 2,44
Na fase gasosa, e em temperaturas muito baixas na fase condensada, os metais alcalinos formam moléculas diatômicas covalentemente ligadas. Os comprimentos das ligações metal-metal nessas moléculas M 2 aumentam no grupo de Li 2 a Cs 2 , mas depois diminuem até Uue 2 , devido aos efeitos relativísticos mencionados acima que estabilizam o orbital 8s. A tendência oposta é mostrada para as energias de dissociação de ligação metal-metal . A ligação Uue – Uue deve ser ligeiramente mais forte do que a ligação K – K. A partir destas H 2 energias de dissociação, a entalpia de sublimação (Δ H sub ) de ununénnio é predito para ser 94 kJ / mol (o valor para o frâncio deve ser cerca de 77 kJ / mol).
Espera-se que a molécula UueF tenha um caráter covalente significativo devido à alta afinidade eletrônica do ununênio. A ligação em UueF é predominantemente entre um orbital 7p no ununênio e um orbital 2p no flúor, com contribuições menores do orbital 2s do flúor e do 8s, 6d z 2 e os outros dois orbitais 7p do ununênio. Isso é muito diferente do comportamento dos elementos do bloco s, bem como do ouro e do mercúrio , nos quais os orbitais s (às vezes misturados com os orbitais d) são os que participam da ligação. A ligação Uue-F é relativisticamente expandida devido à divisão do orbital 7p em espinores 7p 1/2 e 7p 3/2 , forçando os elétrons de ligação no maior orbital medido pela extensão radial: uma expansão semelhante no comprimento da ligação é encontrada em os hidretos em H e TsH. A ligação Uue-Au deve ser a mais fraca de todas as ligações entre o ouro e um metal alcalino, mas ainda deve ser estável. Isso dá entalpias de adsorção extrapoladas de tamanho médio (−Δ H ads ) de 106 kJ / mol em ouro (o valor do frâncio deve ser 136 kJ / mol), 76 kJ / mol em platina e 63 kJ / mol em prata , o menor de todos os metais alcalinos, que demonstram que seria viável estudar a adsorção cromatográfica do ununênio em superfícies feitas de metais nobres . A entalpia de adsorção do ununênio em uma superfície de Teflon é estimada em 17,6 kJ / mol, que seria a mais baixa entre os metais alcalinos: esta informação seria muito útil para futuros experimentos químicos no ununênio. Os valores de Δ H sub e −Δ H ads não estão proporcionalmente relacionados para os metais alcalinos, pois eles mudam em direções opostas com o aumento do número atômico.
Veja também
Notas
Referências
Bibliografia
- Audi, G .; Kondev, FG; Wang, M .; Huang, WJ; Naimi, S. (2017). "A avaliação NUBASE2016 das propriedades nucleares" (PDF) . Chinese Física C . 41 (3): 030001. bibcode : 2017ChPhC..41c0001A . doi : 10.1088 / 1674-1137 / 41/3/030001 .
- Beiser, A. (2003). Conceitos de física moderna (6ª ed.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418 .
- Hoffman, DC ; Ghiorso, A .; Seaborg, GT (2000). The Transuranium People: The Inside Story . World Scientific . ISBN 978-1-78-326244-1.
- Kragh, H. (2018). De elementos transurânicos a superpesados: uma história de disputa e criação . Springer . ISBN 978-3-319-75813-8.
- Zagrebaev, V .; Karpov, A .; Greiner, W. (2013). "Futuro da pesquisa com elementos superpesados: quais núcleos podem ser sintetizados nos próximos anos?". Journal of Physics: Conference Series . 420 (1). 012001. arXiv : 1207.5700 . Bibcode : 2013JPhCS.420a2001Z . doi : 10.1088 / 1742-6596 / 420/1/012001 . ISSN 1742-6588 . S2CID 55434734 .
links externos
-
 A definição de ununênio no dicionário do Wikcionário
A definição de ununênio no dicionário do Wikcionário


