Unbiunium - Unbiunium
| Unbiunium | ||||||
|---|---|---|---|---|---|---|
| Pronúncia |
/ ˌ u n b aɪ u n i ə m / ( OON -by- OON -ee-əm ) |
|||||
| Nomes alternativos | elemento 121, eka-actínio | |||||
| Unbiunium na tabela periódica | ||||||
| ||||||
| Número atômico ( Z ) | 121 | |||||
| Grupo | grupo n / a | |||||
| Período | período 8 | |||||
| Bloquear | bloco g | |||||
| Configuração de elétron | [ Og ] 8s 2 8p 1 (previsto) | |||||
| Elétrons por camada | 2, 8, 18, 32, 32, 18, 8, 3 (previsto) |
|||||
| Propriedades físicas | ||||||
| desconhecido | ||||||
| Fase em STP | desconhecido | |||||
| Propriedades atômicas | ||||||
| Estados de oxidação | (+1), ( +3 ) (previsto) | |||||
| Energias de ionização | ||||||
| Outras propriedades | ||||||
| Número CAS | 54500-70-8 | |||||
| História | ||||||
| Nomeação | Nome do elemento sistemático IUPAC | |||||
Unbiunium , também conhecido como eka-actinium ou simplesmente elemento 121 , é o elemento químico hipotético com o símbolo Ubu e número atômico 121. Unbiunium e Ubu são o nome e o símbolo sistemáticos temporários da IUPAC respectivamente, que são usados até que o elemento seja descoberto, confirmado, e um nome permanente é decidido. Na tabela periódica dos elementos, espera-se que seja o primeiro dos superactinídeos e o terceiro elemento no oitavo período . Ele chamou a atenção por causa de algumas previsões de que pode estar na ilha de estabilidade , embora cálculos mais recentes prevejam que a ilha ocorra com um número atômico ligeiramente menor, mais próximo de copernicium e flerovium . Também é provável que seja o primeiro de um novo bloco g de elementos.
O unbiunium ainda não foi sintetizado. Espera-se que seja um dos últimos elementos alcançáveis com a tecnologia atual; o limite pode estar em qualquer lugar entre o elemento 120 e 124 . Também será provavelmente muito mais difícil de sintetizar do que os elementos conhecidos até agora até 118, e ainda mais difícil do que os elementos 119 e 120. A equipe da RIKEN no Japão tem planos de tentar a síntese do elemento 121 no futuro depois disso tenta os elementos 119 e 120.
A posição do unbiunium na tabela periódica sugere que ele teria propriedades semelhantes às do lantânio e do actínio ; entretanto, os efeitos relativísticos podem fazer com que algumas de suas propriedades sejam diferentes daquelas esperadas de uma aplicação direta de tendências periódicas . Por exemplo, espera-se que o unbiunium tenha uma configuração de elétron de valência 2 p , em vez do s 2 d de lantânio e actínio ou s 2 g esperado da regra de Madelung , mas isso não deve afetar muito sua química. Por outro lado, reduziria significativamente sua primeira energia de ionização além do que seria esperado de tendências periódicas.
Introdução

| Vídeo externo | |
|---|---|
|
|
Os núcleos atômicos mais pesados são criados em reações nucleares que combinam dois outros núcleos de tamanhos desiguais em um; grosso modo, quanto mais desiguais os dois núcleos em termos de massa, maior a possibilidade de os dois reagirem. O material formado pelos núcleos mais pesados é transformado em alvo, que é então bombardeado pelo feixe de núcleos mais leves. Dois núcleos só podem se fundir em um se se aproximarem um do outro; normalmente, os núcleos (todos carregados positivamente) se repelem devido à repulsão eletrostática . A interação forte pode superar essa repulsão, mas apenas dentro de uma distância muito curta de um núcleo; os núcleos do feixe são, portanto, grandemente acelerados a fim de tornar essa repulsão insignificante em comparação com a velocidade do núcleo do feixe. Chegar perto sozinho não é suficiente para dois núcleos se fundirem: quando dois núcleos se aproximam, eles geralmente permanecem juntos por aproximadamente 10-20 segundos e então se separam (não necessariamente na mesma composição de antes da reação) em vez de formar um único núcleo. Se a fusão ocorrer, a fusão temporária - denominada núcleo composto - é um estado excitado . Para perder sua energia de excitação e atingir um estado mais estável, um núcleo composto fissiona ou ejeta um ou vários nêutrons , que carregam a energia. Isso ocorre em aproximadamente 10 a 16 segundos após a colisão inicial.
O feixe passa pelo alvo e atinge a próxima câmara, o separador; se um novo núcleo é produzido, ele é carregado com este feixe. No separador, o núcleo recém-produzido é separado de outros nuclídeos (o do feixe original e quaisquer outros produtos de reação) e transferido para um detector de barreira de superfície , que pára o núcleo. A localização exata do próximo impacto no detector é marcada; também marcados são sua energia e o tempo da chegada. A transferência leva cerca de 10 −6 segundos; para ser detectado, o núcleo deve sobreviver por tanto tempo. O núcleo é registrado novamente assim que sua decadência é registrada, e a localização, a energia e o tempo de decadência são medidos.
A estabilidade de um núcleo é fornecida pela interação forte. No entanto, seu alcance é muito curto; à medida que os núcleos se tornam maiores, sua influência sobre os núcleos mais externos ( prótons e nêutrons) enfraquece. Ao mesmo tempo, o núcleo é dilacerado pela repulsão eletrostática entre prótons, pois tem alcance ilimitado. Os núcleos dos elementos mais pesados são, portanto, teoricamente previstos e, até agora, observou-se que decaem principalmente por meio de modos de decaimento que são causados por tal repulsão: decadência alfa e fissão espontânea ; esses modos são predominantes para núcleos de elementos superpesados . Os decaimentos alfa são registrados pelas partículas alfa emitidas e os produtos do decaimento são fáceis de determinar antes do decaimento real; se tal decaimento ou uma série de decaimentos consecutivos produz um núcleo conhecido, o produto original de uma reação pode ser determinado aritmeticamente. A fissão espontânea, entretanto, produz vários núcleos como produtos, de modo que o nuclídeo original não pode ser determinado a partir de suas filhas.
A informação à disposição dos físicos com o objetivo de sintetizar um dos elementos mais pesados são, portanto, as informações coletadas nos detectores: localização, energia e tempo de chegada de uma partícula ao detector e de seu decaimento. Os físicos analisam esses dados e procuram concluir que ele foi de fato causado por um novo elemento e não poderia ter sido causado por um nuclídeo diferente do alegado. Freqüentemente, os dados fornecidos são insuficientes para concluir que um novo elemento foi definitivamente criado e não há outra explicação para os efeitos observados; erros na interpretação dos dados foram cometidos.
História

Elementos transactinídeos , como o unbiunium, são produzidos por fusão nuclear . Essas reações de fusão podem ser divididas em fusão "quente" e "fria", dependendo da energia de excitação do núcleo composto produzido. Em reações de fusão a quente, projéteis muito leves e de alta energia são acelerados em direção a alvos muito pesados ( actinídeos ), dando origem a núcleos compostos em altas energias de excitação (~ 40-50 MeV ) que podem fender ou evaporar vários (3 a 5) nêutrons . Em reações de fusão a frio (que usam projéteis mais pesados, normalmente do quarto período , e alvos mais leves, geralmente chumbo e bismuto ), os núcleos fundidos produzidos têm uma energia de excitação relativamente baixa (~ 10-20 MeV), o que diminui a probabilidade de que estes produtos sofrerão reações de fissão. À medida que os núcleos fundidos se resfriam ao estado fundamental , eles exigem a emissão de apenas um ou dois nêutrons. No entanto, as reações de fusão a quente tendem a produzir mais produtos ricos em nêutrons porque os actinídeos têm as maiores proporções nêutron-próton de qualquer elemento que pode ser feito atualmente em quantidades macroscópicas; atualmente é o único método para produzir os elementos superpesados do flerovium (elemento 114) em diante.
As tentativas de sintetizar os elementos 119 e 120 empurram os limites da tecnologia atual, devido às seções transversais decrescentes das reações de produção e suas provavelmente curtas meias-vidas , que devem ser da ordem de microssegundos. Elementos mais pesados, começando com o elemento 121, provavelmente teriam vida muito curta para serem detectados com a tecnologia atual, decaindo em um microssegundo antes de chegar aos detectores. Onde esta fronteira de um microssegundo de meia-vida se encontra não é conhecido, e isso pode permitir a síntese de alguns isótopos dos elementos 121 a 124, com o limite exato dependendo do modelo escolhido para prever massas de nuclídeos. Também é possível que o elemento 120 seja o último elemento alcançável com as técnicas experimentais atuais, e que os elementos de 121 em diante exigirão novos métodos.
Devido à impossibilidade atual de sintetizar elementos além do califórnio ( Z = 98) em quantidades suficientes para criar um alvo, com alvos einsteinio ( Z = 99) sendo atualmente considerados, a síntese prática de elementos além do oganesson requer projéteis mais pesados, como o titânio - 50, cromo -54, ferro -58 ou níquel -64. Isso, no entanto, tem a desvantagem de resultar em reações de fusão mais simétricas que são mais frias e menos prováveis de sucesso. Por exemplo, espera-se que a reação entre 243 Am e 58 Fe tenha uma seção transversal da ordem de 0,5 fb , várias ordens de magnitude menor do que as seções transversais medidas em reações bem-sucedidas; tal obstáculo tornaria essa reação e outras semelhantes inviáveis para a produção de unbiunium.
Tentativas de síntese
Passado
A síntese de unbiunium foi tentada pela primeira vez em 1977, bombardeando um alvo de urânio-238 com íons de cobre -65 na Gesellschaft für Schwerionenforschung em Darmstadt , Alemanha :
-
238
92você
+ 65
29Cu
→ 303
121Ubu
* → sem átomos
Nenhum átomo foi identificado.
Planejado
Atualmente, as intensidades do feixe em instalações de elementos superpesados resultam em cerca de 10 12 projéteis atingindo o alvo por segundo; isso não pode ser aumentado sem queimar o alvo e o detector, e a produção de maiores quantidades de actinídeos cada vez mais instáveis necessários para o alvo é impraticável. A equipe do Joint Institute for Nuclear Research (JINR) em Dubna está construindo uma nova fábrica de elementos superpesados (SHE-factory) com detectores aprimorados e a capacidade de trabalhar em uma escala menor, mas mesmo assim, continuando além do elemento 120 e talvez 121 seria um grande desafio. O químico, escritor e filósofo da ciência Eric Scerri observou que o desenvolvimento de novas tecnologias no campo foi impulsionado pela busca de novos elementos, de modo que a incapacidade de avançar além dos elementos 120 e 121 com as tecnologias atuais pode não necessariamente causar um pausa muito longa nas descobertas.
É possível que a era das reações de fusão-evaporação para produzir novos elementos superpesados esteja chegando ao fim devido às meias-vidas cada vez mais curtas até a fissão espontânea e a linha de gotejamento de prótons que se aproxima , de modo que novas técnicas, como reações de transferência nuclear (por Por exemplo, disparar núcleos de urânio uns contra os outros e deixá-los trocar prótons, potencialmente produzindo produtos com cerca de 120 prótons) seria necessário para alcançar os superactinídeos. Por outro lado, muitas mudanças nas técnicas foram necessárias para sintetizar elementos de transurânio , desde a captura de nêutrons (até Z = 100 ) ao bombardeio de íons de luz (até Z = 110 ) à fusão a frio (até Z = 113 ) e agora fusão a quente com 48 Ca (até Z = 118 ), sem falar na diferença essencial antes e depois do urânio entre encontrar os elementos quimicamente ou espectroscopicamente na natureza e sintetizá-los. Apesar disso, a taxa de descoberta de novos elementos manteve-se em um a cada dois anos e meio, em média, nos últimos dois séculos e meio.
A equipe da RIKEN listou a síntese do elemento 121 entre seus planos futuros. Como as seções transversais dessas reações de fusão-evaporação aumentam com a assimetria da reação, o titânio seria um projétil melhor do que o cromo para a síntese do elemento 121, embora isso necessite de um alvo de einsteínio . Isso apresenta desafios severos devido ao aquecimento significativo e danos do alvo devido à alta radioatividade do einsteinium-254, mas provavelmente seria a abordagem mais promissora para o elemento 119 com 48 feixes de Ca e possivelmente o elemento 121 com 50 feixes de Ti. Também exigiria trabalhar em uma escala menor devido à menor quantidade de 254 Es que pode ser produzida. Este trabalho em pequena escala só poderia, em um futuro próximo, ser realizado na fábrica SHE de Dubna.
-
254
99Es
+ 50
22Ti
→ 300
121Ubu
+ 4 1
0
n
-
254
99Es
+ 50
22Ti
→ 301
121Ubu
+ 3 1
0
n
Para outros elementos até 124, dado que o aumento do número de nêutrons permite chegar mais perto da camada de nêutrons fechada prevista em N = 184 que conferiria estabilidade, o uso de ferro-60 fracamente radioativo (com meia-vida de 2,6 milhões de anos ) em vez de ferro-58 estável como um projétil foi considerado. Espera-se que os isótopos 299 Ubu, 300 Ubu e 301 Ubu que poderiam ser produzidos nessas reações através dos canais 3n e 4n sejam os únicos isótopos unbiunium alcançáveis com meia-vida longa o suficiente para detecção; as seções transversais, no entanto, empurrariam os limites do que pode ser detectado atualmente. Por exemplo, a seção transversal da reação acima mencionada entre 254 Es e 50 Ti está prevista para ser da ordem de 7 fb no canal 4n, quatro vezes menor do que a menor seção transversal medida para uma reação bem-sucedida. Se tal reação for bem-sucedida, no entanto, os núcleos resultantes irão decair através de isótopos de ununênio que poderiam ser produzidos por bombardeios cruzados nas reações de 248 Cm + 51 V ou 249 Bk + 50 Ti, que serão experimentadas na RIKEN e JINR respectivamente em 2017 –2020, através de isótopos conhecidos de tennessina e moscovium sintetizados nas reações 249 Bk + 48 Ca e 243 Am + 48 Ca. A multiplicidade de estados excitados povoados pela decadência alfa de núcleos ímpares pode, no entanto, impedir casos claros de bombardeio cruzado, como foi visto na ligação controversa entre 293 Ts e 289 Mc. Espera-se que os isótopos mais pesados sejam mais estáveis; Prevê-se que 320 Ubu seja o isótopo de unbiunium mais estável, mas não há como sintetizá-lo com a tecnologia atual, pois nenhuma combinação de alvo utilizável e projétil poderia fornecer nêutrons suficientes.
Os laboratórios da RIKEN no Japão e do JINR na Rússia são os mais adequados para esses experimentos, pois são os únicos no mundo onde os tempos de feixe longos são acessíveis para reações com seções transversais baixas previstas.
Nomeação
Usando nomenclatura de Mendeleev para elementos não identificados e não descobertos , unbiunium deve ser conhecido como eka- actinium . Usando as recomendações da IUPAC de 1979 , o elemento deveria ser temporariamente chamado de unbiunium (símbolo Ubu ) até que seja descoberto, a descoberta seja confirmada e um nome permanente seja escolhido. Embora amplamente utilizadas na comunidade química em todos os níveis, de salas de aula de química a livros avançados, as recomendações são geralmente ignoradas entre os cientistas que trabalham teoricamente ou experimentalmente com elementos superpesados, que o chamam de "elemento 121", com o símbolo E121 , (121) , ou 121 .
Estabilidade nuclear e isótopos
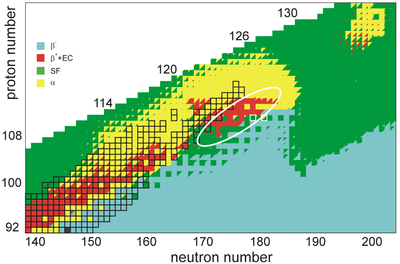
A estabilidade dos núcleos diminui muito com o aumento do número atômico após o cúrio , o elemento 96, cuja meia-vida é quatro ordens de magnitude mais longa do que a de qualquer elemento de número superior conhecido atualmente. Todos os isótopos com um número atômico acima de 101 sofrem decaimento radioativo com meia-vida de menos de 30 horas. Nenhum elemento com número atômico acima de 82 (após o chumbo ) possui isótopos estáveis. No entanto, por razões ainda não bem compreendidas, há um ligeiro aumento da estabilidade nuclear em torno dos números atômicos 110 - 114 , o que leva ao surgimento do que é conhecido na física nuclear como a " ilha de estabilidade ". Este conceito, proposto pela Universidade da Califórnia professor de Glenn Seaborg e decorrente os efeitos estabilizadores dos fechados conchas nucleares cerca de Z = 114 (ou, possivelmente, 120 , 122 , 124, ou 126) e N = 184 (e, possivelmente, também N = 228) , explica por que os elementos superpesados duram mais do que o previsto. Na verdade, a mera existência de elementos mais pesados do que o rutherfórdio pode ser atestada para efeitos de casca e a ilha de estabilidade, já que a fissão espontânea rapidamente faria com que tais núcleos se desintegrassem em um modelo que desprezasse tais fatores.
Um cálculo de 2016 das meias-vidas dos isótopos de unbiunium de 290 Ubu a 339 Ubu sugeriu que aqueles de 290 Ubu a 303 Ubu não seriam ligados e decairiam por emissão de prótons , aqueles de 304 Ubu a 314 Ubu sofreriam decaimento alfa , e os de 315 Ubu a 339 Ubu sofreriam fissão espontânea. Apenas os isótopos de 309 Ubu a 314 Ubu teriam uma vida de decaimento alfa longa o suficiente para serem detectados em laboratórios, iniciando cadeias de decaimento terminando em fissão espontânea em moscovium , tennessine ou ununennium . Isso representaria um grave problema para experimentos com o objetivo de sintetizar isótopos de unbiunium se verdadeiro, porque os isótopos cujo decaimento alfa poderia ser observado não poderiam ser alcançados por nenhuma combinação atualmente utilizável de alvo e projétil. Cálculos em 2016 e 2017 pelos mesmos autores nos elementos 123 e 125 sugerem um resultado menos sombrio, com cadeias de decaimento alfa dos nuclídeos mais alcançáveis 300–307 Ubt passando por unbiunium e levando ao bohrium ou nihonium . Também foi sugerido que o decaimento do cluster pode ser um modo de decaimento significativo em competição com o decaimento alfa e a fissão espontânea na região após Z = 120, o que representaria ainda outro obstáculo para a identificação experimental desses nuclídeos.
Química prevista
Prevê-se que o unbiunium seja o primeiro elemento de uma longa série de transição sem precedentes, chamada de superactinídeos em analogia aos primeiros actinídeos. Embora seu comportamento provavelmente não seja muito distinto do lantânio e do actínio, é provável que coloque um limite à aplicabilidade da lei periódica; após o elemento 121, espera-se que os orbitais 5g, 6f, 7d e 8p 1/2 se encham juntos devido às suas energias muito próximas e em torno dos elementos no final dos anos 150 e 160, nos 9s, 9p 1/2 e 8p 3/2 subníveis se juntam, de modo que a química dos elementos logo após 121 e 122 (o último para o qual cálculos completos foram realizados) deve ser tão semelhante que sua posição na tabela periódica seria uma questão puramente formal .
Com base no princípio de Aufbau , seria de se esperar que a subcamada de 5g começasse a se encher no átomo de unbiunium. No entanto, embora o lantânio tenha um envolvimento significativo de 4f em sua química, ele ainda não tem um elétron 4f em sua configuração de fase gasosa de estado fundamental; um atraso maior ocorre para 5f, onde nem os átomos de actínio nem de tório têm um elétron 5f, embora 5f contribua para sua química. Prevê-se que uma situação semelhante de colapso "radial" retardado pode ocorrer para o unbiunium, de modo que os orbitais de 5g não comecem a se encher até por volta do elemento 125, embora algum envolvimento químico de 5g possa começar mais cedo. Devido à falta de nódulos radiais nos orbitais 5g, análogos aos orbitais 4f, mas não aos orbitais 5f, espera-se que a posição do unbiunium na tabela periódica seja mais semelhante à do lantânio do que à do actínio entre seus congêneres, e alguns propuseram renomear os superactinídeos como "superlantanídeos" por esse motivo. A falta de nódulos radiais nos orbitais 4f contribui para seu comportamento semelhante ao núcleo na série dos lantanídeos, ao contrário dos orbitais 5f mais semelhantes à valência nos actinídeos; no entanto, a expansão relativística e a desestabilização dos orbitais de 5g devem compensar parcialmente a falta de nós radiais e, portanto, em menor extensão.
Espera-se que o unbiunium preencha o orbital 8p 1/2 devido à sua estabilização relativística, com uma configuração de [Og] 8s 2 8p 1 . No entanto, espera-se que a configuração [Og] 7d 1 8s 2 , que seria análoga ao lantânio e actínio, seja um estado de baixa excitação em apenas 0,412 eV , e a configuração esperada [Og] 5g 1 8s 2 do Madelung a regra deve estar em 2,48 eV. As configurações eletrônicas dos íons de unbiunium devem ser Ubu + , [Og] 8s 2 ; Ubu 2+ , [Og] 8s 1 ; e Ubu 3+ , [Og]. Espera-se que o elétron 8p do unbiunium tenha uma ligação muito frouxa, de modo que sua energia de ionização prevista de 4,45 eV seja menor do que a do ununennium (4,53 eV) e todos os elementos conhecidos, exceto para os metais alcalinos do potássio ao frâncio . Uma grande redução semelhante na energia de ionização também é vista em lawrencium , outro elemento que possui uma configuração s 2 p anômala devido a efeitos relativísticos .
Apesar da mudança na configuração do elétron e da possibilidade de usar a camada de 5g, não se espera que o unbiunium se comporte quimicamente de maneira muito diferente do lantânio e do actínio. Um cálculo de 2016 sobre monofluoreto de unbiunium (UbuF) mostrou semelhanças entre os orbitais de valência do unbiunium nesta molécula e aqueles de actínio em monofluoreto de actínio (AcF); em ambas as moléculas, a maior ocupada orbital molecular deverá ser não-ligação, ao contrário do superficialmente mais semelhante nihonium monofluoretado (NHF) onde ele é de ligação. Nihonium tem a configuração de elétron [Rn] 5f 14 6d 10 7s 2 7p 1 , com uma configuração de valência s 2 p. O unbiunium pode, portanto, ser um pouco como o lawrencium por ter uma configuração s 2 p anômala que não afeta sua química: as energias de dissociação da ligação, os comprimentos das ligações e as polarizabilidades da molécula de UbuF devem continuar a tendência por meio de escândio, ítrio, lantânio e actínio, todos com três elétrons de valência acima de um núcleo de gás nobre. Espera-se que a ligação Ubu-F seja forte e polarizada, assim como para os monofluoretos de lantânio e actínio.
Os electrões não-ligantes em unbiunium em UbuF se espera que sejam capazes de ligação a átomos ou grupos adicionais, resultando na formação dos unbiunium trialogenetos UbuX 3 , análoga à LaX 3 e ACX 3 . Portanto, o principal estado de oxidação do unbiunium em seus compostos deve ser +3, embora a proximidade dos níveis de energia das subcamadas de valência possa permitir estados de oxidação mais elevados, assim como nos elementos 119 e 120. O potencial de eletrodo padrão para o Ubu 3+ / O casal Ubu está previsto como -2,1 V.
Notas
Referências
Bibliografia
- Audi, G .; Kondev, FG; Wang, M .; Huang, WJ; Naimi, S. (2017). "A avaliação NUBASE2016 das propriedades nucleares" (PDF) . Chinese Física C . 41 (3): 030001. bibcode : 2017ChPhC..41c0001A . doi : 10.1088 / 1674-1137 / 41/3/030001 .
- Beiser, A. (2003). Conceitos de física moderna (6ª ed.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418 .
- Hoffman, DC ; Ghiorso, A .; Seaborg, GT (2000). The Transuranium People: The Inside Story . World Scientific . ISBN 978-1-78-326244-1.
- Kragh, H. (2018). De elementos transurânicos a superpesados: uma história de disputa e criação . Springer . ISBN 978-3-319-75813-8.
- Zagrebaev, V .; Karpov, A .; Greiner, W. (2013). "Futuro da pesquisa com elementos superpesados: quais núcleos poderiam ser sintetizados nos próximos anos?" (PDF) . Journal of Physics: Conference Series . 420 . 012001. arXiv : 1207.5700 . Bibcode : 2013JPhCS.420a2001Z . doi : 10.1088 / 1742-6596 / 420/1/012001 . ISSN 1742-6588 . S2CID 55434734 .
Leitura adicional
- Kaldor, U. (2005). "Elementos Superpesados - Química e Espectroscopia". Enciclopédia de Química Computacional . doi : 10.1002 / 0470845015.cu0044 . ISBN 978-0-470-84501-1.
- Seaborg, GT (1968). "Elementos além de 100, situação atual e perspectivas futuras" . Revisão Anual da Ciência Nuclear . 18 : 53-15. Bibcode : 1968ARNPS..18 ... 53S . doi : 10.1146 / annurev.ns.18.120168.000413 .
