Ácido tricloroacético - Trichloroacetic acid
|
|
|||

|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Ácido tricloroacético |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100.000.844 |
||
| KEGG | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 2 H Cl 3 O 2 | |||
| Massa molar | 163,38 g · mol −1 | ||
| Aparência | Incolor a branco, sólido cristalino | ||
| Odor | afiado, pungente | ||
| Densidade | 1,63 g / cm 3 | ||
| Ponto de fusão | 57 a 58 ° C (135 a 136 ° F; 330 a 331 K) | ||
| Ponto de ebulição | 196 a 197 ° C (385 a 387 ° F; 469 a 470 K) | ||
| 1000g / 100mL | |||
| Pressão de vapor | 1 mmHg (51,1 ° C) | ||
| Acidez (p K a ) | 0,66 | ||
| -73,0 · 10 −6 cm 3 / mol | |||
| Estrutura | |||
| 3,23 D | |||
| Perigos | |||
| Corrosivo ( C ) Perigoso para o meio ambiente ( N ) |
|||
| Frases R (desatualizado) | R35 , R50 / 53 | ||
| Frases S (desatualizado) |
(S1 / 2) , S26 , S36 / 37/39 , S45 , S60 , S61 |
||
| NFPA 704 (diamante de fogo) | |||
| Dose ou concentração letal (LD, LC): | |||
|
LD 50 ( dose mediana )
|
5000 mg / kg por via oral em ratos | ||
| NIOSH (limites de exposição à saúde dos EUA): | |||
|
PEL (permitido)
|
Nenhum | ||
|
REL (recomendado)
|
TWA 1 ppm (7 mg / m 3 ) | ||
|
IDLH (perigo imediato)
|
WL | ||
| Compostos relacionados | |||
|
Ácidos cloroacéticos relacionados
|
Ácido cloroacético Ácido dicloroacético |
||
|
Compostos relacionados
|
Ácido acético Ácido trifluoroacético Ácido tribromoacético |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
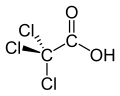
O ácido tricloroacético ( TCA ; TCAA ; também conhecido como ácido tricloroetanóico ) é um análogo do ácido acético no qual os três átomos de hidrogênio do grupo metil foram todos substituídos por átomos de cloro . Os sais e ésteres do ácido tricloroacético são chamados de tricloroacetatos .
Síntese
É preparado pela reação de cloro com ácido acético na presença de um catalisador adequado , como fósforo vermelho . Esta reação é halogenação Hell-Volhard-Zelinsky .
-
CH
3 COOH + 3 Cl
2 → CCl
3 COOH + 3 HCl
Outra rota para o ácido tricloroacético é a oxidação do tricloroacetaldeído.
Usar
É amplamente utilizado em bioquímica para a precipitação de macromoléculas, como proteínas , DNA e RNA . O TCA e o DCA são usados em tratamentos cosméticos (como peelings químicos e remoção de tatuagens ) e como medicação tópica para quimioablação de verrugas , incluindo verrugas genitais . Também pode matar células normais. É considerado seguro para uso com essa finalidade durante a gravidez. O sal de sódio (tricloroacetato de sódio) foi usado como herbicida a partir dos anos 1950, mas os reguladores o removeram do mercado no final dos anos 1980 e início dos 1990.
História
A descoberta do ácido tricloroacético por Jean-Baptiste Dumas em 1839 forneceu um exemplo notável para a teoria de evolução lenta dos radicais orgânicos e valências. A teoria era contrária às crenças de Jöns Jakob Berzelius , dando início a uma longa disputa entre Dumas e Berzelius.