Óxido de estanho (II) - Tin(II) oxide
|
|

|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Óxido de estanho (II)
|
|
| Outros nomes
Óxido estanoso, monóxido de estanho
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ECHA InfoCard |
100.040.439 |
| Número EC | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| SnO | |
| Massa molar | 134,709 g / mol |
| Aparência | pó preto ou vermelho quando anidro, branco quando hidratado |
| Densidade | 6,45 g / cm 3 |
| Ponto de fusão | 1.080 ° C (1.980 ° F; 1.350 K) |
| insolúvel | |
| −19,0 · 10 −6 cm 3 / mol | |
| Estrutura | |
| tetragonal | |
| Termoquímica | |
|
Entropia molar padrão ( S |
56 J · mol −1 · K −1 |
| −285 kJ · mol −1 | |
| Perigos | |
| Ficha de dados de segurança | ICSC 0956 |
| Ponto de inflamação | Não inflamável |
| NIOSH (limites de exposição à saúde dos EUA): | |
|
PEL (permitido)
|
Nenhum |
|
REL (recomendado)
|
TWA 2 mg / m 3 |
|
IDLH (perigo imediato)
|
WL |
| Compostos relacionados | |
|
Outros ânions
|
Sulfeto de estanho Seleneto de estanho Telureto de estanho |
|
Outros cátions
|
Monóxido de carbono Monóxido de silício Óxido de germânio (II) Óxido de chumbo (II) |
| Dióxido de estanho | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O óxido de estanho (II) ( óxido estanoso ) é um composto com a fórmula SnO. É composto de estanho e oxigênio, onde o estanho tem o estado de oxidação de +2. Existem duas formas, uma forma azul-escura estável e uma forma vermelha metaestável .
Preparação e reações
O SnO preto-azulado pode ser produzido aquecendo o hidrato de óxido de estanho (II), SnO · xH 2 O (x <1) precipitado quando um sal de estanho (II) reage com um hidróxido alcalino como o NaOH.
O SnO vermelho metaestável pode ser preparado por aquecimento suave do precipitado produzido pela ação da amônia aquosa sobre um sal de estanho (II).
O SnO pode ser preparado como uma substância pura em laboratório, por aquecimento controlado de oxalato de estanho (II) ( oxalato estanoso ) na ausência de ar ou sob uma atmosfera de CO 2 . Este método também é aplicado à produção de óxido ferroso e óxido manganoso .
- SnC 2 O 4 · 2H 2 O → SnO + CO 2 + CO + 2 H 2 O
O óxido de estanho (II) queima no ar com uma chama verde fraca para formar SnO 2 .
- 2 SnO + O 2 → 2 SnO 2
Quando aquecido em uma atmosfera inerte, inicialmente ocorre desproporcionamento dando Sn metal e Sn 3 O 4 que posteriormente reage para dar SnO 2 e Sn metal.
- 4SnO → Sn 3 O 4 + Sn
- Sn 3 O 4 → 2SnO 2 + Sn
SnO é anfotérico , dissolvendo-se em ácido forte para dar sais de estanho (II) e em base forte para dar estanitos contendo Sn (OH) 3 - . Pode ser dissolvido em soluções de ácido forte para dar os complexos iônicos Sn (OH 2 ) 3 2+ e Sn (OH) (OH 2 ) 2 + , e em soluções menos ácidas para dar Sn 3 (OH) 4 2+ . Observe que os estanitos anidros, por exemplo, K 2 Sn 2 O 3 , K 2 SnO 2, também são conhecidos. SnO é um agente redutor e acredita-se que reduza o cobre (I) a aglomerados metálicos na fabricação do chamado "vidro de cobre rubi".
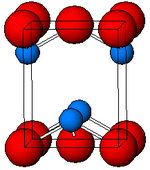
Estrutura
Preto, α-SnO adota a estrutura de camada tetragonal de PbO contendo quatro átomos de estanho piramidais quadrados coordenados. Esta forma é encontrada na natureza como a rara romarquita mineral . A assimetria é geralmente simplesmente atribuída a um par solitário estericamente ativo; no entanto, cálculos de densidade de elétrons mostram que a assimetria é causada por uma interação anti-ligação dos orbitais Sn (5s) e O (2p). A estrutura eletrônica e química do par solitário determinam a maioria das propriedades do material.
A não estequiometria foi observada em SnO.
O gap eletrônico foi medido entre 2,5 eV e 3eV.
Usos
O uso dominante do óxido estanoso é como um precursor na fabricação de outros compostos ou sais de estanho, normalmente divalentes. O óxido estanoso também pode ser empregado como agente redutor e na criação de vidro rubi . Tem um uso menor como um catalisador de esterificação .
O óxido de cério (III) na forma cerâmica , junto com o óxido de estanho (II) (SnO), é usado para iluminação com luz ultravioleta.

