Ácido Fósforo - Phosphorous acid
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
ácido fosfônico
|
|||
| Outros nomes
Óxido de diidroxifosfina
Diidroxi (oxo) - λ 5- fosfano |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard |
100.033.682 |
||
| KEGG | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| H 3 PO 3 | |||
| Massa molar | 81,99 g / mol | ||
| Aparência | sólido branco deliquescente |
||
| Densidade | 1,651 g / cm 3 (21 ° C) | ||
| Ponto de fusão | 73,6 ° C (164,5 ° F; 346,8 K) | ||
| Ponto de ebulição | 200 ° C (392 ° F; 473 K) (decompõe-se) | ||
| 310 g / 100 mL | |||
| Solubilidade | solúvel em etanol | ||
| Acidez (p K a ) | 1,1, 6,7 | ||
| −42,5 · 10 −6 cm 3 / mol | |||
| Estrutura | |||
| pseudo-tetraédrico | |||
| Perigos | |||
| Riscos principais | irritante para a pele | ||
| Ficha de dados de segurança | http://www.sigmaaldrich.com/MSDS/ | ||
| Frases R (desatualizado) | 22-35 | ||
| Frases S (desatualizado) | 26-36 / 37 / 39-45 | ||
| NFPA 704 (diamante de fogo) | |||
| Compostos relacionados | |||
|
Compostos relacionados
|
H 3 PO 4 (ou seja, PO (OH) 3 ) H 3 PO 2 (ou seja, H 2 PO (OH)) |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
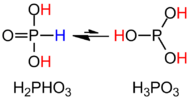
O ácido fosforoso é o composto descrito pela fórmula H 3 PO 3 . Este ácido é diprótico (prontamente ioniza dois prótons), não triprótico como pode ser sugerido por esta fórmula. O ácido fosforoso é um intermediário na preparação de outros compostos de fósforo. Os derivados orgânicos do ácido fosforoso, compostos com a fórmula RPO 3 H 2 , são chamados de ácidos fosfônicos .
Nomenclatura e tautomerismo
H 3 PO 3 é mais claramente descrito com a fórmula estrutural HPO (OH) 2 . No estado sólido, HP (O) (OH) 2 é tetraédrico com uma ligação P – H de 1,32 pm, uma ligação P = O mais curta de 148 pm e duas ligações P – O (H) mais longas de 154 pm. Esta espécie existe em equilíbrio com um tautômero extremamente menor P (OH) 3 . A IUPAC recomenda que este último seja denominado ácido fosforoso, enquanto a forma di-hidroxilada é denominada ácido fosfônico. Apenas os compostos de fósforo reduzidos são soletrados com uma terminação "ous".
Outros oxiácidos importantes do fósforo são o ácido fosfórico (H 3 PO 4 ) e o ácido hipofosforoso (H 3 PO 2 ). Os ácidos de fósforo reduzidos estão sujeitos a tautomerismo semelhante envolvendo mudanças de H entre O e P.
Preparação
HPO (OH) 2 é o produto da hidrólise de seu anidrido ácido :
- P 4 O 6 + 6 H 2 O → 4 HPO (OH) 2
(Uma relação análoga conecta H 3 PO 4 e P 4 O 10 ).
Em escala industrial, o ácido é preparado por hidrólise de tricloreto de fósforo com água ou vapor:
- PCl 3 + 3 H 2 O → HPO (OH) 2 + 3 HCl
Reações
Propriedades ácido-base
O ácido fosforoso tem um ap K a no intervalo de 1,26-1,3.
- HP (O) (OH) 2 → HP (O) 2 (OH) - + H + p K a = 1,3
É um ácido diprótico , o íon hidrogenofosfito, HP (O) 2 (OH) - é um ácido fraco:
- HP (O) 2 (OH) - → HPO2−
3 + H + p K a = 6,7
A base conjugada HP (O) 2 (OH) - é chamada de fosfito de hidrogênio, e a segunda base conjugada, HPO2−
3, é o íon fosfito . (Observe que as recomendações da IUPAC são hidrogênio fosfonato e fosfonato, respectivamente).
O átomo de hidrogênio ligado diretamente ao átomo de fósforo não é facilmente ionizável. Os exames de química muitas vezes testam a apreciação dos alunos sobre o fato de que nem todos os três átomos de hidrogênio são ácidos em condições aquosas, em contraste com o H 3 PO 4 .
Propriedades redox
No aquecimento a 200 ° C, o ácido fosfórico é desproporcional ao ácido fosfórico e fosfina :
- 4 H 3 PO 3 → 3 H 3 PO 4 + PH 3
Esta reação é usada para preparações em escala laboratorial de PH 3 .
O ácido fosfórico oxida lentamente no ar em ácido fosfórico.
Tanto o ácido fosforoso quanto suas formas desprotonadas são bons agentes redutores , embora não necessariamente de reação rápida. Eles são oxidados em ácido fosfórico ou seus sais. Reduz soluções de cátions de metais nobres aos metais. Quando o ácido fosforoso é tratado com uma solução fria de cloreto mercúrico , forma-se um precipitado branco de cloreto mercúrico:
- H 3 PO 3 + 2 HgCl 2 + H 2 O → Hg 2 Cl 2 + H 3 PO 4 + 2 HCl
O cloreto de mercúrio é reduzido ainda mais pelo ácido fosforoso a mercúrio no aquecimento ou em repouso:
- H 3 PO 3 + Hg 2 Cl 2 + H 2 O → 2 Hg + H 3 PO 4 + 2 HCl
Como um ligante
Após o tratamento com metais de configuração d6, o ácido fosforoso é conhecido por coordenar como o tautômero P (OH) 3 raro . Exemplos incluem Mo (CO) 5 (P (OH) 3 ) e [Ru (NH 3 ) 4 (H 2 O) (P (OH) 3 )] 2+ .
Usos
O uso mais importante do ácido fosfórico (ácido fosfônico) é a produção de fosfito de chumbo básico , que é um estabilizador no PVC e polímeros clorados relacionados.
É utilizado na produção de estabilizador básico de PVC fosfonato de chumbo, ácido aminometileno fosfônico e ácido hidroxietano difosfônico. Também é usado como um forte agente redutor e na produção de ácido fosforoso, fibras sintéticas, pesticidas organofosforados e o agente de tratamento de água altamente eficiente ATMP .
Os materiais ferrosos , incluindo o aço, podem ser protegidos de alguma forma promovendo a oxidação ("ferrugem") e, em seguida, convertendo a oxidação em um metalofosfato usando ácido fosfórico e posteriormente protegidos por revestimento de superfície. (Veja: Passivação (química) ).
Derivados orgânicos
O nome IUPAC (principalmente orgânico) é ácido fosfônico . Essa nomenclatura é comumente reservada para derivados substituídos , ou seja, grupo orgânico ligado ao fósforo, não simplesmente um éster. Por exemplo, (CH 3 ) PO (OH) 2 é " ácido metilfosfônico ", que pode, evidentemente, formar ésteres de " fosfonato de metila " .
Referências
Leitura adicional
- Holleman, AF; Wiberg, E. (2001). Química Inorgânica . San Diego: Academic Press. ISBN 0-12-352651-5.
- Corbridge., DEC (1995). Fósforo: Um Esboço de sua Química, Bioquímica e Tecnologia (5ª ed.). Amsterdã: Elsevier. ISBN 0-444-89307-5.
- Lee, JD (3 de janeiro de 2008). Química Inorgânica Concisa . Imprensa da Universidade de Oxford. ISBN 978-81-265-1554-7.