Regra Oddo-Harkins - Oddo–Harkins rule
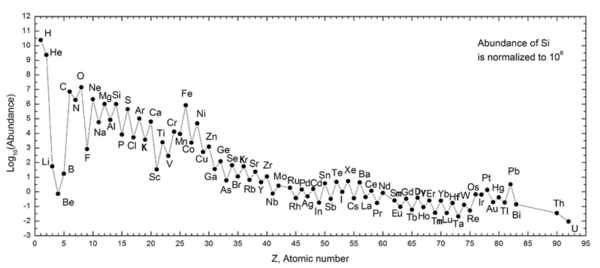
A regra Oddo-Harkins sustenta que um elemento com um número atômico par (como carbono : elemento 6) é mais abundante do que ambos os elementos com os números atômicos ímpares adjacentemente maiores e menores (como boro : elemento 5 e nitrogênio : elemento 7, respectivamente, para carbono ). Esta tendência da abundância dos elementos químicos foi relatada pela primeira vez por Giuseppe Oddo em 1914 e William Draper Harkins em 1917.
Definição
Todos os átomos maiores que o hidrogênio são formados em estrelas ou supernovas por meio da nucleossíntese , quando a gravidade , a temperatura e a pressão atingem níveis altos o suficiente para fundir prótons e nêutrons . Prótons e nêutrons formam o núcleo atômico , que acumula elétrons para formar átomos. O número de prótons no núcleo, chamado número atômico, identifica exclusivamente um elemento químico.
A regra de Oddo-Harkins argumenta que elementos com números atômicos ímpares têm um próton desemparelhado e são mais propensos a capturar outro, aumentando assim seu número atômico. É possível que em elementos com números atômicos pares, prótons estejam emparelhados, com cada membro do par equilibrando o spin do outro; mesmo a paridade, portanto, aumenta a estabilidade do núcleo.
Exceções à regra
Este postulado, no entanto, não se aplica ao elemento mais abundante e simples do universo da tabela periódica dos elementos: hidrogênio , com um número atômico de 1. Isso pode ser porque, em sua forma ionizada, um átomo de hidrogênio torna-se um único próton. , do qual é teorizado ter sido um dos primeiros grandes conglomerados de quarks durante o segundo inicial do período de inflação do Universo , após o Big Bang . Nesse período, quando a inflação do universo o havia trazido de um ponto infinitesimal para aproximadamente o tamanho de uma galáxia moderna, as temperaturas na sopa de partículas caíram de mais de um trilhão de graus para vários milhões de graus.
Esse período permitiu a fusão de prótons únicos e núcleos de deutério para formar núcleos de hélio e lítio, mas era muito curto para que cada íon H + fosse reconstituído em elementos mais pesados. Nesse caso, o hélio, número atômico 2, continua sendo a contraparte par do hidrogênio. Assim, o hidrogênio neutro - ou hidrogênio emparelhado com um elétron , o único leptão estável - constituiu a vasta maioria das porções não aniquiladas restantes da matéria após a conclusão da inflação.
Outra exceção à regra é o berílio , que, mesmo com um número atômico par (4), é mais raro do que os elementos de número ímpar de cada lado dele ( lítio e boro ). Isso ocorre porque a maior parte do lítio, berílio e boro do universo são feitos por fragmentação de raios cósmicos , não a nucleossíntese estelar comum , e o berílio tem apenas um isótopo estável, fazendo com que fique em atraso em abundância em relação aos seus vizinhos, que têm dois isótopos.
Relação com a fusão
O padrão surge após a fusão descontrolada em uma estrela massiva moribunda, na qual uma dada massa dos vários elementos pares e ímpares é formada por uma massa ligeiramente maior dos elementos hidrogênio e hélio. Os elementos recém-formados são ejetados na explosão e eventualmente se juntam ao resto do meio interestelar da galáxia .
Quando a fusão ocorre com núcleos cada vez maiores, a entrada de energia torna-se cada vez maior e a saída de energia torna-se cada vez menor; o ponto em que esses dois potenciais se encontram na tabela periódica dos elementos é em algum lugar em torno dos elementos ferro , número atômico 26 e níquel , número atômico 28. A fusão de elementos mais pesados do que isso não libera energia e, portanto, a probabilidade de encontrar discrepâncias na regra Oddo-Harkins torna-se inferior.
Veja também
- Número atômico
- Hidrogênio
- Inflação cósmica
- Lista de elementos por estabilidade de isótopos
- Fusão nuclear
- Química nuclear
