Acetilida - Acetylide
O acetileto se refere a compostos químicos com as fórmulas químicas MC≡CH e MC≡CM, onde M é um metal. O termo é usado vagamente e pode referir-se a acetiletos substituídos tendo a estrutura geral RC≡CM (onde R é uma cadeia lateral orgânica ). Os acetilidos são reagentes na síntese orgânica . O acetileto de cálcio comumente chamado de carboneto de cálcio é o principal composto comercializado.
Estrutura e ligação
Acetiletos de metais alcalinos e alcalino-terrosos da fórmula geral MC≡CM são compostos de fase Zintl semelhantes a sal , contendo C2−
2íons. A evidência para este caráter iônico pode ser vista na hidrólise pronta desses compostos para formar acetileno e óxidos metálicos, há também alguma evidência para a solubilidade de C2−
2íons na amônia líquida. O C2−
2íon tem um estado fundamental de casca fechada de 1 Σ+
g, tornando-o isoeletrônico a uma molécula neutra de N 2 , o que pode proporcionar alguma estabilidade.
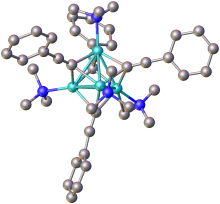
Acetiletos análogos preparados a partir de outros metais, particularmente metais de transição , apresentam caráter covalente e estão invariavelmente associados aos seus centros metálicos. Isso pode ser visto em sua estabilidade geral à água (como acetileto de prata , acetileto de cobre ) e aplicações químicas radicalmente diferentes.
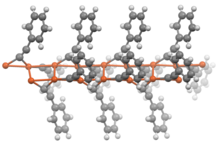
Os acetiletos da fórmula geral RC≡CM (em que R = H ou alquil) geralmente apresentam propriedades semelhantes aos seus análogos duplamente substituídos. Na ausência de ligantes adicionais, os acetiletos de metal adotam estruturas poliméricas em que os grupos acetileto são ligantes de ponte .
Preparação
Os alcinos terminais são ácidos fracos :
- RC≡CH + R ″ M ⇌ R ″ H + RC≡CM
Para gerar acetiletos a partir de acetileno e alcinos, é necessário o uso de superbases organometálicas ou inorgânicas em solventes que são menos ácidos do que o alcino terminal. Nos primeiros estudos, amônia líquida foi empregada, mas os solventes etéreos são mais comuns.
Amida de lítio , LiHMDS ou reagentes de organolítio , como butil-lítio , são frequentemente usados para formar acetiletos de lítio:
Acetiletos de sódio ou potássio podem ser preparados a partir de vários reagentes inorgânicos (como amida de sódio ) ou de seus metais elementares, frequentemente em temperatura ambiente e pressão atmosférica.
O acetileto de cobre (I) pode ser preparado passando acetileno através de uma solução aquosa de cloreto de cobre (I) devido a um equilíbrio de baixa solubilidade . Da mesma forma, os acetiletos de prata podem ser obtidos a partir do nitrato de prata .
O carboneto de cálcio é preparado aquecendo o carbono com cal ( óxido de cálcio ) a aproximadamente 2.000 ° C. Um processo semelhante é usado para produzir carboneto de lítio .
Reações
Os acetiletos do tipo RC 2 M são amplamente usados em alcinilações em química orgânica . Eles são nucleófilos que se somam a uma variedade de substratos eletrofílicos e insaturados. Uma aplicação clássica é a reação Favorskii .
Ilustrativa é a sequência mostrada abaixo, propiolato de etila é desprotonado por n- butil - lítio para dar o acetileto correspondente. Este acetileto adiciona ao centro carbonil da ciclopentanona . O processamento hidrolítico libera o álcool alcinílico.
Reações de acoplamento
Os acetilidos às vezes são intermediários nas reações de acoplamento . Os exemplos incluem o acoplamento Sonogashira , o acoplamento Cadiot-Chodkiewicz , o acoplamento Glaser e o acoplamento Eglinton .
Perigos
Algumas acetilidas são notoriamente explosivas. A formação de acetiletos representa um risco no manuseio de acetileno gasoso na presença de metais como mercúrio , prata ou cobre , ou ligas com seu alto teor ( latão , bronze , solda de prata ).
Veja também
- Etinil
- Radical etinila
- Diatomic carbono (C neutro 2 )
- Acetilenodiol

![{\ displaystyle {\ ce {{HC \! {\ equiv} \! CH} + {\ overset {butyllithium} {BuLi}} -> [{\ ce {THF}}] [- 78 ^ {\ circ} { \ ce {C}}] {Li - \! {\ equiv} \! - H} + BuH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae261811e4519409e7516a7a6c4576ec44871845)
