MG132 - MG132
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
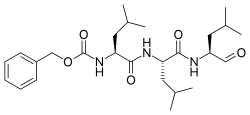
Benzil [( 2S ) -4-metil-1 - {[( 2S ) -4-metil-1 - {[( 2S ) -4-metil-1-oxopentan-2-il] amino} -1- oxopentan-2-il] amino} -1-oxopentan-2-il] carbamato |
|
| Outros nomes
N -benziloxicarbonil- L -leucil- L -leucil- L -leucinal
Z-Leu-Leu-Leu-al |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 26 H 41 N 3 O 5 | |
| Massa molar | 475,630 g · mol −1 |
| Aparência | Sólido branco |
| Solubilidade | 100 mM em EtOH e DMSO |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
MG132 é um inibidor de proteassoma potente, reversível e permeável às células ( K i = 4 nM). Pertence à classe dos aldeídos peptídicos sintéticos. Ele reduz a degradação de proteínas conjugadas com ubiquitina em células de mamíferos e cepas permeáveis de levedura pelo complexo 26S, sem afetar suas atividades de ATPase ou isopeptidase . MG132 ativa a quinase c-Jun N-terminal (JNK1), que inicia a apoptose . MG132 também inibe a ativação de NF-κB com um IC 50 de 3 μM e evita a clivagem da β-secretase .
Mecanismo Molecular
Existem vários inibidores que podem entrar prontamente na célula e inibir seletivamente a via degradativa. Inclui aldeídos peptídicos , como Cbz-leu-leu-leucinal (MG132), Cbz-leu-leu-norvalinal ( MG115 ) e acetil-leu-leu-norleucinal ( ALLN ). Estes são análogos de substrato e potentes inibidores do estado de transição da atividade semelhante à quimiotripsina da maquinaria do proteassoma . Os aldeídos peptídicos também são conhecidos por inibir certas proteases de cisteína lisossomal e, portanto, as calpaínas MG132 podem não ser inibidoras exclusivas da via proteassomal.
