Homólise (química) - Homolysis (chemistry)
Em química , homólise (do grego ὅμοιος, homoios, "igual" e λύσις, lusis, "afrouxamento") ou fissão homolítica é a dissociação de ligação química de uma ligação molecular por um processo em que cada um dos fragmentos (um átomo ou molécula) retém um dos elétrons originalmente ligados. Durante a fissão homolítica de uma molécula neutra com um número par de elétrons, dois radicais livres serão gerados. Ou seja, os dois elétrons envolvidos na ligação original são distribuídos entre as duas espécies de fragmentos. A energia envolvida neste processo é chamada de energia de dissociação de ligações (BDE). A clivagem da ligação também é possível por um processo chamado heterólise .
Dissociação ligação de energia é definida como a "entalpia (por mole) necessária para romper uma dada ligação de uma entidade molecular específica por ruptura homolítica," simbolizado como D . A energia de dissociação da ligação depende da força da ligação, que é determinada por fatores relacionados à estabilidade das espécies radicais resultantes.
Por causa da energia relativamente alta necessária para quebrar ligações desta maneira, a homólise ocorre principalmente em certas circunstâncias:
- Luz (ou seja, radiação ultravioleta )
- Aquecer
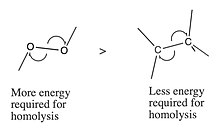
- Certas ligações intramoleculares, como a ligação O – O de um peróxido , são fracas o suficiente para se dissociar espontaneamente de maneira homolítica com uma pequena quantidade de calor.
- Altas temperaturas na ausência de oxigênio ( pirólise ) podem induzir a eliminação homolítica de compostos de carbono .
- A maioria das ligações homolisa a temperaturas acima de 200 ° C.
Além disso, em alguns casos, a pressão pode induzir a formação de radicais. Essas condições excitam os elétrons para o próximo orbital molecular mais alto, criando assim um Orbital Molecular de Ocupação Única (ou SOMO).
Adenosilcobalamina é o cofator que cria o radical desoxiadenosil por clivagem homolítica de uma ligação cobalto-carbono em reações catalisadas por metilmalonil-CoA mutase , isobutiril-CoA mutase e enzimas relacionadas. Isso desencadeia reações de rearranjo na estrutura de carbono dos substratos sobre os quais as enzimas atuam.
Fatores que impulsionam a homólise
A clivagem homolítica é impulsionada pela capacidade de uma molécula de absorver energia da luz ou do calor e da energia de dissociação da ligação ( entalpia ). Se a espécie radical for mais capaz de estabilizar o radical livre, a energia do orbital molecular ocupado individualmente será reduzida, assim como a energia de dissociação da ligação. A energia de dissociação da ligação é determinada por vários fatores:
-
Eletro-negatividade
- Átomos menos eletronegativos são melhores estabilizadores de radicais, o que significa que uma ligação entre dois átomos eletronegativos terá um BDE mais alto do que uma molécula semelhante com dois átomos menos eletronegativos.
-
Polarizabilidade
- Quanto maior a nuvem de elétrons, melhor o átomo pode estabilizar o radical (isto é, o iodo é muito polarizável e um estabilizador de radical).
- Hibridização Orbital
- O caractere s de um orbital está relacionado à proximidade dos elétrons do núcleo. No caso de um radical, o caractere s se relaciona mais especificamente com o quão próximo o elétron está do núcleo. Os radicais diminuem em estabilidade à medida que estão mais próximos do núcleo, porque a afinidade eletrônica do orbital aumenta. Como regra geral, as hibridizações que minimizam o caráter s aumentam a estabilidade dos radicais e diminuem a energia de dissociação da ligação (ou seja, a hibridização sp3 é mais estabilizadora).
-
Ressonância
- Os radicais podem ser estabilizados pela doação de carga negativa por ressonância, ou seja, [deslocamento de elétrons].
-
Hiperconjugação
- Os radicais de carbono são estabilizados por hiperconjugação, o que significa que mais carbonos substituídos são mais estáveis e, portanto, têm BDEs mais baixos.
- Em 2005, Gronert propôs uma hipótese alternativa envolvendo o alívio da cepa estérica do grupo substituinte (em oposição ao paradigma antes aceito, que sugere que os radicais de carbono são estabilizados por meio de grupos alquil).
- O Efeito Captodativo
- Os radicais podem ser estabilizados por um efeito sinérgico de substituintes do grupo de retirada de elétrons e do grupo de doação de elétrons .
- Os grupos de retirada de elétrons geralmente contêm orbitais π * vazios que têm baixa energia e se sobrepõem ao SOMO, criando dois novos orbitais: um que é mais baixo em energia e se estabiliza no radical, e um orbital vazio de alta energia. Da mesma forma, os orbitais doadores de elétrons se combinam com o radical SOMO, permitindo que um par solitário diminua sua energia e o radical entre no novo orbital de maior energia. Essa interação é estabilizadora.