Paraplegia espástica hereditária - Hereditary spastic paraplegia
| Paraplegia espástica hereditária | |
|---|---|
| Especialidade |
Neurologia |
A paraplegia espástica hereditária ( HSP ) é um grupo de doenças hereditárias cuja principal característica é um distúrbio progressivo da marcha. A doença se apresenta com rigidez progressiva ( espasticidade ) e contração nos membros inferiores. A HSP também é conhecida como paraparesia espástica hereditária, paraplegia espástica familiar, doença do assentamento francês, doença de Strumpell ou doença de Strumpell-Lorrain. Os sintomas são resultado da disfunção de longos axônios da medula espinhal . As células afetadas são os neurônios motores primários ; portanto, a doença é uma doença do neurônio motor superior . A HSP não é uma forma de paralisia cerebral , embora fisicamente possa aparecer e se comportar da mesma forma que a diplegia espástica . A origem da HSP é diferente da paralisia cerebral. Apesar disso, alguns dos mesmos medicamentos antiespasticidade usados na paralisia cerebral espástica às vezes são usados para tratar os sintomas de HSP.
A HSP é causada por defeitos no transporte de proteínas, proteínas estruturais, proteínas de manutenção de células, lipídios e outras substâncias através da célula. As fibras nervosas longas (axônios) são afetadas porque as longas distâncias tornam as células nervosas particularmente sensíveis aos defeitos desses mecanismos mencionados.
A doença foi descrita pela primeira vez em 1880 pelo neurologista alemão Adolph Strümpell . Foi descrito mais extensivamente em 1888 por Maurice Lorrain, um médico francês. Devido à sua contribuição na descrição da doença, ainda é chamada de doença de Strümpell-Lorrain nos países de língua francesa. O termo paraplegia espástica hereditária foi cunhado por Anita Harding em 1983.
sinais e sintomas
Os sintomas dependem do tipo de HSP herdado. A principal característica da doença é a espasticidade progressiva nos membros inferiores devido à disfunção do trato piramidal . Isso também resulta em reflexos rápidos, reflexos extensores plantares, fraqueza muscular e distúrbios vesicais variáveis. Além disso, entre os principais sintomas da HSP estão também marcha anormal e dificuldade para caminhar, diminuição da sensação vibratória nos tornozelos e parestesia . Indivíduos com HSP podem apresentar fadiga extrema associada ao sistema nervoso central e distúrbios neuromusculares, que podem ser incapacitantes. Os sintomas iniciais são geralmente dificuldade de equilíbrio, arrancada do dedo do pé ou tropeço. Os sintomas de HSP podem começar em qualquer idade, desde a infância até mais de 60 anos. Se os sintomas começarem durante a adolescência ou mais tarde, a perturbação espástica da marcha geralmente progride ao longo de muitos anos. Eventualmente, podem ser necessários bengalas, andadores e cadeiras de rodas, embora algumas pessoas nunca precisem de dispositivos de assistência. A deficiência tem sido descrita como progredindo mais rapidamente nas formas de início na idade adulta.
Mais especificamente, os pacientes com a forma pura autossômica dominante de HSP revelam movimentos faciais e extraoculares normais. Embora a contração da mandíbula possa ser rápida em indivíduos mais velhos, não há distúrbio da fala ou dificuldade de engolir. O tônus e a força dos músculos das extremidades superiores são normais. Nas extremidades inferiores, o tônus muscular é aumentado nos isquiotibiais, quadríceps e tornozelos. A fraqueza é mais notável no iliopsoas , tibial anterior e, em menor extensão, nos músculos isquiotibiais . Na forma complexa da doença, sintomas adicionais estão presentes. Estes incluem: neuropatia periférica , amiotrofia , ataxia , deficiência intelectual , ictiose , epilepsia , neuropatia óptica , demência , surdez ou problemas com a fala, engolir ou respirar.
Anita Harding classificou o HSP de forma pura e complicada. A HSP pura se apresenta com espasticidade nos membros inferiores, associada a distúrbios neurogênicos da bexiga , bem como falta de sensibilidade à vibração ( palhipestesia ). Por outro lado, a HSP é classificada como complexa quando a espasticidade dos membros inferiores é combinada com qualquer sintoma neurológico adicional.
Essa classificação é subjetiva e os pacientes com HSPs complexas às vezes são diagnosticados como portadores de ataxia cerebelar com espasticidade, deficiência intelectual (com espasticidade) ou leucodistrofia . Alguns dos genes listados abaixo foram descritos em outras doenças além da HSP anteriormente. Portanto, alguns genes-chave se sobrepõem a outros grupos de doenças.
Idade de início
No passado, a HSP foi classificada como de início precoce, começando na primeira infância ou mais tarde na idade adulta. A idade de início tem dois pontos no máximo aos 2 anos e por volta dos 40 anos. Novas descobertas sugerem que um início mais precoce leva a uma duração mais longa da doença, sem perda de deambulação ou necessidade de uso de cadeira de rodas. Isso também foi descrito anteriormente, que as formas de início tardio evoluem mais rapidamente.
Causa
HSP é um grupo de doenças genéticas. Segue-se em geral de herança regras e pode ser herdada em uma autossômica dominante , autossômica recessiva ou ligada ao X recessiva maneira. O modo de herança envolvido tem um impacto direto nas chances de herdar o distúrbio. Mais de 70 genótipos foram descritos e mais de 50 loci genéticos foram associados a esta condição. Dez genes foram identificados com herança autossômica dominante. Um deles, SPG4, é responsável por ~ 50% de todos os casos geneticamente resolvidos, ou aproximadamente 25% de todos os casos de HSP. Doze genes são conhecidos por serem herdados de forma autossômica recessiva. Coletivamente, este último grupo é responsável por cerca de 1/3 dos casos.
A maioria dos genes alterados tem função conhecida, mas para alguns a função ainda não foi identificada. Todos eles estão listados na lista de genes abaixo, incluindo seu modo de herança. Alguns exemplos são spastin (SPG4) e paraplegin (SPG7) são AAA ATPases.
Genótipos
Os genes são designados SPG (Spastic gait gene). As localizações dos genes estão no formato: cromossomo - braço (curto ou p : longo ou q ) - número da banda. Essas designações são apenas para os genes humanos. As localizações podem (e provavelmente irão) variar em outros organismos. Apesar do número de genes conhecidos por estarem envolvidos nesta condição, cerca de 40% dos casos ainda não tiveram sua causa identificada. Na tabela abaixo SPG? é usado para indicar um gene que foi associado a HSP, mas ainda não recebeu uma designação oficial de gene HSP.
| Genótipo | OMIM | Símbolo do gene | Locus gênico | Herança | Idade de início | Outros nomes e características |
|---|---|---|---|---|---|---|
| SPG1 | 303350 | L1CAM | Xq28 | Recessivo ligado ao X | Cedo | Síndrome MASA |
| SPG2 | 312920 | PLP1 | Xq22.2 | Recessivo ligado ao X | Variável | Doença de Pelizaeus-Merzbacher |
| SPG3A | 182600 | ATL1 | 14q22.1 | Dominante autossômico | Cedo | Doença de Strumpell (este Wiki) |
| SPG4 | 182601 | SPAST | 2p22.3 | Dominante autossômico | Variável | |
| SPG5A | 270800 | CYP7B1 | 8q12.3 | Autossômica recessiva | Variável | |
| SPG6 | 600363 | NIPA1 | 15q11.2 | Dominante autossômico | Variável | |
| SPG7 | 607259 | SPG7 | 16q24.3 | Dominante autossômico | Variável | |
| SPG8 | 603563 | KIAA0196 | 8q24.13 | Dominante autossômico | Adulto | |
| SPG9A | 601162 | ALDH18A1 | 10q24.1 | Dominante autossômico | Adolescência | Catarata com neuronopatia motora, baixa estatura e anormalidades esqueléticas |
| SPG9B | 616586 | ALDH18A1 | 10q24.1 | Autossômica recessiva | Cedo | |
| SPG10 | 604187 | KIF5A | 12q13.3 | Dominante autossômico | Cedo | |
| SPG11 | 604360 | SPG11 | 15q21.1 | Autossômica recessiva | Variável | |
| SPG12 | 604805 | RTN2 | 19q13.32 | Dominante autossômico | Cedo | |
| SPG13 | 605280 | HSP60 | 2q33.1 | Dominante autossômico | Variável | |
| SPG14 | 605229 | ? | 3q27 – q28 | Autossômica recessiva | Adulto | |
| SPG15 | 270700 | ZFYVE26 | 14q24.1 | Autossômica recessiva | Cedo | |
| SPG16 | 300266 | ? | Xq11.2 | Recessivo ligado ao X | Cedo | |
| SPG17 | 270685 | BSCL2 | 11q12.3 | Dominante autossômico | Adolescência | |
| SPG18 | 611225 | ERLIN2 | 8p11.23 | Autossômica recessiva | Cedo | |
| SPG19 | 607152 | ? | 9q | Dominante autossômico | Início adulto | |
| SPG20 | 275900 | SPG20 | 13q13.3 | Autossômica recessiva | Início precoce | Síndrome de Troyer |
| SPG21 | 248900 | ACP33 | 15q22.31 | Autossômica recessiva | Início precoce | Síndrome MAST |
| SPG22 | 300523 | SLC16A2 | Xq13.2 | Recessivo ligado ao X | Início precoce | Síndrome de Allan – Herndon – Dudley |
| SPG23 | 270750 | RIPK5 | 1q32.1 | Autossômica recessiva | Início precoce | Síndrome de Lison |
| SPG24 | 607584 | ? | 13q14 | Autossômica recessiva | Início precoce | |
| SPG25 | 608220 | ? | 6q23 – q24.1 | Autossômica recessiva | Adulto | |
| SPG26 | 609195 | B4GALNT1 | 12q13.3 | Autossômica recessiva | Início precoce | |
| SPG27 | 609041 | ? | 10q22.1 – q24.1 | Autossômica recessiva | Variável | |
| SPG28 | 609340 | DDHD1 | 14q22.1 | Autossômica recessiva | Início precoce | |
| SPG29 | 609727 | ? | 1p31.1 – p21.1 | Dominante autossômico | Adolescência | |
| SPG30 | 610357 | KIF1A | 2q37.3 | Autossômica recessiva | Adolescência | |
| SPG31 | 610250 | REEP1 | 2p11.2 | Dominante autossômico | Início precoce | |
| SPG32 | 611252 | ? | 14q12 – q21 | Autossômica recessiva | Infância | |
| SPG33 | 610244 | ZFYVE27 | 10q24.2 | Dominante autossômico | Adulto | |
| SPG34 | 300750 | ? | Xq24 – q25 | Recessivo ligado ao X | Adolescente / Adulto | |
| SPG35 | 612319 | FA2H | 16q23.1 | Autossômica recessiva | Infância | |
| SPG36 | 613096 | ? | 12q23 – q24 | Dominante autossômico | Adolescente / Adulto | |
| SPG37 | 611945 | ? | 8p21.1 – q13.3 | Dominante autossômico | Variável | |
| SPG38 | 612335 | ? | 4p16 – p15 | Dominante autossômico | Adolescente / Adulto | |
| SPG39 | 612020 | PNPLA6 | 19p13.2 | Autossômica recessiva | Infância | |
| SPG41 | 613364 | ? | 11p14.1 – p11.2 | Dominante autossômico | Adolescência | |
| SPG42 | 612539 | SLC33A1 | 3q25.31 | Dominante autossômico | Variável | |
| SPG43 | 615043 | C19orf12 | 19q12 | Autossômica recessiva | Infância | |
| SPG44 | 613206 | GJC2 | 1q42.13 | Autossômica recessiva | Infância / adolescente | |
| SPG45 | 613162 | NT5C2 | 10q24.32 – q24.33 | Autossômica recessiva | Infância | |
| SPG46 | 614409 | GBA2 | 9p13.3 | Autossômica recessiva | Variável | |
| SPG47 | 614066 | AP4B1 | 1p13.2 | Autossômica recessiva | Infância | |
| SPG48 | 613647 | AP5Z1 | 7p22.1 | Autossômica recessiva | 6ª década | |
| SPG49 | 615041 | TECPR2 | 14q32.31 | Autossômica recessiva | Infância | |
| SPG50 | 612936 | AP4M1 | 7q22.1 | Autossômica recessiva | Infância | |
| SPG51 | 613744 | AP4E1 | 15q21.2 | Autossômica recessiva | Infância | |
| SPG52 | 614067 | AP4S1 | 14q12 | Autossômica recessiva | Infância | |
| SPG53 | 614898 | VPS37A | 8p22 | Autossômica recessiva | Infância | |
| SPG54 | 615033 | DDHD2 | 8p11.23 | Autossômica recessiva | Infância | |
| SPG55 | 615035 | C12orf65 | 12q24.31 | Autossômica recessiva | Infância | |
| SPG56 | 615030 | CYP2U1 | 4q25 | Autossômica recessiva | Infância | |
| SPG57 | 615658 | TFG | 3q12.2 | Autossômica recessiva | Cedo | |
| SPG58 | 611302 | KIF1C | 17p13.2 | Autossômica recessiva | Nas primeiras duas décadas | Ataxia espástica 2 |
| SPG59 | 603158 | USP8 | 15q21.2 | ?Autossômica recessiva | Infância | |
| SPG60 | 612167 | WDR48 | 3p22.2 | ?Autossômica recessiva | Infância | |
| SPG61 | 615685 | ARL6IP1 | 16p12.3 | Autossômica recessiva | Infância | |
| SPG62 | 615681 | ERLIN1 | 10q24.31 | Autossômica recessiva | Infância | |
| SPG63 | 615686 | AMPD2 | 1p13.3 | Autossômica recessiva | Infância | |
| SPG64 | 615683 | ENTPD1 | 10q24.1 | Autossômica recessiva | Infância | |
| SPG66 | 610009 | ARSI | 5q32 | ? Autossômica dominante | Infância | |
| SPG67 | 615802 | PGAP1 | 2q33.1 | Autossômica recessiva | Infância | |
| SPG68 | 609541 | KLC2 | 11q13.1 | Autossômica recessiva | Infância | Síndrome de SPOAN |
| SPG69 | 609275 | RAB3GAP2 | 1q41 | Autossômica recessiva | Infância | Síndrome de Martsolf , síndrome Warburg Micro |
| SPG70 | 156560 | MARS | 12q13 | ? Autossômica dominante | Infância | |
| SPG71 | 615635 | ZFR | 5p13.3 | ?Autossômica recessiva | Infância | |
| SPG72 | 615625 | REEP2 | 5q31 | Autossômica recessiva; autossômico dominante |
Infância | |
| SPG73 | 616282 | CPT1C | 19q13.33 | Dominante autossômico | Adulto | |
| SPG74 | 616451 | IBA57 | 1q42.13 | Autossômica recessiva | Infância | |
| SPG75 | 616680 | MAG | 19q13.12 | Autossômica recessiva | Infância | |
| SPG76 | 616907 | CAPN1 | 11q13 | Autossômica recessiva | Adulto | |
| SPG77 | 617046 | FARS2 | 6p25 | Autossômica recessiva | Infância | |
| SPG78 | 617225 | ATP13A2 | 1p36 | Autossômica recessiva | Adulto | Síndrome de Kufor – Rakeb |
| SPG79 | 615491 | UCHL1 | 4p13 | Autossômica recessiva | Infância | |
| HSNSP | 256840 | CCT5 | 5p15.2 | Autossômica recessiva | Infância | Neuropatia sensorial hereditária com paraplegia espástica |
| SPG? | SERAC1 | 6q25.3 | Juvenil | Síndrome MEGDEL | ||
| SPG? | 605739 | KY | 3q22.2 | Autossômica recessiva | Infância | |
| SPG? | PLA2G6 | 22q13.1 | Autossômica recessiva | Infância | ||
| SPG? | ATAD3A | 1p36.33 | Dominante autossômico | Infância | Síndrome de Harel-Yoon | |
| SPG? | KCNA2 | 1p13.3 | Dominante autossômico | Infância | ||
| SPG? | Granulin | 17q21.31 | ||||
| SPG? | POLR3A | 10q22.3 | Autossômica recessiva |
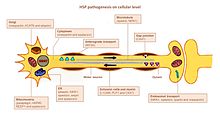
Fisiopatologia
A principal característica da HSP é uma degeneração axonal dependente do comprimento. Estes incluem os tratos corticospinais cruzados e não cruzados para as pernas e fascículo grácil . O trato espinocerebelar está menos envolvido. Os corpos celulares neuronais de axônios em degeneração são preservados e não há evidência de desmielinização primária . A perda de células do corno anterior da medula espinhal é observada em alguns casos. Os gânglios da raiz dorsal, raízes posteriores e nervos periféricos não são afetados diretamente.
A HSP afeta várias vias nos neurônios motores. Muitos genes foram identificados e associados ao HSP. Ainda é um desafio definir com precisão os principais atores em cada uma das vias afetadas, principalmente porque muitos genes têm funções múltiplas e estão envolvidos em mais de uma via.
Pathfinding axônio
Pathfinding é importante para o crescimento do axônio até o destino correto (por exemplo, outra célula nervosa ou um músculo). Significativo para esse mecanismo é o gene L1CAM, uma glicoproteína de superfície celular da superfamília das imunoglobulinas. Mutações que levam à perda de função em L1CAM também são encontradas em outras síndromes ligadas ao X. Todos esses distúrbios apresentam comprometimento do trato corticoespinhal (uma característica marcante da HSP). L1CAM participa de um conjunto de interações, ligando outras moléculas L1CAM, bem como moléculas de adesão de células extracelulares, integrinas e proteoglicanos ou proteínas intracelulares como anquirinas.
O defeito pathfinding ocorre por meio da associação de L1CAM com neuropilina-1 . A neuropilina-1 interage com as proteínas Plexina-A para formar o complexo receptor Semaforina-3A . A semaforina-a3A é então liberada na medula espinhal ventral para desviar os neurônios corticospinais da medula espinhal / junção medular. Se o L1CAM não funcionar corretamente devido a uma mutação, os neurônios cortiocospinhais não são direcionados para a posição correta e o comprometimento ocorre.
Metabolismo lipídico
Os axônios no sistema nervoso central e periférico são revestidos com um isolamento, a camada de mielina, para aumentar a velocidade de propagação do potencial de ação. A mielinização anormal no SNC é detectada em algumas formas de hsp HSP. Vários genes foram associados à malformação de mielina, nomeadamente PLP1, GFC2 e FA2H. As mutações alteram a composição, espessura e integridade da mielina.
O retículo endoplasmático (RE) é a principal organela para a síntese de lipídios. Mutações em genes que codificam proteínas que têm um papel na formação da morfologia do ER e no metabolismo lipídico foram ligadas a HSP. Mutações em ATL1 , BSCL2 e ERLIN2 alteram a estrutura do ER, especificamente a rede tubular e a formação de junções de três vias nos túbulos do ER. Muitos genes mutados estão ligados ao metabolismo lipídico anormal. O efeito mais prevalente é sobre o ácido araquidônico ( CYP2U1 ) e o metabolismo do colesterol ( CYP7B1 ), a atividade da fosfolipase (DDHD1 e DDHD2), a formação de gangliosídeos ( B4GALNT-1 ) e o equilíbrio entre o metabolismo de carboidratos e gorduras (SLV33A1).
Tráfego endossomal
Os neurônios absorvem substâncias de seu ambiente por endocitose. As vesículas endocíticas se fundem aos endossomos para liberar seu conteúdo. Existem três compartimentos principais que têm tráfego de endossomos: Golgi de / para endossomos; membrana plasmática de / para endossomos iniciais (por meio de endossomos de reciclagem) e endossomos tardios para lisossomos. A disfunção do tráfego endossomal pode ter consequências graves em neurônios motores com axônios longos, conforme relatado no HSP. Mutações em AP4B1 e KIAA0415 estão ligadas a distúrbios na formação de vesículas e tráfego de membrana, incluindo a absorção seletiva de proteínas nas vesículas. Ambos os genes codificam proteínas que interagem com várias outras proteínas e interrompem as vias secretoras e endocíticas.
Função mitocondrial
As disfunções mitocondriais têm sido associadas a distúrbios neurológicos degenerativos e de desenvolvimento. Apenas alguns genes HSP codificam proteínas mitocondriais. Duas proteínas residentes mitocondriais são mutadas em HSP: paraplegina e chaperonina 60. A paraplegina é uma metaloprotease m-AAA da membrana mitocondrial interna. Ele funciona na montagem ribossômica e no controle de qualidade da proteína. A atividade da chaperonina 60 prejudicada leva a um controle de qualidade mitocondrial prejudicado. Dois genes DDHD1 e CYP2U1 mostraram alteração da arquitetura mitocondrial em fibroblastos de pacientes. Esses genes codificam enzimas envolvidas no metabolismo dos ácidos graxos.
Diagnóstico
O diagnóstico inicial de HSPs depende da história familiar, da presença ou ausência de sinais adicionais e da exclusão de outras causas não genéticas de espasticidade, sendo esta última particularmente importante em casos esporádicos.
A ressonância magnética cerebral e espinhal é um procedimento importante realizado para descartar outras condições neurológicas frequentes, como esclerose múltipla , mas também para detectar anormalidades associadas, como atrofia cerebelar ou do corpo caloso , bem como anormalidades na substância branca . O diagnóstico diferencial de HSP também deve excluir a diplegia espástica que se apresenta com efeitos diários quase idênticos e até mesmo é tratável com medicamentos semelhantes, como baclofeno e cirurgia ortopédica ; às vezes, essas duas condições podem parecer e parecer tão semelhantes que a única diferença percebida pode ser a natureza hereditária da HSP versus a natureza explicitamente não hereditária da diplegia espástica (no entanto, ao contrário da diplegia espástica e outras formas de paralisia cerebral espástica , a HSP não pode ser confiável tratada com rizotomia dorsal seletiva ).
A confirmação final do diagnóstico de HSP só pode ser fornecida através da realização de testes genéticos direcionados para mutações genéticas conhecidas .
Classificação
As paraplegias espásticas hereditárias podem ser classificadas com base nos sintomas; modo de herança; a idade de início do paciente; os genes afetados; e vias bioquímicas envolvidas.
Tratamento
Não se conhece nenhum tratamento específico que possa prevenir, retardar ou reverter a HSP. As terapias disponíveis consistem principalmente no manejo médico sintomático e na promoção do bem-estar físico e emocional. A terapêutica oferecida a pacientes com HSP inclui:
- Baclofen - um relaxante muscular voluntário para relaxar os músculos e reduzir o tônus. Isso pode ser administrado por via oral ou intratecal. (Estudos em HSP)
- Tizanidina - para tratar espasmos noturnos ou intermitentes (estudos disponíveis)
- Diazepam e clonazepam - para diminuir a intensidade dos espasmos
- Cloreto de oxibutinina - um relaxante muscular involuntário e agente espasmolítico, usado para reduzir a espasticidade da bexiga em pacientes com problemas de controle da bexiga
- Tartarato de tolterodina - um relaxante muscular involuntário e agente espasmolítico, usado para reduzir a espasticidade da bexiga em pacientes com problemas de controle da bexiga
- Cro System - para reduzir a hiperatividade muscular (estudos existentes para espasticidade)
- Toxina botulínica - para reduzir a hiperatividade muscular (estudos existentes para pacientes com HSP)
- Antidepressivos (como inibidores seletivos da recaptação da serotonina, antidepressivos tricíclicos e inibidores da monoamina oxidase) - para pacientes com depressão clínica
- Fisioterapia - para restaurar e manter a capacidade de movimento; para reduzir o tônus muscular; para manter ou melhorar a amplitude de movimento e mobilidade; para aumentar a força e coordenação; para evitar complicações, como articulações congeladas, contraturas ou escaras.
Prognóstico
Embora a HSP seja uma condição progressiva, o prognóstico para indivíduos com HSP varia muito. Afeta principalmente as pernas, embora possa haver algum envolvimento da parte superior do corpo em alguns indivíduos. Alguns casos são gravemente incapacitantes, enquanto outros são menos incapacitantes e são compatíveis com uma vida produtiva e plena. A maioria dos indivíduos com HSP tem uma expectativa de vida normal .
Epidemiologia
Em todo o mundo, a prevalência de todas as paraplegias espásticas hereditárias combinadas é estimada em 2 a 6 em 100.000 pessoas. Um estudo norueguês com mais de 2,5 milhões de pessoas publicado em março de 2009 encontrou uma taxa de prevalência de HSP de 7,4 / 100.000 da população - uma taxa mais alta, mas na mesma faixa dos estudos anteriores. Não foram encontradas diferenças nas taxas relacionadas ao sexo, e a idade média de início foi de 24 anos. Nos Estados Unidos , a Paraplegia Espástica Hereditária é listada como uma "doença rara" pelo Office of Rare Diseases (ORD) do National Institutes of Health, o que significa que a doença afeta menos de 200.000 pessoas na população dos EUA.
Referências
Leitura adicional
- GeneReviews / NCBI / NIH / UW entrada em Spastic Paraplegia 3A
- Entrada do GeneReviews / NCBI / NIH / UW na Visão geral da Paraplegia Espástica Hereditária
- Warner, Tom (janeiro-fevereiro de 2007). "Hereditary Spastic Paraplegia" (PDF) . Avanços em Neurociência Clínica e Reabilitação . 6 (6): 16–17.
links externos
| Classificação | |
|---|---|
| Fontes externas |